Enferm Bras 2022;21(5):596-604
ARTIGO ORIGINAL
Reutilização do
detergente enzimático: avaliação do impacto da contaminação microbiana na
limpeza de gastroscópios
Maria Letícia de Miranda Mati, D.Sc.*, Adriana Cristina de
Oliveira**
*Pós-graduanda
(Doutorado) pelo Programa de Pós-Graduação em Enfermagem da Escola de
Enfermagem da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG,
**Coordenadora do Núcleo de Estudo e Pesquisa em Infecção Relacionada ao Cuidar
em Saúde (NEPIRCS/CNPq), Professora Titular do Departamento de Enfermagem Básica
da Escola de Enfermagem da UFMG, Belo Horizonte, MG
Recebido em 10 de março de
2022; Aceito em 20 de maio de 2022.
Correspondência: Maria Letícia de Miranda Mati, Rua Ouro Preto, 1371 Santo Agostinho 30170-041 Belo
Horizonte MG
Maria
Letícia de Miranda Mati: mleticiamati@gmail.com
Adriana
Cristina de Oliveira: adrianacoliveira@gmail.com
Este
estudo é parte integrante da dissertação de mestrado intitulada “Reutilização
do detergente enzimático: avaliação do impacto da contaminação microbiana da
solução na efetividade da limpeza de aparelhos endoscópicos gastrointestinais”.
Resumo
Introdução: A reutilização do detergente
enzimático é uma prática utilizada no processamento dos endoscópios
gastrointestinais. Objetivo: Avaliar o impacto da contaminação
microbiana da solução de detergente enzimático, quando reutilizada, na limpeza
de gastroscópios. Métodos: Estudo transversal
realizado a partir da análise microbiológica de endoscópios e da solução de
detergente enzimático utilizada na limpeza destes equipamentos. As alíquotas
coletadas a partir dos aparelhos e da solução enzimática foram homogeneizadas,
filtradas em membrana Millipore® 0,45 µm e as membranas, sobrepostas em meio de
cultura Ágar Tríptico de Soja. Procedeu-se a análise quantitativa e a
identificação presuntiva dos microrganismos, por meio de métodos
bioquímico-fisiológico. Resultados: Análise da solução enzimática
identificou carga microbiana após o primeiro e terceiro uso de 152 UFC/ml e 315
UFC/ml respectivamente. Nos canais do aparelho imerso no terceiro uso do
detergente enzimático, a contaminação microbiana aumentou quando comparada
àquela após uso clínico. Pseudomonas spp. foi recuperada em todos os canais
após imersão na solução enzimática, mesmo naqueles em que não havia sido
identificada antes da imersão. Conclusão: Este estudo reforça o risco do
reuso do detergente enzimático, uma vez que há possibilidade do aumento da
carga microbiana e da contaminação dos dispositivos com microrganismos que
anteriormente não haviam sido recuperados.
Palavras-chave: segurança do paciente; endoscópios;
detergentes; saneantes; controle de infecção.
Abstract
Reuse of enzymatic detergent: evaluation of the impact of microbial
contamination on gastroscopes cleaning
Introduction: The reuse of enzymatic detergent is a practice used
in the processing of gastrointestinal endoscopes. Objective: To evaluate
the impact of microbial contamination of the enzymatic detergent solution, when
reused, on the gastroscope cleaning. Methods: Cross-sectional study carried out
from the microbiological analysis of endoscopes and the enzymatic detergent
solution used to clean this equipment. The aliquots collected from the
apparatus and the enzyme solution were homogenized, subjected to Millipore®
0.45 µm membrane filtration and the membranes were superimposed on Soy Triptych
Agar culture medium. Quantitative analysis and presumptive identification of
microorganisms was carried out using biochemical-physiological methods. Results:
The analysis of the enzymatic solution identified microbial load after the
first and third use of 152 CFU / ml and 315 CFU / ml respectively. In the
device channels immersed in the third use of the enzymatic detergent, microbial
contamination increased compared to that after clinical use. Pseudomonas spp.
it was recovered in all channels after immersion in the enzyme solution, even
in those in which it had not been identified before immersion. Conclusion:
This study reinforces the risk of reusing the enzymatic detergent, since there
is the possibility of an increase in the microbial load and contamination of
devices with microorganisms that had not previously been recovered.
Keywords: patient safety; endoscopes; detergents; sanitizing
products; microbiology; infection control.
Resumen
Reutilización de detergente enzimático: evaluación del impacto de la contaminación microbiana en la limpieza
de gastroscopios
Introducción: La reutilización
de detergente enzimático es una práctica utilizada en el procesamiento
de endoscopios gastrointestinales.
Objetivo: Evaluar el
impacto de la contaminación
microbiana de la solución
de detergente enzimático, cuando se reutiliza, sobre la limpieza del
gastroscopio. Métodos: Estudio
transversal realizado a partir del análisis microbiológico de endoscopios
y la solución detergente
enzimático utilizada para la limpieza
de este equipo. Las alícuotas
recogidas del aparato y la solución de enzima fueron homogeneizadas y sometidas a filtración
en membrana Millipore® 0,45 µm y las
membranas se superpusieron sobre medio
de cultivo de Agar Triptych de soja. El análisis cuantitativo y la identificación presuntiva de microorganismos se realizaron
mediante métodos bioquímico-fisiológicos. Resultados: El análisis de la solución enzimática identificó
carga microbiana después del
primer y tercer uso de 152 UFC / ml y 315 UFC / ml
respectivamente. En los canales del dispositivo sumergidos en el
tercer uso del detergente
enzimático, la contaminación
microbiana aumentó en comparación con la posterior al uso clínico. Pseudomonas spp. se recuperó en todos los canales después
de la inmersión en la solución
enzimática, incluso en aquellos
en los que no se había identificado antes de
la inmersión. Conclusión: Este estudio refuerza el riesgo
de reutilizar el detergente enzimático, ya que existe la posibilidad de un aumento de la carga microbiana y contaminación
de los dispositivos con microorganismos que no habían
sido previamente recuperados.
Palabras-clave: seguridad del
paciente; endoscopios; detergentes; saneantes; control de infecciones.
Introdução
Nos
últimos anos, falhas no processamento de endoscópios gastrointestinais foram
responsáveis por surtos que causaram inúmeras mortes em todo mundo [1,2,3]. Ao
processar tais equipamentos, é importante que sejam respeitadas não só as
etapas estabelecidas como também as características dos produtos empregados na
limpeza desses dispositivos.
Um dos
produtos amplamente utilizado no processamento dos endoscópios
gastrointestinais é o detergente enzimático. Este tem como função a
desagregação da matéria orgânica dos dispositivos após o uso clínico. A
reutilização do detergente enzimático, utilizado na etapa da limpeza, no
entanto, é desaconselhada por instituições nacionais e internacionais, sob pena
da perda da eficácia proposta pelo produto [4,5,6]. Contudo, sabe-se que na
prática clínica tal solução é reutilizada por diversas vezes para imersão de
diferentes endoscópios, sobretudo em países em desenvolvimento e com escassos
recursos financeiros.
Essa
prática tem como objetivo reduzir custos no processamento dos equipamentos sem
considerar o impacto do reuso da solução frente à qualidade do processamento
dos dispositivos, uma vez que o detergente enzimático não possui propriedade
bactericida [5,6,7].
Diante
deste fato, propôs-se avaliar o impacto da contaminação microbiana da solução
de detergente enzimático, quando reutilizada, na limpeza de gastroscópios.
Métodos
Tratou-se
de estudo de delineamento transversal realizado no serviço de endoscopia
digestiva de um hospital universitário público e geral de Belo Horizonte, Minas
Gerais, local em que se deu a fase de coleta das amostras e no Laboratório de
Microbiologia Oral e de Anaeróbios do Instituto de Ciências Biológicas da
Universidade Federal de Minas Gerais, onde ocorreram as análises dos materiais
coletados.
Neste
estudo foram incluídos para análise dois equipamentos endoscópicos utilizados
para realização dos exames de endoscopia digestiva alta e a solução de
detergente enzimático utilizada na limpeza destes equipamentos.
A partir
dos aparelhos endoscópicos, foram coletadas amostras dos canais de ar/água e
biópsia antes e após imersão do dispositivo na solução de detergente
enzimático. O primeiro aparelho correspondeu ao primeiro uso da solução
enzimática e o segundo equipamento foi imerso no terceiro uso da solução.
Para a
coleta das alíquotas foram injetados 20 mL de água bi-destilada no orifício proximal de cada canal do aparelho
endoscópico e o material foi coletado na porção distal do equipamento em
frascos estéreis [8]. Todo material a ser analisado foi acondicionado em caixa
térmica refrigerada e transportado para o laboratório.
Para as
análises microbiológicas as amostras foram então homogeneizadas em vórtex por
um minuto e, em seguida, para cada material coletado, 1 mL
da alíquota foi inoculado em 9 mL de caldo Letheem Modificado, acrescido de Tween
80. Posteriormente, essas soluções foram filtradas separadamente, utilizando-se
o método de filtração por membrana Millipore® com porosidade de 0,45 µm e 47 mm
de diâmetro.
Cada
membrana foi sobreposta em uma placa de petri
contendo em meio de cultura Triptic Agar Soy (TSA) e incubada a 37°C ± 2°C por 24 a 48h. Colônias
representativas de distintos morfotipos foram
isoladas em TSA e armazenadas em freezer a -80ºC, em caldo Brucella
acrescido de glicerol (na concentração final de 10%) para a identificação
futura.
A
coloração de Gram foi utilizada para identificação presuntiva dos
microrganismos. Cocos Gram positivos foram semeados em Ágar Manitol e incubados
a 37°C ± 2°C por 24 horas. As amostras que apresentaram crescimento em Ágar
Manitol foram submetidas a provas bioquímicas de catalase, coagulase e DNAse. Os bastonetes Gram negativos foram semeados em caldo
de glicose a 1% com indicador de Andrade e incubados a 37°C ± 2°C por 24 horas.
Os microrganismos não fermentadores de glicose foram semeados em Ágar Cetrimide a 37°C ± 2°C por 24 horas. Aqueles que
fermentaram a glicose foram submetidos aos testes de Rugai modificados.
O
crescimento microbiano apresentado nas placas está expresso por UFC/mL.
Este
estudo foi aprovado pelo Comitê de Ética e Pesquisa do Conselho Nacional de
Saúde (Processo: CAAE-67493417.1.0000.5149).
Resultados
Os
valores da carga microbiana presente no detergente enzimático foram crescentes
à medida que a solução foi reutilizada. Os números encontrados após o primeiro
e terceiro uso foram 152UFC/ml e 315 UFC/ml respectivamente.
Em
relação aos aparelhos endoscópicos, houve maior contaminação microbiana no
canal de biópsia após o primeiro uso da solução de detergente enzimático e nos
canais de ar/água e biópsia após imersão no terceiro uso da solução (Figura 1).
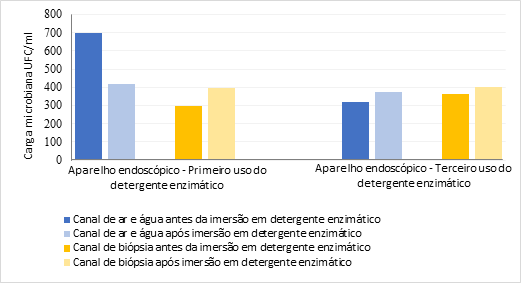
Figura 1 - Carga microbiana recuperada nos
canais dos aparelhos endoscópicos antes e após imersão em detergente
enzimático. Belo Horizonte, 2018
O canal
de biópsia do aparelho endoscópico imerso no primeiro uso do detergente
enzimático teve carga microbiana 33,8% maior após imersão. Os canais de ar/água
e biópsia do aparelho imerso no terceiro reuso do detergente apresentaram
aumento da contaminação microbiana em 17,5% e 10,5%, respectivamente.
No canal
de ar/água do aparelho endoscópico imerso no primeiro uso do detergente
enzimático foi evidenciado somente cocos Gram positivo logo após o uso clínico.
Após ele ser imerso na solução, recuperou-se desse canal Pseudomonas ssp. Tal microrganismo foi recuperado ainda em todos os
canais do aparelho endoscópico antes e a pós a imersão no terceiro reuso da
solução e em todas as alíquotas coletadas a partir do detergente, exceto
naquela tomada antes do uso do produto, onde não houve crescimento bacteriano.
Discussão
Os
achados deste estudo são corroborados por outras pesquisas relacionadas à
reutilização de detergente enzimático [9], que apontam para um acúmulo de
microrganismos nesta solução de limpeza quando reutilizada, comprometendo o
processamento dos dispositivos nela imersos [10].
A elevada
carga microbiana da solução pode contribuir para a aderência de microrganismos
nos endoscópios durante a imersão e tornar a contaminação do equipamento maior
que a inicial. Assim, não se alcançariam os objetivos da limpeza, que são
reduzir o nível dos resíduos nos canais dos aparelhos endoscópicos a valores
abaixo de 6,4 mg/cm² de proteína, 2,2 mg/cm² de hemoglobina, 1,8 mg/cm² de hidratos
de carbono, e 4-log10 UFC/cm² de microrganismos [11]. A reutilização do
detergente enzimático pode favorecer, ainda, a formação de biofilme [12].
Estudos demonstram que muitos produtos de limpeza e de desinfecção utilizados
no processamento de endoscópios gastrointestinais não o removem em sua
totalidade, o que possibilitaria a transmissão de microrganismos [13]. Além
disso, bactérias que fazem parte do biofilme apresentam resistência a
antimicrobianos e desinfetantes até 1.000 vezes maior do que quando em
suspensão [14].
A
recuperação de Pseudomonas ssp. em todos os canais
analisados após imersão em detergente, inclusive naquele onde ela não havia
sido isolada logo após o uso clínico, é um importante indício de que os
endoscópios, ao serem imersos em soluções de DE
contaminadas, ficam susceptíveis à contaminação por microrganismos com elevado
potencial patogênico.
Pseudomonas
ssp. podem apresentar resistência a múltiplos
antibióticos, e devido à gravidade das infecções que causam (sepse, colangite,
abcessos, pancreatites, pneumonia) e às opções limitadas de tratamento, merecem
atenção a fim de prevenir surtos após procedimentos endoscópicos [15].
Como
limitação deste estudo pode-se incluir o pequeno tamanho da amostra, dois
aparelhos endoscópicos. Entretanto, a investigação realizada neste trabalho
apresenta elevado grau de dificuldade, que já foi evidenciado em outras
pesquisas com técnica semelhante e que apresentaram resultados importantes.
Alfa, 2018, ao avaliar a recuperação de microrganismos em um processamento
automático caso o canal de elevador de um duodenoscópio
não estivesse posicionado de maneira correta, demonstrou seus achados
fundamentada na análise de apenas dois equipamentos e concluiu que
microrganismos de importância epidemiológica podem sobreviver nos equipamentos
caso o elevador não esteja posicionado corretamente [16].
Portanto,
ainda que os resultados deste estudo tenham se fundamentado na análise de dois
equipamentos, foi possível demostrar de que o reuso da solução de detergente
enzimático representa um alto risco para o processamento dos endoscópios
gastrointestinais, comprometendo a segurança do procedimento realizado pelo
aumento da possibilidade de transmissão de microrganismos entre pacientes e de
possíveis surtos. Adicionalmente, infere-se que o impacto causado pela
reutilização do detergente enzimático sobre o aparelho endoscópico e a
segurança do paciente, seja ainda maior do que o relatado, considerando que os
serviços de endoscopia, em sua grande maioria, têm como prática o seu uso acima
de três reusos.
Nesse
sentido, o presente resultado é indiscutível como alerta aos serviços e
instituições de que o risco do reuso é bastante elevado quando comparado à
segurança do descarte da solução em único uso, conforme indicado pelas diversas
sociedades internacionais que preconizam boas práticas para o processamento dos
endoscópios [4,5].
Conclusão
Este
estudo reforça o risco do reuso do detergente enzimático, uma vez que existe a
possibilidade do aumento da carga microbiana no equipamento após a imersão no
produto e da contaminação dos aparelhos endoscópicos com microrganismos
adicionais à contaminação do equipamento após seu uso clínico.
A
reutilização do detergente enzimático é uma realidade nos países
subdesenvolvidos e em desenvolvimento, onde muitos serviços são limitados ao
processamento manual e a adesão aos protocolos estabelecidos podem ser
insuficientes.
Os
achados deste estudo trazem evidências do risco atribuído ao reuso de soluções
de limpeza como potenciais focos de surtos relacionados a procedimentos endocópicos, reforçando que, quando uma parte do processo
de limpeza não é efetiva, todo o processamento poderá estar em risco,
comprometendo a segurança do paciente.
Conflitos
de interesse
Não há
conflito de interesse
Fontes
de financiamento
Apoio
financeiro da Fundação de Amparo à Pesquisa de Minas Gerais, Processo APQ-02025-15,
Brasil.
Contribuição
dos autores
Concepção
e desenho da pesquisa:
Mati MLM, Oliveira AC; Coleta de dados: Mati MLM; Análise e interpretação dos dados: Mati MLM, Oliveira AC; Análise estatística: Mati MLM, Oliveira AC; Redação do manuscrito: Mati MLM, Oliveira AC; Revisão crítica do manuscrito
quanto ao conteúdo intelectual importante: Mati
MLM, Oliveira AC
Referências
- Humphries RM, Yang S, Kim S, Muthusamy VR, Russell D, et al.
Duodenoscope-related outbreak of a carbapenem-resistant Klebsiella pneumoniae
identified using advanced molecular diagnostics. Clin Infect Dis 2017;65:1159-66. doi: 10.1093/cid/cix527 [Crossref]
- McCafferty CE, Aghajani MJ, Abi-Hanna D, Gosbell IB, Jensen SO. An update on gastrointestinal
endoscopy-associated infections and their contributing factors. Ann Clin
Microbiol Antimicrob 2018;17:36. doi: 10.1186/s12941-018-0289-2 [Crossref]
- Muscarella LF. ‘Updated’
guidance for the prevention of transmission of carbapenem-resistant enterobacteriaceae (‘cre’) and
other related multidrug-resistant ‘superbugs’ during gastrointestinal
endoscopy. [Internet] 2016. [cited 2019 Jul 15]. Available from:
http://nascecme.com.br/2014/wp-content/uploads/2017/03/Updated-guidance-for-the-Prevention-of-CRE...pdf
- Brasil. Ministério da Saúde.
Resolução da Diretoria Colegiada (RDC) nº55, de 14 de novembro de 2012. Dispõe
sobre os detergentes enzimáticos de uso restrito em estabelecimentos de
assistência à saúde com indicação para limpeza de dispositivos médicos e dá
outras providencias. Diário Oficial da União. Brasília. 2012. [cited 2019 Mar 18]. Available from:
http://portal.anvisa.gov.br/documents/10181/3153268/RDC_55_2012.pdf/719da261-765e-4d51-a7c2-62c69262c9b1?version=1.0
- World Gastroenterology Organization, World Endoscopy Organization. Desinfecção de Endoscópios – um enfoque
sensível aos recursos. Practice Guidelines
2011 [Internet]. [cited 2020 Mar 17]. Available from:
http://www.worldgastroenterology.org/UserFiles/file/guidelines/endoscope-disinfectionportuguese-2011.pdf
- Mati MLM, Guimarães NR, Magalhães PP, Farias LM, Oliveira AC. Reutilização do detergente enzimático no processamento de gastroscópios: uma potencial fonte de transmissão de microrganismos. Rev Latino-Am Enfermagem 2019;27:e3211. doi: 10.1590/1518-8345.3101.3211 [Crossref]
- American Society for Gastrointestinal Endoscopy. Multisociety guideline on reprocessing flexible GI endoscopes and accessories. Gastrointestinal Endoscopy 2021;93(1);11-33. doi: 10.1016/j.gie.2020.09.048 [Crossref]
- Beleihoff U, Neumann, CS,
Rey JF, Biering H, Blum R, Schimidt
V, et al. Esge–Esgena
Guideline for quality assurance in reprocessing: Microbiological surveillance
testing in endoscopy 2007;39:175-81. doi: 10.1055/s-2006-945181 [Crossref]
- Evangelista SS, Santos SG, Resende MAS, Oliveira AC. Analysis of microbial load on surgical instruments after clinical use and following manual and automated cleaning. Am J Infect Control 2015;43 (5):522-7. doi: 10.1016/j.ajic.2014.12.018 [Crossref]
- Alfa MJ. Current issues result in a paradigm shift in reprocessing medical and surgical instruments. Am J Infect Control 2016;44(Suppl5):41-45. doi: 10.1016/j.ajic.2016.01.020 [Crossref]
- Alfa MJ, DeGagne P, Olson N. Worst-case soiling levels for patient-used flexible endoscopes before and after cleaning. Am J Infect Control 1999;27(5):392-401. doi: 10.1016/s0196-6553(99)70004-0 [Crossref]
- Ren-Pei W, Jun-Hui X, Ke O, Dong W, Xing N, Zhao-Shen L. Correlation between thegrowth of bacterial biofilm in flexible endoscopes and endoscope reprocessing methods. Am J Infect Control 2014;42(11):1203-6. doi: 10.1016/j.ajic.2014.07.029 [Crossref]
- Neves MS, Silva MG, Vetura GM, et al. Effectiveness of current disinfection procedures against biofilm on contaminated GI endoscopes. Gastrointest Endosc 2016;83(5):944-53. doi: 10.1016/j.gie.2015.09.016 [Crossref]
- Vickery K, Pajkos A, Cossart,
Y. Removal of biofilm from endoscopes: Evaluation of detergent efficiency. Am J
Infect Control 2004;32(3):170-6. doi: 10.1016/j.ajic.2003.10.009 [Crossref]
- Kovaleva J. Infectious complications in gastrointestinal endoscopy and their prevention. Best Pract Res Clin Gastroenterol 2016;30(5):689-704. doi: 10.1016/j.bpg.2016.09.008 [Crossref]
- Alfa MJ, Singh H, Duerksen DR, Schultz G, Reidy C, DeGagne P, et al. Improper positioning of the elevator lever of duodenoscopes may lead to sequestered bacteria that survive disinfection by automated endoscope reprocessors. Am J Infect Control 2018;46:73-5. doi: 10.1016/j.ajic.2017.07.021 [Crossref]
