Enferm Bras.
2023;22(5):655-67
ARTIGO
ORIGINAL
Correlação
entre obesidade central e resistência insulínica em crianças e adolescentes com
diabetes tipo 1
João
Pedro Ferreira Dias, Lilia Maria Freires Rodrigues Soares de Melo, Rodrigo de
Azeredo Siqueira, Marco Orsini
Universidade
Iguaçu (UNIG), Nova Iguaçu, RJ, Brasil
Recebido
10 de setembro de 2023; aceito 20 de outubro de 2023
Correspondência: Marco Orsini,
orsinimarco@hotmail.com
Como citar
Dias JPF, Melo LMFRS,
Siqueira RA, Orsini M. Correlação entre obesidade
central e resistência insulínica em crianças e adolescentes com diabetes tipo
1. Enferm Bras. 2023;22(5):655-667. doi: 10.33233/eb.v22i5.5551
Resumo
Introdução: Observa-se que o Brasil é o 5º país em
incidência de Diabetes no mundo, com 1,1 milhão de crianças e adolescentes
portadoras de DM1. Estudos recentes indicam que a resistência insulínica pode
estar presente na doença. Como objetivo principal, este trabalho busca avaliar a
influência da obesidade central na resistência insulínica em crianças e
adolescentes com DM1. Métodos: Estudo de coorte transversal composto por
19 indivíduos, com idade entre 6 e 18 anos diagnosticados com DM1, avaliados de
janeiro a dezembro de 2022. Dados: IC; VAI; BSl; BRI;
WHR; WtHR; foram coletados por anamnese e medidas
antropométricas, e relacionados utilizando o coeficiente de Pearson com os
resultados da equação “eGDR” e “CACTI”. Resultados:
Observou-se que a correlação entre EDC x IFC não demonstrou resultados
satisfatórios (p > 0.05), assim como CACTI x VAI (p > 0,05). Entretanto,
a correlação entre EDC x CI se mostrou satisfatória (p < 0,001), similar ao
observado em EDC x WtHR (p = 0,017), EDC x WHR (p =
0,002), e em EDC x BRI (p < 0,05). Conclusão: Concluímos que quanto
maior a gordura corporal central, maior resistência insulínica e maior o índice
de volume abdominal, pior a sensibilidade a insulina.
Palavras-chave: Diabetes mellitus tipo 1; obesidade
central; resistência insulínica; obesidade pediatrica;
diabetes tipo 1 pediátrica.
Abstract
Correlation of central obesity with insulin resistance
in children and adolescents with type 1 diabetes
Introduction: It is observed
that Brazil is the 5º country in incidence of Diabetes in the world, with 1.1
million children and adolescents with DM1. Recent studies indicate that insulin
resistance may be present in the disease. As a main objective, this study seeks
to evaluate the influence of central obesity on insulin resistance in children
and adolescents with DM1. Methods: Cross-sectional cohort study
consisting of 19 individuals, aged between 6 and 18 years diagnosed with DM1,
evaluated from January to December 2022. Data: IC; VAI; BSl;
BRI; WHR; WtHR; were collected by anamnesis and
anthropometric measurements and related using the Pearson coefficient with the
results of the equation "eGDR" and
"CACTI". Results: It was observed that the correlation between
EDC x IFC did not show satisfactory results (p > 0.05), as well as CACTI x
VAI (p > 0.05). However, the correlation between EDC x IC was satisfactory
(p < 0.001), similar to that observed in EDC x WtHR
(p = 0.017), EDC x WHR (p = 0.002), and in EDC x BRI (p < 0.05). Conclusion:
We conclude that the higher the central body fat, the greater insulin
resistance and the higher the abdominal volume index, the worse the insulin
sensitivity.
Keywords: Type 1
diabetes mellitus; central obesity; insulin resistance; pediatric obesity; pediatric type1 diabetes.
Introdução
O
Brasil é considerado o quinto país em termos de incidência de diabetes no
mundo, com 16.8 milhões de pacientes adultos (20 a 79 anos de idade). É
estimado que a incidência da doença alcance 21.5 milhões em 2030. A ocorrência
de DM1 em crianças e adolescentes abaixo de 20 anos de idade alcança 1,1
milhões [1]. Esta alta incidência faz com que o Brasil ocupe uma posição
proeminente na incidência de DM, junto aos EUA e Índia [2]. A reposição
insulínica é necessária em pacientes com Diabetes Mellitus Tipo 1 (DM1),
considerando que a doença resulta da destruição da porção endócrina do
pâncreas, especificamente das células β, responsáveis pela formação e
secreção da insulina [3]. DM1A ou autoimune [4] é caracterizada pela destruição
das ilhotas de Langherans, o que geralmente ocorre por autólise. Pode ser
detectada em exames laboratoriais pela presença de anticorpos em níveis
séricos, como: anti-ilhotas ou anti-ICA,
anti-insulina ou IAA, anti-carboxilase
do ácido glutâmico ou anti-GAD. Os casos de DM1B são
mais incomuns e a sua etiologia permanece desconhecida ou idiopática, o que
sugere que mutações no gene da insulina podem ser responsáveis pela maioria dos
casos. A clínica da DM1 tem início agudo e se desenvolve por dias ou semanas
com sintomas clássicos: poliúria, polidipsia, polifagia e perda de peso
involuntária [4]. O fator autoimune está relacionado prevalente e diretamente a
DM1, mas estudos recentes indicaram que a resistência à insulina pode estar
presente.
Resistência
insulínica é clinicamente definida como uma resposta reduzida dos tecidos-alvo
para estimulação da insulina, levando a hiperglicemia [5].
Alguns eventos
fisiológicos podem desencadeá-la, como: puberdade,
desidratação, infecções, medicamentos
e tabagismo. Entretanto, estes não são os únicos
fatores que podem induzir
resistência. Mecanismos como: glicose sanguínea elevada,
inflamação sistêmica e
celular e estresse oxidativo também podem interferir na cascata
de sinalização
e desenvolver a resistência, além de influenciar as vias
celulares
inflamatórias resultantes da forma crônica da
doença [6].
Através
dos anos, algumas hipóteses propuseram uma forte ligação entre a resistência
insulínica e o desenvolvimento da DMT1. A hipótese criada em 2011 afirma que
pacientes com desregulação metabólica predominante e uma doença autoimune menos
dominante levam a anticorpos em indivíduos com menor sensibilidade à insulina,
associando essa hipótese à obesidade, estilo de vida e a genética do paciente.
A nível molecular, tal hipótese seria caracterizada pela expressão de citocinas
ligadas à obesidade, o que, por sua vez, leva a apoptose de células β mais
agressiva [7].
Existe
ainda a hipótese do “acelerador”, que considera que o desenvolvimento da resistência
à insulina é impulsionado pela obesidade, este conceito é baseado em diversos
estudos transversais associando maior peso corporal no momento do diagnóstico
da DM1 [8]. Há também teorias como a teoria do “campo fértil”, que sugere que a
função metabólica anormal compromete as células β, tornando-se mais
característica de fenômenos autoimunes desencadeados por fatores ambientais,
como a infecção microbiana viral [9].
Considerado
o método direto e o padrão-ouro para avaliar a resistência à insulina de acordo
com o recente consenso da American Diabetes Association
(ADA), o Clamp euglicêmico hiperinsulinemico, que permite ao investigador examinar a
sensibilidade tecidual da insulina, tanto no músculo quanto no fígado, bem como
examinar a resposta das células beta à glicose são situações de constância de
glicemia e insulinemia [7] permite a manipulação da
ação da insulina e interação da dor em função da glicose no sangue, onde as
duas variáveis podem ser manipuladas de forma independente. No entanto, o Clamp é um método difícil de acessar e só é realizado em
pesquisa clínica [7]
O
objetivo deste trabalho foi correlacionar a obesidade central e a resistência à
insulina no diabetes tipo 1, em crianças e adolescentes, como uma continuação
da avaliação positiva, em pacientes adultos, de acordo com dados anteriores
realizados pelo nosso grupo. Eles serão avaliados por fórmulas matemáticas já
protegidas na literatura.
Observa-se
que o aumento do tecido adiposo tem uma relação direta com a resistência à
insulina, de modo que o adipócito, uma célula especializada em armazenamento de
lipídios em nosso corpo, tem função endócrina, sendo capaz de secretar
substâncias chamadas adipocinas, como leptina, adiponectina e resitina. Estes
interagem com certos sistemas do nosso corpo causando alterações metabólicas.
Por exemplo, no fígado, há um aumento na glicogenólise e na gliconeogênese,
como resultado do qual há um aumento na glicose no sangue. A nível do músculo
esquelético, adipocinas como TNF-alfa e resitina inibem a captação de glicose no nível muscular,
consequentemente o consumo de glicose é reduzido e isso é acumulado no sangue
[10]. As adipocinas que circulam na corrente
sanguínea e atuam no cérebro causam um ajuste da taxa metabólica restante para
um nível mais baixo, fazendo com que o cérebro reduza significativamente o
consumo de glicose, uma consequência da dificuldade do músculo esquelético em
capturar a glicose. Além disso, as adipocinas
aumentam a ingestão de alimentos, causando um aumento no tecido adiposo do
corpo, e na produção de glicose hepática. Em termos de vasos sanguíneos,
principalmente em arteríolas, as adipocinas reduzem a
função endotelial, proporcionando a capacidade de vasodilatação. Esses efeitos
combinados levam a um risco aumentado de desenvolver diabetes e eventos
cardiovasculares.
Métodos
O
estudo é um coorte transversal realizado entre os meses de janeiro de 2022 até
dezembro de 2022, com amostra de 19 pacientes portadores de Diabetes Mellitus
Tipo 1, com idade entre 6 e 18 anos. Todos os pacientes foram voluntários e
assinaram o termo de Assentimento livre e esclarecido, assim como seus
responsáveis assinaram o Termo de consentimento Livre e Esclarecido,
concordando com os termos da pesquisa, conforme a Resolução 466/12 do Conselho
Nacional de Saúde do Brasil. Projeto aprovado pelo comitê de ética e pesquisa
CAAE: 53175521.9.0000.8044
Foram
utilizados como critérios de inclusão, os seguintes itens: o responsável do
menor deve concordar com a coleta de dados; estar ciente dos objetivos do
estudo e ser capaz de colaborar com a sua realização; os responsáveis devem
assinar o termo de Consentimento Livre e Esclarecido; os participantes da
pesquisa devem assinar o Termo de Assentimento Livre e Esclarecido; Idade entre
6 e 18 anos incompletos.
Como
critérios de exclusão, levamos em consideração: qualquer patologia que
impossibilite a participação na pesquisa; Recusa a participar do estudo;
Alterações cognitivas que impeçam a realização do protocolo; deformidade da
região abdominal.
Os
dados foram coletados por meio de exames laboratoriais, para identificar
inflamação sistêmica e avaliar o perfil metabólico dos pacientes, como:
Ferritina, Proteína C reativa, Triglicerídeos, HDL, LDL, Hemoglobina glicada, Albuminuria e Creatinina. Além disso realizamos anamnese
clínica.
A
entrevista realizada pelos pesquisadores, direcionada aos participantes do
estudo foi clara e objetiva, buscando adquirir informações sobre o histórico
médico do paciente em questão. As informações usadas foram: nome; idade; sexo; etnia;
tempo de diabete; tipo de terapia; prática de atividade física.
Foram
adquiridas medidas antropométricas: peso; altura; circunferência de quadril,
cintura e pescoço. A partir dessas informações foi possível calcular índices e
realizar relações, sendo estas:
Índice
de conicidade (CI) – determinado pela massa corporal, altura e circunferência
abdominal. Representa um indicador de obesidade abdominal e seu cálculo é
descrito por meio da seguinte equação:
𝐶𝑜𝑛𝑖𝑐𝑖𝑡𝑦 𝐼𝑛𝑑𝑒𝑥=Waist circumference (m) 0.109 x √𝐵𝑜𝑑𝑦 𝑤𝑒𝑖𝑔ℎ𝑡 (𝑘𝑔) 𝐻𝑒𝑖𝑔ℎ𝑡 (𝑚)
Produto
de Acúmulo de Lipídeos (LAP) – Índice que combina a circunferência da cintura e
o triglicerídeo, refletindo no acúmulo de lipídio corporal. Pode ser calculado
utilizando as seguintes equações:
Homem
LAP = [waist (cm) - 65] × TG (mmol/l)
Mulher LAP
= [waist (cm) - 58] × TG (mmol/l)
Índice
de adiposidade visceral (VAI) – Índice matemático sexo-específico, baseado em
circunferência da cintura (WC), Indice de massa
corporal (IMC), Triglicerídeo (TG), e colesterol HDL. Expressa a adiposidade
visceral, além de revelar a sensibilidade a insulina. Pode ser obtido com a
seguinte equação:
Homem:
VAI = (WC/39,68+(1,88 x IMC)) x (TG/1,03) x (1,31/HDL)
Mulher:
VAI = (WC/36,58+(1,89 x IMC)) x (TG/0,81) x (1,52/HDL)
Índice
de Formato Corporal (BSI) – foi desenvolvido como uma forma de quantificar o
risco associado à obesidade abdominal, indicada pela relação da cintura com a
altura e índice de massa corporal (IMC). Caso este índice seja um valor alto,
indica que a cintura é maior do que o esperado para uma certa altura e peso e
indica uma centralização da massa corporal
𝐵𝑆𝐼 = WC𝐵𝑀𝐼 2/3 𝐻𝑒𝑖𝑔ℎ𝑡
1/2
Índice
de massa magra apendicular (ALMI) – calculado dividindo a massa magra (massa
muscular) pelo quadrado da altura: ALMI = appendicular
lean mass/height x height
Índice
de volume abdominal (AVI) – calculado utilizando a seguinte formula:
A𝑉𝐼 = [2 x (𝑊𝐶)2 (𝑐𝑚)+0.7 𝑥 (𝑊𝐶−𝐻𝐶)2(𝑐𝑚)]1000
Índice
de arredondamento corporal (BRI) – índice que expressa obesidade central,
obtido pela equação:
𝐵𝑅𝐼=364.2−365.5 𝑥 √1−[𝑊𝐶[𝑚]/2𝜋]2[0.5
𝑥 𝐻𝑒𝑖𝑔ℎ𝑡 [𝑚]]2
Para
avaliar a resistência insulínica na diabete tipo 1, é utilizado a equação
descrita por y Kilpatrick et al. [11], EDC (Epidemiology of Diabetes Complications) a qual mede a taxa estimada de disposição de
glicose (eGDR):
Estimated glucose disposal rate = 24.31-12.22 x (WHR)
–3.29 x (hipertension: 0 = No; 1 = Yes) – 0.57 x
(HbA1c, %)
Para
avaliar a sensibilidade insulínica utilizamos a equação desenvolvida pelo
estudo Coronary Artery
Calcification in T1DM.
(CACTI) = 4.1075 – 0.01299 × (waist, cm) – 1.05819 ×
(insulin dose, UI·kg-1·day-1) - 0.00354 × (triglyceride,
mg/dL) × 0.00802 × (DBP,mmHg)
[12]
Tabela
I - Características
demográficas

n
= 19 participantes
Tabela
II - Características
gerais
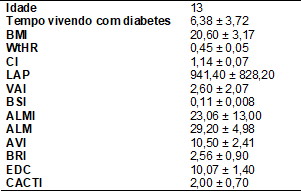
n
= 19 participantes
Resultados
As
características demográficas são especificadas na Tabela I e as características
gerais são especificadas na Tabela II. O estudo envolveu 19 indivíduos com
idades entre 6 e 18 anos diagnosticados com DM1. Podemos notar uma idade média
de 13 anos.
Quando
correlacionamos o EDC com o BRI, obtivemos uma correlação inversamente
proporcional (r = -0,3894) com valor significativo (p < 0,05), como podemos
ver na Figura 1, que mostra um gráfico de característica descendente.
Correlações
inversamente proporcionais também podem ser vistas ao correlacionar EDC x CI (r
= -0,7717; p = < 0,0001); EDC X WtHR (r = -
0,5364; p = 0,0179); EDC X WHR (r = - 0,6618; p = 0,0028) embora não tenhamos
obtido valor significativo ao correlacionar CACTI x VAI e EDC x BSI, podemos
observar a formação de gráficos com características descendentes com r =
-0,2981 e r = -0,1385.
Tabela
III -. Correlação
dos resultados entre EDC e variáveis
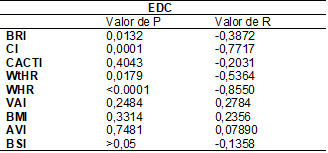
N
= 19 participantes. EDC = Epidemiology of Diabetes Complications; CACTI
= Estimated Insulin Sensitive Developed from Coronary Artery
Calcification in T1DM; BRI = Índice de arredondamento
corporal; CI = Índice de Conicidade; WtHR = Relação
Cintura-Estatura; WHR = Relação Cintura=Quadril; VAI = Índice de Adiposidade
Visceral; AVI = Índice de Volume Abdominal; BSI = Índice de Formato Corporal;
BMI = Índice de Massa Corporal
Tabela
IV - Correlação dos
resultados entre CACTI e variáveis
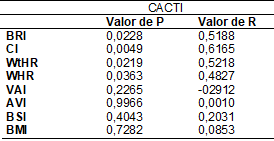
N
= 19 participantes. CACTI = Estimated Insulin Sensitive Developed from Coronary Artery Calcification in T1DM; BRI = Índice de arredondamento
corporal; CI = Índice de Conicidade; WtHR = Relação
Cintura-Estatura; WHR = Relação Cintura=Quadril; VAI = Índice de Adiposidade
Visceral; AVI = Índice de Volume Abdominal; BSI = Índice de Formato Corporal;
BMI = Índice de Massa Corporal
Discussão
O
estudo teve como objetivo avaliar a influência da obesidade central na
resistência à insulina em crianças e adolescentes com DM1, investigando a
associação entre EDC (eGDR), CACTI e outros índices
de obesidade (incluindo IMC, WtHR, WHR, VAI, AVI, CI)
crianças e adolescentes brasileiras, de 6 a 18 anos. Neste estudo transversal,
encontramos que WHR (relação cintura/quadril) teve a associação mais forte com
EDC, enquanto BRI teve a associação mais fraca.
A
relação cintura/quadril apresentou correlação significativa negativa com EDC.
Os resultados correspondem aos achados de Epstein et al. [13] que
descobriram que um eGDR de baixo nível (alto
pontuação EDC) está associada a obesidade central elevada. A correlação de
Pearson também indicou uma correlação negativa significativa entre Índice de
Conicidade e EDC. Isso representa que o quanto maior a resistência à insulina,
maior o Índice de Conicidade, que é um parâmetro antropométrica que determina o
risco cardiometabólico [14].
O
Índice de Arredondamento Corporal mostrou uma correlação significativa negativa
com EDC, sendo condizente com os resultados encontrados no estudo de Liu et
al. [15]. Representando que quanto maior a resistência insulínica, maior o
Índice de Arredondamento Corporal.
A
relação cintura/estatura também nos forneceu uma correlação negativa
significativa quando correlacionada com EDC. Os resultados correspondem a Alvim
et al. [16], que sugerem que a relação cintura-altura (WtHR) pode ser uma ferramenta útil para fornecer triagem
para resistência à insulina.
O
IMC não foi significativamente associado ao CACTI. Nossos resultados contrastam
com Klöting et al. [17], que encontraram uma
correlação entre obesidade e resistência à insulina. Esta contradição pode ter
ocorrido devido ao fato de seu estudo focar em participantes de meia-idade,
enquanto focamos em crianças e adolescentes de 6 a 18 anos.
Neste
estudo, o IMC não foi significativamente associado ao EDC, no entanto, Ferreira
et al. [18] encontraram uma correlação entre IMC e resistência à
insulina. Essa contradição pode ser devido a eles usarem o HOMA – IR como um
indicador de resistência à insulina, enquanto nosso estudo, se concentra em
parâmetros antropométricos mais simples para predizer a resistência à insulina.
Outro fato importante que merece destaque, é o
que os estudos que avaliam distribuição de gordura corporal [19,20], ou medidas
de adiposidade central [20,21,22], identificam que estas são superiores para
predizer a resistência insulínica em relação ao BMI (IMC). Vasques AC et al.
[23] apontam que esse fato possa ocorrer devido à associação entre resistência
insulínica e o acúmulo de tecido adiposo visceral, que é mais bem representado
por essas medidas. Outrossim, os autores deste estudo [23] também identificam a
incapacidade do IMC em distinguir entre massa corporal magra e gorda. Logo, sua
utilização para predizer a resistência insulínica pode ser falha,
principalmente em indivíduos com elevada massa muscular.
Embora
a correlação entre EDC x BSI não mostrou valor significativo, o estudo de Rahman et al. [24], identifica que de que quanto
maior o índice de formato corporal, maior a resistência à insulina, pior a
sensibilidade à insulina e com isso maior o risco de eventos cardiovasculares.
Conclusão
A
priori é importante salientar que neste estudo houve limitações dignas de nota.
Não conseguimos estabelecer uma relação causal por se tratar de um estudo
transversal e não utilizamos uma calculadora para avaliar o risco
cardiovascular. Além disso, a amostra foi bastante pequena comparado a outros
estudos, provavelmente devido à grande evasão dos participantes. Outrossim
muitos participantes tiveram que ser excluídos, devido a indisponibilidade de
exames laboratoriais. Por fim, a população deste estudo é majoritariamente
infantil, o que representou um grande desafio à cooperação.
Apesar
de todos os empecilhos encontrados, podemos concluir que a obesidade central
está diretamente correlacionada com a resistência à insulina e influencia
negativamente a vida de pacientes com Diabetes Mellitus Tipo 1. Desta forma,
com a aplicação de um tratamento otimizado, existem menos chances destes
pacientes sofrerem com as complicações da doença
Referências
- Antão FA, Souza KMR, Oliveira LF de,
Neto W de BC, Mendonça CNG. Resgate do Hiperdia em uma Unidade Básica de Saúde
no Estado de Pernambuco: relato de experiência. Anais FMO [Internet]. 29 de
junho de 2023 [citado 20 de julho de 2023];1(9):67-73. Disponível em:
https://afmo.emnuvens.com.br/afmo/article/view/241
- Negrato CA, Lauris JRP, Saggioro IB,
Corradini MCM, Borges PR, Crês MC, Junior AL, Guedes MFS, Gomes MB. Increasing
incidence of type 1 diabetes between 1986 and 2015 in Bauru, Brazil. Diabetes Res Clin Pract.
2017;127:198-204. doi: 10.1016/j.diabres.2017.03.014 [Crossref]
- Balda CA, Pacheco-Silva A. Aspectos imunológicos do diabetes melito tipo 1. Rev Assoc Med Bras 1999 45(2). doi: 10.1590/S0104-42301999000200015 [Crossref]
- Silva MER, Ursich MJM, Rocha DM, Fukui RT, Correia MRS, Marui S, et al. Diabetes autoimune em adultos: características clínicas e autoanticorpos. Arq Bras Endocrinol Metab. 2003 47(3). doi: 10.1590/S0004-27302003000300008 [Crossref]
- Dib SA. Resistência à insulina e síndrome metabólica no diabetes melito do tipo 1. Arq Bras Endocrinol Metab. 2006 50(2). doi: 10.1590/S0004-27302006000200011 [Crossref]
- Protocolo colaborativo diabetes mellitus
síntese operativa para o cuidado. [Internet]. Disponível em:
https://prefeitura.pbh.gov.br/sites/default/files/estrutura-de-governo/saude/2021/protocolo-colaborativo_diabetes_mellitus-29-11-2021.pdf
- Triches C, Schaan BD, Gross JL, Azevedo MJ de. Complicações macrovasculares do diabetes melito: peculiaridades clínicas, de diagnóstico e manejo. Arq Bras Endocrinol Metab. 2009;53(6):698–708. doi: 10.1590/S0004-27302009000600002 [Crossref]
- Cobas R, Santos B, Braga L, Cunha EF, Gomes M de B. Evolução para hipertensão arterial em pacientes com diabetes tipo 1. Arq Bras Endocrinol Metab 2008 52(4). doi: 10.1590/S0004-27302008000400008 [Crossref]
- Mathiesen
ER, Rønn B, Storm B, Foght H, Deckert T. The natural course of microalbuminuria
in insulin-dependent diabetes: a 10-year prospective study. Diabet Med.
1995;12(6):482-7. doi: 10.1111/j.1464-5491.1995.tb00528.x [Crossref]
- Abdul-Ghani MA, DeFronzo RA. Pathogenesis of insulin resistance in skeletal muscle. J Biomed Biotechnol. 2010;2010:476279. doi: 10.1155/2010/476279 [Crossref]
- Kilpatrick ES, Rigby AS, Atkin SL. Insulin resistance, the metabolic syndrome, and complication risk in type 1 diabetes: “Double diabetes” in the Diabetes Control and Complications Trial. Diabetes Care 2007;30(3):707–12. doi: 10.2337/dc06-1982 [Crossref]
- Kissebah AH, Vydelingum N, Murray R, Evans DJ, Hartz AJ, Kalkhoff RK, Adams PW. Relation of body fat distribution to metabolic complications of obesity. J Clin Endocrinol Metab. 1982;54(2):254-60. doi: 10.1210/jcem-54-2-254 [Crossref]
- Epstein EJ, Osman JL, Cohen HW, Rajpathak SN, Lewis O, Crandall JP. Use of the estimated glucose disposal rate as a measure of insulin resistance in an urban multiethnic population with type 1 diabetes. Diabetes Care. 201;36(8):2280-5. doi: 10.2337/dc12-1693 [Crossref]
- Ribeiro I da C, Calafange SM, Oliveira
TLPS de, Andrade MIS de, Orange LG de, Lima CR de. Correlação entre o índice de
conicidade e indicadores antropométricos de risco cardiovascular: um estudo com
praticantes e não-praticantes de exercícios. Braz J Develop. [Internet]. 2020
mar 18 [citado 2023 jan 25];6(3):13616-29. Disponível em:
https://ojs.brazilianjournals.com.br/ojs/index.php/BRJD/article/view/7835
- Liu B, Liu B, Wu G, Yin F. Relationship between body-roundness index and metabolic syndrome in type 2 diabetes. Diabetes Metab Syndr Obes. 2019;12:931-35. doi: 10.2147/DMSO.S209964 [Crossref]
- Alvim RO, Zaniqueli D, Neves FS, Pani VO, Martins CR, Peçanha MAS, Barbosa MCR, Faria ER, Mill JG. Waist-to-height ratio is as reliable as biochemical markers to discriminate pediatric insulin resistance. J Pediatr. 2019;95(4):428-434. doi: 10.1016/j.jped.2018.04.004 [Crossref]
- Klöting N, Fasshauer M, Dietrich A, Kovacs P, Schön MR, Kern M, Stumvoll M, Blüher M. Insulin-sensitive obesity. Am J Physiol Endocrinol Metab. 2010;299(3):E506-15. doi: 10.1152/ajpendo.00586.2009 [Crossref]
- Ferreira AP, Nóbrega O de T, França NM
de. Associação do índice de massa corporal e da resistência à insulina com
síndrome metabólica em crianças brasileiras. Arq Bras Cardiol 2009;93(2):147–53
- Chuang YC, Hsu KH, Hwang CJ, Hu PM, Lin TM, Chiou WK. Waist-to-thigh ratio can also be a better indicator associated with type 2 diabetes than traditional anthropometrical measurements in Taiwan population. Ann Epidemiol. 2006;16(5):321-31. doi: 10.1016/j.annepidem.2005.04.014 [Crossref]
- Ho SY, Lam TH, Janus ED; Hong Kong Cardiovascular Risk Factor Prevalence Study Steering Committee. Waist to stature ratio is more strongly associated with cardiovascular risk factors than other simple anthropometric indices. Ann Epidemiol. 2003;13(10):683-91. doi: 10.1016/s1047-2797(03)00067-x [Crossref]
- Petersson H, Daryani A, Risérus U. Sagittal abdominal diameter as a marker of inflammation and insulin resistance among immigrant women from the Middle East and native Swedish women: a cross-sectional study. Cardiovasc Diabetol. 2007;28;6:10. doi: 10.1186/1475-2840-6-10 [Crossref]
- Parikh RM, Joshi SR, Menon PS, Shah NS. Index of central obesity - A novel parameter. Med Hypotheses. 2007;68(6):1272-5. doi: 10.1016/j.mehy.2006.10.038 [Crossref]
- Vasques AC, Rosado L, Rosado G, Ribeiro
R de C, Franceschini S, Geloneze B. Indicadores antropométricos de resistência
à insulina. Arq Bras Cardiol 2010 Jul;95(1):e14–23.
- Rahman SA,
Adjeroh D (2015) Surface-based body shape index and its relationship
with all-cause mortality. PLOS
ONE 10(12):e0144639. doi: 10.1371/journal.pone.0144639 [Crossref
