Enferm Bras.
2023;22(6):1208-224
REVISÃO
Correlação
entre microbiota intestinal e distúrbios neurológicos
Clara de
Almeida e Araujo Leite1, Juan Pablo Lemos
dos Santos2, Luciana Armada2, Marco Antonio
Araujo Leite3, Catarine Torquato Barcellos1,
Thiago de Mello
Tavares4, Marco Orsini2
1Universidade Estácio de Sá, Rio de
Janeiro, RJ, Brasil
2Universidade Iguaçu, Nova Iguaçu, RJ,
Brasil
3Universidade Federal Fluminense, Niteroi, RJ, Brasil
4Universidade do Contestado, Mafra, SC, Brasil
Recebido 20 de novembro de 2023; aceito 22 de dezembro de 2023
Correspondência: Marco Orsini,
orsinimarco@hotmail.com
Como citar
Leite CAA, Santos JPL, Armada L, Leite MAA, Barcellos CT, Tavares TM, Orsini M. Correlação entre microbiota intestinal e distúrbios neurológicos. Enferm Bras. 2023;22(6):1208-224. doi: 10.33233/eb.v22i6.5570
Resumo
A
microbiota intestinal, composta por uma diversidade de microrganismos, exerce
um papel crucial na digestão, absorção de nutrientes e na saúde geral do
hospedeiro. Sua composição varia conforme fatores individuais, como dieta,
idade, genética e ambiente. Apesar da compreensão da influência dos intestinos
delgado e grosso na produção de hormônios como a serotonina, os efeitos de
alterações na microbiota no sistema nervoso ainda são pouco elucidados. Este
artigo explora as descobertas científicas recentes sobre este eixo
intestino-encéfalo enfatizando diversos estudos que investigaram os efeitos da
microbiota intestinal no comportamento e no sistema nervoso central.
Palavras-chave: eixo intestino-encéfalo; influência
humoral da microbiota; distúrbios neurológicos.
Abstract
Correlation between intestinal microbiota and
neurological disorders
The intestinal microbiota, composed of a diversity of
microorganisms, plays a crucial role in digestion, nutrient absorption, and the
overall health of the host. Its composition varies based on individual factors
such as diet, age, genetics, and environment. Despite the understanding of the
intestines' influence on hormone production like serotonin, the effects of microbiota
alterations on the nervous system remain poorly elucidated. This article
explores recent scientific findings on this gut-brain axis, emphasizing various
studies that investigated the effects of intestinal microbiota on behavior and
the central nervous system.
Keywords: gut-brain axis; humoral influence
of microbiota; neurological disorders.
Resumen
Correlación entre microbiota intestinal y trastornos neurológicos
La
microbiota intestinal, compuesta por una diversidad de microorganismos, desempeña un papel crucial en la digestión,
absorción de nutrientes y en la salud
general del huésped. Su composición varía según factores
individuales como la dieta,
la edad, la genética y el entorno. A pesar
de la comprensión de la influencia de los intestinos en la producción de hormonas como la serotonina, los efectos de las alteraciones en la microbiota en el sistema nervioso aún no están completamente
esclarecidos. Este artículo explora los recientes descubrimientos
científicos sobre este eje intestino-cerebro, enfatizando diversos estudios
que han investigado los efectos de la microbiota
intestinal en el comportamiento y el sistema nervioso central.
Palabras-clave: eje intestino-cerebro; influencia humoral de la
microbiota; desórdenes neurológicos.
Introdução
O
complexo sistema de comunicação entre o intestino e o encéfalo tem sido objeto
de crescente interesse científico devido às suas implicações para a saúde.
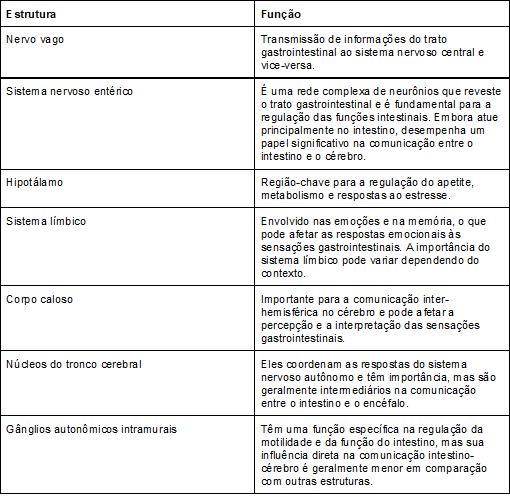
Estruturas neuroanatômicas como o corpo caloso e o
sistema nervoso entérico conectam esses órgãos. A interação entre os intestinos
e o encéfalo ocorre por meio de vias complexas, incluindo a via neural, a via
neuroendócrina e a via de sinalização inflamatória. Essas vias desempenham
papéis cruciais na regulamentação das funções intestinais, na resposta ao
estresse e na interação entre a microbiota intestinal e o sistema nervoso
central. A proposta do presente ocorrera de acordo com a especificidade e
conteúdo contendo em questão, com o fito de obter mais informações sobre esta
alteração psicológica pelo ponto de vista fisiológico.
Quadro
1 - Estruturas que
conectam o eixo intestino-encéfalo
Métodos
Trata-se
de uma atualização da literatura, caracterizada por análise sistemática e
síntese de investigação sobre a correlação entre a microbiota intestinal e
distúrbios neurológicos, escopo restrito com análise descritiva. A busca foi
composta utilizando as seguintes palavras chaves, compreendidas nos exames de
2015 a 2023: microbiota intestinal, influência intestinal no humor, distúrbios
psíquicos, nos idiomas português, inglês e espanhol. Os principais bancos de dados utilizados foram: eBioMedicine Part of THE LANCET Discovery Science; MDPI;
BioMed Central (BMC); Frontiers; Sage Journals; International Parkinson and
Movement Disorder Society (MDS); Science Direct; Proceedings of the National
Academy of Sciences (PNAS); além de SCIELO, National
Institutes of Health (NIH), Scientific reports e PubMed.
Quadro
2 - Descrição metodológica
Resultados
e discussão
Em
primeiro plano, é imperativo aprofundar nossa compreensão do intricado
mecanismo de comunicação entre o trato gastrointestinal e o encéfalo. Complexas
estruturas neuroanatômicas conectam esses órgãos, e
uma intrincada rede de nervos se estende pela parede intestinal. A informação
gerada por essa estrutura pode ser transmitida ao sistema nervoso central
através dos nervos entéricos e do nervo vago. Reciprocamente, o encéfalo,
posicionado como epicentro do organismo, tem a capacidade de modular as funções
intestinais por intermédio do nervo vago descendente. A via neuroendócrina
desse sistema é constituída pelo eixo hipotálamo-hipofisário-adrenal, desempenhando
um papel pivotal na orquestração desta comunicação e
exercendo uma função central na interação. Cabe ressaltar que o estresse
desencadeia modificações na composição e nas funcionalidades microbianas do
aparelho digestivo, através da ativação deste eixo. A disfunção do mesmo
desempenha um papel determinante na patogênese de condições neuropsiquiátricas [1-3].
Tendo
em consideração as informações previamente mencionadas, foi conduzido um estudo
no qual transplantes de microbiota fecal foram realizados em camundongos com
perfis comportamentais diversos, direcionados a receptores livres de germes. Os
resultados revelaram que comportamentos associados à ansiedade e depressão
podiam ser transferidos através do transplante de microbiota. Animais receptores
que receberam doadores ansiosos e deprimidos manifestaram condutas semelhantes,
mesmo na ausência de exposição aos fatores estressores que afetaram os
doadores. Tais modificações comportamentais mostraram-se correlacionadas com
alterações nos níveis de neurotransmissores, incluindo o ácido gama-aminobutírico (GABA), uma substância de relevância na
regulação do estado de ânimo [4-6].
Conforme
previamente mencionado, a composição da microbiota intestinal exerce influência
no sistema nervoso central, provocando modificações no comportamento do
hospedeiro e possivelmente relacionando-se com o desenvolvimento de distúrbios
neurodegenerativos. Alguns metabólitos originados da microbiota intestinal,
tais como o N-óxido de trimetilamina, podem estar
implicados na patogênese do Alzheimer. Ademais, outros compostos gerados
durante a fermentação de alimentos intestinais, como o D-glutamato e os ácidos
graxos de cadeia curta, apresentam potencial impacto na função cognitiva. A
administração de microrganismos benéficos à saúde, os chamados probióticos, tem
sido investigada em ensaios com animais de laboratório e seres humanos visando
avaliar seus efeitos na doença de Alzheimer [7].
Por
outro lado, a análise do RNA ribossômico 16S, realizada em biópsias do cólon e
amostras fecais de adultos afetados por doenças neurológicas, como o Alzheimer [8,9],
evidenciou uma redução nas populações de bactérias produtoras de ácidos graxos
de cadeia curta, tais como Blautia, Coprococcus e Roseburia.
Adicionalmente, observou-se uma variação na presença dos gêneros Prevotella e Lactobacillus em vários estudos caso-controle
conduzidos com esses pacientes [10,11].
Dado
que qualquer alteração nessa região pode acarretar efeitos sistêmicos, a
utilização indiscriminada de antibióticos pode também resultar em distúrbios do
humor, ao eliminar tanto bactérias benéficas quanto patogênicas. Por meio da
administração de antibacterianos em ratos, foi examinada a influência desses
compostos no encéfalo. Os experimentos destacaram que o uso prolongado resultou
em níveis elevados de marcadores inflamatórios no cérebro e em comportamentos
assemelhados a sintomas de ansiedade [12-14].
Determinadas
investigações têm estabelecido relações entre as células T auxiliares do tipo
17 e a patogênese da esclerose múltipla, em virtude de seu impacto na exacerbacão da encefalomielite autoimune experimental. As
células T reguladoras desempenham um papel de primordial importância na
supressão da inflamação no sistema nervoso. Notavelmente, Cekanaviciute
et al. [16] identificaram elevações nos sintomas neurológicos
relacionados à gravidade da doença e uma deficiência na indução de linfócitos T
reguladores IL-10+ em camundongos colonizados com microbiota de pacientes
acometidos por esclerose múltipla 15. Ademais, algumas bactérias produtoras de butirato também foram implicadas na patogênese dessa
condição. O butirato é conhecido por inibir vias
pró-inflamatórias e prevenir a exposição sistêmica a antígenos intestinais.
Bactérias, como o Faecalibacterium, pertencente ao
filo Firmicutes, mostraram-se reduzidas em pacientes
com essa patologia.
Similarmente,
pacientes acometidos pela doença de Parkinson apresentam manifestações não
motoras graves durante a fase prodrômica da enfermidade, as quais desempenham
um papel crucial na determinação da qualidade de vida destes indivíduos.
Sintomas sensoriais, neuropsiquiátricos, distúrbios do sono e sintomas
gastrointestinais figuram como os fenótipos mais frequentemente descritos nesta
categoria. Diversos estudos, recorrendo a testes respiratórios, têm demonstrado
que uma parcela significativa dos pacientes com Parkinson apresenta
supercrescimento bacteriano no intestino e problemas de absorção, o que culmina
em quadros de constipação intestinal [17,18].
De
maneira análoga, pesquisas têm revelado que cerca de 50% dos pacientes afetados
por acidentes vasculares cerebrais (AVCs) manifestam
complicações gastrointestinais. Esse fenômeno demonstra uma sólida conexão com
o processo de recuperação do paciente, a deterioração das funções neurológicas
e, por conseguinte, com a taxa de mortalidade. Diversos estudos têm confirmado
a ligação entre os desfechos dos AVCs e a modulação
da microbiota, desempenhando um papel crucial na regulação do sistema
imunológico e do metabolismo. Tais pesquisas têm revelado que certas cepas
bacterianas podem exercer influência, seja de forma benéfica ou adversa, sobre
os níveis séricos de lipoproteínas de baixa densidade (LDL) e lipoproteínas de
alta densidade (HDL) [19].
Da
mesma forma, observou-se que pacientes acometidos pela epilepsia exibem uma
suscetibilidade presumível à disbiose intestinal,
que, por conseguinte, pode resultar em inflamação crônica do epitélio
intestinal [20]. Em um estudo envolvendo 91 participantes, conduzido por Peng et al. [21], foi revelado que pacientes que
sofriam mais de quatro convulsões por ano apresentavam uma predominância de
microrganismos do gênero Ruminococcus e espécies
bacterianas raras em comparação com o grupo de pacientes sensíveis a
tratamentos medicamentosos. Essas descobertas suscitam diversas hipóteses,
incluindo: i) a possibilidade de que o uso de diferentes fármacos
antiepiléticos possa induzir a disbiose intestinal; ii) a prevalência de microrganismos raros pode modular vias
metabólicas relacionadas aos transportadores ABC, conferindo resistência
química ao tratamento; iii) os gêneros Bifidobacterianos e Lactobacilos parecem estimular a
produção de GABA e predominam no grupo de pacientes sensíveis a medicamentos [21].
Todas
as informações anteriormente mencionadas evidenciam o crescente interesse
científico na interação entre a microbiota intestinal e o sistema nervoso.
Compreender como as modificações na microbiota podem impactar o comportamento e
a saúde mental reveste-se de uma importância singular, sobretudo em um contexto
global onde observamos um aumento nos casos de depressão e ansiedade. A
compreensão destas interações pode fornecer perspectivas inestimáveis para o
desenvolvimento de estratégias voltadas ao tratamento e prevenção de distúrbios
psíquicos.
Conclusão
Após
leitura e interpretação dos artigos abordados acima de acordo com o tema,
chegou-se à conclusão que a microbiota intestinal tem enorme influência sob o
estado humoral, entre outras funções do encéfalo, podendo tornar-se, com o
avanço do conhecimento acerca, objeto terapêutico para doenças não apenas
relacionadas ao trato digestivo, mas também neuropsiquiátricas.
Referências
- Lanxiang Liu,
Haiyang Wang, Xueyi Chen, Peng Xie.
Gut microbiota: a new insight into neurological diseases. Chin Med J.
2023;136(11):1261-77. doi: 10.1097/CM9.0000000000002212
- Murakami T, Kamada K,
Mizushima K, Higashimura Y, Katada
K, Uchiyama K, et al. Changes in intestinal motility and gut microbiota
composition in a rat stress model. Digestion. 2017;95(1):55-60. doi: 10.1159/000452364
- Cryan JF, O’Riordan KJ, Cowan CSM, Sandhu KV, Bastiaanssen
TFS, Boehme M, et al. The microbiota-gut-brain axis. Physiol
Rev. 2019;99(4):1877-2013. doi:
10.1152/physrev.00018.2018
- Faulin T, Estadella D. Alzheimer’s disease and its relationship with
the microbiota-gut-brain axis. Arq gastroenterol.
2023.;60(1). https://doi.org/10.1590/S0004-2803.202301000-17
- Nannan Li,
Qi Wang, Yan Wang, Anji Sun, Yiwei Lin, Ye Jin, Xiaobai Li, et al.. Fecal microbiota transplantation from chronic
unpredictable mild stress mice donors affects anxiety-like and depression-like
behavior in recipient mice via the gut microbiota-inflammation-brain axis.
Stress. 2019;22(5):592-602. doi:
10.1080/10253890.2019.1617267
- Zheng P, Zeng B, Liu M, Chen J, Pan J, Han Y, et al.
The gut microbiome from patients with schizophrenia modulates the
glutamate-glutamine-GABA cycle and schizophrenia-relevant behaviors in mice.
Sci Adv. 2019;5(2):eaau8317. doi:
10.1126/sciadv.aau8317
- Mejía-Granados
DM, Villasana-Salazar B, Coan
AC, Balthazar MLF, Godoi AB, Canto AM, et al. Gut
microbiome in neuropsychiatric disorders. Arq Neuro-Psychiatr. 2022;80(2).
https://doi.org/10.1590/0004-282X-ANP-2021-0052
- Aho VTE, Pereira
PAB, Voutilainen S, Paulin L, Pekkonen
E, Auvinen P, et al. Gut microbiota in Parkinson's
disease: Temporal stability and relations to disease progression. EBioMedicine. 2019;44:691-707. doi: 10.1016/j.ebiom.2019.05.064
- Glover ME, Cohen JL, Singer JR, Sabbagh MN, Rainville JR, Hyland MT, et al. Examining the role of
microbiota in emotional behavior: antibiotic treatment exacerbates anxiety in
high anxiety-prone male rats. Neuroscience. 2021;459:179-97.
doi: 10.1016/j.neuroscience.2021.01.030
- Ping Liu, Li Wu, et al. Altered microbiomes
distinguish Alzheimer’s disease from amnestic mild cognitive impairment and
health in a Chinese cohort. Brain, Behavior, and Immunity 2019;80:633-43.
https://doi.org/10.1016/j.bbi.2019.05.008
- Vogt NM, Kerby RL, et al. Gut microbiome alterations
in Alzheimer’s disease. Scientific
Reports. 2017;7:13537. [acesso
em 25 ago 2023]; Disponível em:
https://www.nature.com/articles/s41598-017-13601-y
- Chunxiao Li, Li Cui et al. Gut microbiota
differs between parkinson’s disease patients and
healthy controls in Northeast China. Front Mol Neurosci.
2019;12. https://doi.org/10.3389/fnmol.2019.00171
- (artigo 9)ME
Glover, JL Cohen, JR Singer, MN Sabbagh, JR Rainville,
MT Hyland, CD Morrow, CT Weaver, GE Hodes, A. Kerman Ilan
and SM Clinton. Examining the role of microbiota in emotional behavior:
antibiotic treatment exacerbates anxiety in high anxiety-prone male rats; Transinfo. [Internet]. 2021 [acesso
em 25 ago 2023];
- Arora K, Green M, Prakash S. The microbiome and
Alzheimer's Disease: potential and limitations of prebiotic, synbiotic, and probiotic formulations. Front Bioeng Biotechnol. 2020;8:537847. doi:
10.3389/fbioe.2020.537847
- Naomi R, Embong H, Othman F,
Ghazi HF, Maruthey N and Bahari
H. Probiotics for Alzheimer's disease: a systematic review. Nutrients.
2021;14(1):20. doi: 10.3390/nu14010020
- Cekanaviciut E, Yoo BB, Runia TF, Baranzini SE, et al. Gut
bacteria from multiple sclerosis patients modulate human T cells and exacerbate
symptoms in mouse models. PNAS. 2017;114(40):10713-18. https://doi.org/10.1073/pnas.1711235114
- Cantarel BL, Waubant E, et al. Gut microbiota
in multiple sclerosis: possible influence of immunomodulators. Journal of
Investigating Medicine. 2015 ;63(5):729-34. doi:
10.1097/JIM.0000000000000192
- Keshavarzian A,
Green SJ, et al. Colonic bacterial composition in Parkinson's disease. Movement
Disorders. 2015;10:1351-60.
https://doi.org/10.1002/mds.26307
- Aho VTE, Houser MC,
at al. Relationships of gut microbiota, short-chain fatty acids, inflammation,
and the gut barrier in Parkinson’s disease. Molecular Neurodegeneration. 2021;16:6. doi:
10.1186/s13024-021-00427-6
- Na Li, Xingcui Wang, et al.
Change of intestinal microbiota in cerebral ischemic stroke patients. BMC
Microbiology. 2019;19:191. doi:
10.1186/s12866-019-1552-1
- Kihyun Lee,
Namil Kim at al. Gut bacterial dysbiosis in children
with intractable epilepsy. J Clin Med. 2021;10(5).
https://doi.org/10.3390/jcm10010005
- Anjiao
Peng, Xiangmiao Qiu, et al.
Altered composition of the gut microbiome in patients with drug-resistant
epilepsy. Epilepsy Research. 2018;147:102-07.
https://doi.org/10.1016/j.eplepsyres.2018.09.013
- Lanxiang Liu,
Haiyang Wang, Xueyi Chen, Peng Xie.
Gut microbiota: a new insight into neurological diseases. Chin Med J.
2023;136(11):1261-77. doi: 10.1097/CM9.0000000000002212
- Murakami T, Kamada K,
Mizushima K, Higashimura Y, Katada
K, Uchiyama K, et al. Changes in intestinal motility and gut microbiota
composition in a rat stress model. Digestion. 2017;95(1):55-60. doi: 10.1159/000452364
- Cryan JF, O’Riordan KJ, Cowan CSM, Sandhu KV, Bastiaanssen
TFS, Boehme M, et al. The microbiota-gut-brain axis. Physiol
Rev. 2019;99(4):1877-2013. doi:
10.1152/physrev.00018.2018
- Faulin T, Estadella D. Alzheimer’s disease and its relationship with
the microbiota-gut-brain axis. Arq gastroenterol.
2023.;60(1). doi:
10.1590/S0004-2803.202301000-17
- Nannan Li,
Qi Wang, Yan Wang, Anji Sun, Yiwei Lin, Ye Jin, Xiaobai Li, et al. Fecal
microbiota transplantation from chronic unpredictable mild stress mice donors
affects anxiety-like and depression-like behavior in recipient mice via the gut
microbiota-inflammation-brain axis. Stress. 2019;22(5):592-602. doi: 10.1080/10253890.2019.1617267
- Zheng P, Zeng B, Liu M, Chen J, Pan J, Han Y, et al.
The gut microbiome from patients with schizophrenia modulates the
glutamate-glutamine-GABA cycle and schizophrenia-relevant behaviors in mice.
Sci Adv. 2019;5(2):eaau8317. doi:
10.1126/sciadv.aau8317
- Mejía-Granados
DM, Villasana-Salazar B, Coan
AC, Balthazar MLF, Godoi AB, Canto AM, et al. Gut
microbiome in neuropsychiatric disorders. Arq Neuro-Psychiatr. 2022;80(2). doi:
10.1590/0004-282X-ANP-2021-0052
- Aho VTE, Pereira
PAB, Voutilainen S, Paulin L, Pekkonen
E, Auvinen P, et al. Gut microbiota in Parkinson's
disease: Temporal stability and relations to disease progression. EBioMedicine. 2019;44:691-707. doi: 10.1016/j.ebiom.2019.05.064
- Glover ME, Cohen JL, Singer JR, Sabbagh MN, Rainville JR, Hyland MT, et al. Examining the role of
microbiota in emotional behavior: antibiotic treatment exacerbates anxiety in
high anxiety-prone male rats. Neuroscience. 2021;459:179-97. doi: 10.1016/j.neuroscience.2021.01.030
- Ping Liu, Li Wu, et al. Altered
microbiomes distinguish Alzheimer’s disease from amnestic mild cognitive
impairment and health in a Chinese cohort. Brain, Behavior, and Immunity
2019;80:633-43. doi: 10.1016/j.bbi.2019.05.008
- Vogt NM, Kerby RL, et al. Gut microbiome alterations
in Alzheimer’s disease. Scientific
Reports. 2017;7:13537. [acesso
em 25 ago 2023]; Disponível em:
https://www.nature.com/articles/s41598-017-13601-y
- Chunxiao Li, Li Cui et al. Gut microbiota
differs between parkinson’s disease patients and
healthy controls in Northeast China. Front Mol Neurosci.
2019;12. doi: 10.3389/fnmol.2019.00171
- Arora K, Green M, Prakash S. The microbiome and
Alzheimer's Disease: potential and limitations of prebiotic, synbiotic, and probiotic formulations. Front Bioeng Biotechnol. 2020;8:537847. doi:
10.3389/fbioe.2020.537847
- Naomi R, Embong H, Othman F,
Ghazi HF, Maruthey N and Bahari
H. Probiotics for Alzheimer's disease: a systematic review. Nutrients.
2021;14(1):20. doi: 10.3390/nu14010020
- Cekanaviciut E, Yoo BB, Runia TF, Baranzini SE, et al. Gut
bacteria from multiple sclerosis patients modulate human T cells and exacerbate
symptoms in mouse models. PNAS. 2017;114(40):10713-18. doi:
10.1073/pnas.1711235114
- Cantarel BL, Waubant E, et al. Gut microbiota in multiple sclerosis:
possible influence of immunomodulators. Journal of Investigating Medicine.
2015 ;63(5):729-34. doi:
10.1097/JIM.0000000000000192
- Keshavarzian A,
Green SJ, et al. Colonic bacterial composition in Parkinson's disease. Movement Disorders. 2015;10:1351-60. doi:
10.1002/mds.26307
- Aho VTE, Houser MC,
at al. Relationships of gut microbiota, short-chain fatty acids, inflammation,
and the gut barrier in Parkinson’s disease. Molecular Neurodegeneration. 2021;16:6. doi: 10.1186/s13024-021-00427-6
- Na Li, Xingcui Wang, et al.
Change of intestinal microbiota in cerebral ischemic stroke patients. BMC
Microbiology. 2019;19:191. doi:
10.1186/s12866-019-1552-1
- Kihyun Lee,
Namil Kim at al. Gut bacterial dysbiosis in children
with intractable epilepsy. J Clin Med. 2021;10(5). doi:
10.3390/jcm10010005
- Anjiao Peng, Xiangmiao Qiu, et al. Altered composition of the gut microbiome in patients with drug-resistant epilepsy. Epilepsy Research. 2018;147:102-07. doi: 10.1016/j.eplepsyres.2018.09.013
