ARTIGO
ORIGINAL
Impacto
da doença renal crônica na função muscular respiratória de pacientes em
tratamento hemodialítico
Impact of chronic kidney disease in respiratory muscular function of
patients in hemodialysis treatment
Danilo Rocha Santos
Caracas, Ft.*, Mariane Alves Souza**, Ruth Maria Caracas Rocha, Ft.***,
Gleidson Ferreira Santos**, Daliane Barbosa Lima**, Rodrigo Rocha Ivo**,
Luciana Araújo Reis, Ft., D.Sc.****, Constança
Margarida Sampaio Cruz, D.Sc.*****
*Professor
Assistente da Faculdade Independente do Nordeste, Mestrando da Escola Bahiana
de Medicina e Saúde Pública, **Acadêmico(a) do Curso de fisioterapia da Faculdade
Independente do Nordeste, ***Professora Assistente da Faculdade de Tecnologia e
Ciências, ****Pós-Doutorado em Saúde Coletiva pelo Instituto de saúde Coletiva
da Universidade Federal da Bahia, Professora adjunta da Faculdade Independente
do Nordeste; *****Médica Nefrologista, Professora Adjunta da Pós-graduação em
Medicina e Saúde Humana da Escola Bahiana de Medicina e Saúde Pública
Recebido em 15 de
maio de 2016; aceito em 18 de maio de 2017.
Endereço
para correspondência:
Danilo Rocha Santos Caracas, Avenida Iolando Fonseca, 18, Bairro Jurema,
45023-030 Vitória da Conquista BA, E-mail: danilorochafisio@yahoo.com.br;
Mariane Alves Souza: marianefisi_@hotmail.com; Ruth Maria Caracas Rocha:
ruthcaracas@hotmail.com; Gleidson Ferreira Santos: 01gleidson@gmail.com;
Daliane Barbosa Lima: dalianeblima@gmail.com; Rodrigo Rocha Ivo:
rocharodrigo2013@gmail.com; Luciana Araújo Reis: lucianareisfainor@gmail.com;
Constança Margarida Sampaio: constancacruz@yahoo.com.br
Resumo
A
Doença Renal
Crônica é uma síndrome clínica
responsável por um ciclo de alterações
físicas,
sistêmicas e fisiológicas, na qual se destaca a miopatia
urêmica como
responsável por comprometer a estrutura e a funcionalidade da
musculatura
esquelética. O objetivo deste estudo foi avaliar o impacto da
insuficiência
renal crônica em estágio terminal na força muscular
respiratória. Estudo
prospectivo, transversal composto por 113 voluntários com
insuficiência renal
crônica em tratamento dialítico. Os dados foram analisados
por meio da
estatística descritiva e inferencial, que adotou um p valor <
0,05,
considerado estatisticamente significativo. A média de idade foi
de 54,1 ± 10,6
anos, predominando o sexo masculino. O tempo médio de tratamento
hemodialítico foi
de 30,7 ±11,6 meses. A média das pressões
inspiratórias e expiratórias máximas
foi 72,2 ± 19,8 cm H2O e 81,1 ± 19,4 cm H2O
respectivamente. Os pacientes
nefropatas dialíticos apresentaram disfunção
muscular inspiratória moderada e
disfunção muscular expiratória leve. As
alterações musculares obtiveram
correlações significativas com as taxas de
filtração glomerular, a força
muscular periférica e os marcadores de qualidade do tratamento
hemodialítico.
Conclui-se que os pacientes com Doença Renal Crônica em
tratamento dialítico
cursam com disfunção na força muscular
respiratória inspiratória e expiratória
e tais comprometimentos estão diretamente relacionados à
progressão da
patologia renal.
Palavras-chave: doença renal
crônica, hemodiálise, força muscular.
Abstract
Chronic kidney disease is a clinical syndrome responsible for a cycle of
physical, systemic, and physiological changes and the uremic myopathy is
responsible for compromising skeletal muscle structure and function. The aim of
this study was to evaluate the impact of end-stage chronic kidney failure on
respiratory muscle strength. It is a prospective, cross-sectional study with
113 volunteers with chronic kidney disease in dialysis. Data were analyzed
using descriptive and inferential statistics, and adopted p value < 0.05,
which is considered statistically significant. The mean age was 54.1 ± 10.6
years, and male gender predominance. The mean time of hemodialysis was 30.7 ±
11.6 months. The mean inspiratory and maximum expiratory pressures were - 72.2
(± 19.8 cm H2O and 81.1 ± 19.4 cm H2O, respectively. Dialytic nephropathy
patients had moderate inspiratory muscle dysfunction and mild expiratory muscle
dysfunction. Muscle changes were significantly correlated with glomerular
filtration rates, peripheral muscle strength, and markers of hemodialytic
treatment quality. It is concluded that patients with chronic kidney failure
undergoing dialysis treatment have dysfunction in inspiratory and expiratory
respiratory muscle strength and such impairments are directly related to the
progression of renal pathology.
Key-words: chronic
kidney disease, hemodialysis, muscle strength.
Introdução
A Insuficiência Renal
Crônica (IRC) é uma síndrome clínica, que pode ser caracterizada por uma
diminuição significativa, lenta, gradual e progressiva, representando não
somente falência da excreção renal, mas também das funções metabólicas e
endócrinas dos rins [1].
A incidência de
pacientes com IRC aumenta progressivamente, tanto no Brasil como no mundo,
tratando-se de uma questão relevante de saúde pública, sendo o diabetes
mellitus e a hipertensão arterial sistêmica os fatores etiológicos mais
prevalentes [2,3].
O diagnóstico e
monitoramento da IRC são dados através da avaliação da Taxa de Filtração Glomerular
(TFG), além de prever complicações e auxiliar no suporte terapêutico. Uma queda
nessa taxa pode estar relacionada ao surgimento de sinais e sintomas de
falência renal. A TFG é medida indiretamente por meio de exames laboratoriais
como o clearance ou depuração de creatinina e a creatinina sérica [4].
Após ter sido
confirmado o diagnóstico e constatado o estágio V de IRC, o indivíduo é
submetido a um tratamento substitutivo, podendo ser hemodiálise ou a diálise
peritoneal [5]. A terapêutica mais utilizada é a hemodiálise, que tem o
objetivo de remover os solutos urêmicos que estejam acumulados e o excesso de
líquidos, restabelecendo assim o equilíbrio eletrolítico e ácido básico do
organismo [6].
A IRC gera várias
alterações físicas, sistêmicas e fisiológicas, sendo o sistema respiratório um
dos mais prejudicados [7]. A função respiratória é afetada tanto pelo
tratamento que é realizado (hemodiálise ou diálise peritoneal), quanto pela
própria doença [6,8,9]. A uremia e a diálise danificam
a mecânica, função muscular e troca de gases [7,10]. Uma das principais causas
de perda dessa capacidade é a diminuição da força dos músculos responsáveis
pela dinâmica respiratória [6,11].
Existem alguns
procedimentos que avaliam a função pulmonar, dentre eles a manovacuometria que
mensura as pressões respiratórias máximas (PRM) investigando, assim, a força
dos músculos respiratórios [12]. A força dos músculos expiratórios é
representada pela pressão expiratória máxima (PEmáx) e
a dos músculos inspiratórios através da pressão inspiratória máxima (PImáx)
[12].
Apesar da IRC ser uma
patologia exaustivamente estudada, há uma lacuna literária ao se tratar das
relações existentes entre a doença renal crônica em estágio terminal (Grau V de
IRC) e o comprometimento muscular respiratório. Principalmente que reportem a
criarem um modelo etiológico que ajudem as equipes a identificarem os pacientes
com maiores predisposições a desenvolver alterações musculares e
consequentemente cursarem com declínio funcional. Sendo assim, o objetivo deste
estudo foi avaliar o impacto da Insuficiência Renal Crônica em estágio terminal
na força muscular respiratória, trazendo fundamentação técnica e científica na
identificação de alterações pulmonares subclínicas em pacientes nefropatas,
fazendo assim surgir um novo pensar clínico para a população estudada.
Material
e métodos
O estudo seguiu um
desenho transversal, no qual foram avaliados 140 indivíduos em tratamento
hemodialítico em duas clínicas especializadas em tratamento de doença renal na
cidade de Vitória da Conquista, Bahia, entre os meses de agosto de 2015 a julho
de 2016.
Foram excluídos do
estudo pacientes que apresentavam doenças
neuromusculares prévias, doenças cardíacas ou pneumológicas diagnosticadas,
tabagismo atual ou ex- tabagismo com período de abstinência inferior a 2 anos.
Pacientes com condição cognitiva suficiente para compreender os comandos de
execução do teste de força muscular, que não tivessem apresentado nenhum quadro
respiratório nos últimos 3 meses e que estavam em
tratamento dialítico por um período superior a três meses foram incluídos.
Dos 140 pacientes
avaliados, 27 foram excluídos por não se adequarem aos critérios (12 foram
excluídos por não terem conseguido executar o teste corretamente, mesmo após 6 tentativas e exaustivas explicações; 5 por apresentarem
dados laboratoriais incompletos; 1 se negou a continuar na pesquisa por queixa
de cefaleia após a primeira avaliação; 03 por apresentarem sintomas de doenças
respiratórias no momento da realização da coleta). Logo, foram incluídos na
análise dados de 113 pacientes nefropatas dialíticos.
A avaliação dos
pacientes foi realizada trinta minutos após uma sessão de hemodiálise em que
não transcorresse mais de 48 horas desde a sessão anterior. Todos os pacientes
incluídos neste estudo assinaram um Termo de Consentimento Livre e Esclarecido,
sendo informados dos riscos, benefícios e da metodologia que seria empregada
para aquisição dos dados. O estudo foi aprovado pelo comitê de ética e pesquisa
da Faculdade Independente do Nordeste com o número de Protocolo 1.825.505.
Os dados referentes
às características clínicas e demográficas foram extraídos dos prontuários dos
pacientes e anotados num questionário semiestruturado, no qual incluíam as
seguintes informações: idade, sexo, raça, grau de instrução, peso
pré-hemodiálise e peso pós- hemodiálise, ganho de peso interdialítico,
etiologia da DRC, doenças prévias e concomitantes, índice de massa corporal
(IMC), função renal residual, tratamento conservador prévio, tempo de terapia
renal substitutiva e o valor da Kt/V total. A ocorrência de hospitalizações,
processos infecciosos e presença de intercorrências relacionadas ao tratamento
dialítico nos três meses anteriores ao estudo foram computados.
Para avaliação da
força muscular respiratória foi utilizado um manovacuômetro digital modelo MVD
300 (GlobalMed, RS, Brasil), escalonado em cmH2O. Foi
conectada ao manovacuômetro uma tubulação plástica, adaptando na sua
extremidade distal um bucal cilíndrico descartável, com diâmetro interno de 32
mm. Anteriormente ao bucal, foi colocado um dispositivo de plástico rígido com
um pequeno orifício de 2 mm de diâmetro interno e 1,5
mm de comprimento, com a finalidade de propiciar pequeno vazamento de ar e,
desta forma, prevenir a elevação da pressão da cavidade oral gerada
exclusivamente por contração da musculatura facial com o fechamento da glote
[12].
As medidas foram
coletadas pelo mesmo pesquisador e realizada sob comando
verbal homogêneo, com os pacientes sentados e tendo as narinas ocluídas por uma
pinça nasal para evitar o escape de ar. A PImáx foi
medida durante esforço iniciado a partir da capacidade residual funcional. A PEmáx foi medida durante esforço iniciado a partir da
capacidade pulmonar total. Os pacientes executaram no mínimo três esforços de
inspiração máxima, tecnicamente satisfatórios, ou seja, sem vazamento de ar
perioral e com valores próximos entre si (menor ou igual a 10%), e foi
considerada para o estudo a medida de maior valor. Os esforços em cada manobra
foram mantidos por no mínimo 3 segundos [12]. O nível de severidade da
disfunção muscular respiratória foi definido de acordo com os percentuais
espirométricos: Norma (>80% do valor predito), Leve (70%-79% do predito),
moderado (60-69% do predito), moderadamente severo (50%-59% do predito), severo
(35%-49% do predito) e muito severo (<35% do predito) [13]. Utilizaram-se as
fórmulas propostas por Dirceu Costa et al. [14] para
definição dos valores preditos da Força Muscular Respiratória, com base na
musculatura analisada, gênero e idade.
As amostras
sanguíneas foram coletadas dentro da rotina específica de cada serviço por
laboratório comum e credenciado às duas clínicas de tratamento de doença renal,
onde a pesquisa foi realizada. Foram utilizadas as médias dos três últimos
exames laboratoriais, e o último exame não poderia ter um período superior a 30
dias da sua realização no momento da coleta dos dados. Analisaram-se os valores
de ureia pré e pós-hemodiálise, creatinina, potássio, sódio, hemácias,
hemoglobina, hematócrito, proteínas, albuminas, globulinas, 25 hidroxivitamina
D e hormônio paratireiodiano (PTH).
Análise
estatística
Os dados com
distribuição paramétrica foram descritos como média e mais ou menos desvio
padrão, e aqueles com distribuição não paramétrica em mediana e intervalos
interquartis, as variáveis categóricas foram descritas em f n absoluto
(frequências). As comparações entre os grupos foram feitas pelos testes
t-Student e Mann-Whitney, quando apropriado. Os testes de Chi-quadrado ou exato
Fisher foram usados para comparações de proporções. Para comparações entre as
variáveis numéricas utilizou-se o coeficiente de correlação de Spearman. Um
valor de p < 0,05 foi considerado estatisticamente significativo. Todas as
análises estatísticas foram realizadas utilizando-se o programa SPSS para o
Windows (versão 20.0; SPSS, Chicago, IL).
Resultados
Os participantes do
estudo em sua maioria eram indivíduos de meia idade do sexo masculino, em
tratamento hemodialítico por um período aproximado de 31 meses sendo o
principal fator etiológico da insuficiência renal crônica na população estudada
a nefroesclerose hipertensiva. A anemia estava presente em 48% dos pacientes
juntamente com 44% da amostra com deficiência de vitamina D definida como
25-Hidroxivitamina D < 40. A média da análise da força muscular global
analisada através da escala MRC evidenciou redução generalizada da força
muscular e a medida de independência funcional indicou dependência funcional
leve, conforme dados da tabela I.
Tabela
I - Perfil clínico dos pacientes com IRC que
realizam hemodiálise.

GNC = Glomerulonefrite
crônica; NEH = Nefroesclerose Hipertensiva; DM2 = Diabetes Mellitus Tipo 2; UO = Uropatia Obstrutiva; DRP = Doença Renal Policistica;
IMC = Indice de Massa Corpórea; RRU = Redução relativa da Ureia; PTH = Hormônio
Paratireoideano; GPID = Ganho de Peso Interdialítico; MRC = Medical Research
Council; MIF = Medida de Independência Funcional.
Na tabela II
observa-se o perfil muscular respiratório dos pacientes com insuficiência renal
crônica em terapia substitutiva. Constata-se severidade moderada (60% - 69% do
valor predito) na Pimáx e leve (70% - 79% do valor predito) na Pemáx.
Tabela
II -
Características das pressões respiratórias máximas.

Pimax = Pressão
Inspiratória Máxima; Pemax = Pressão Expiratória Máxima.
Na análise de
correlação, a Pimáx correlacionou-se negativamente com o ganho de peso
interdialítico, e, positivamente com o Kt/V total, hemoglobina, hematócrito, 25
hidroxivitamina D e o PTH. Enquanto que a Pemáx se correlacionou negativamente
com a idade e positivamente com a hemoglobina, a 25-Hidroxivitamina D e força
muscular global periférica (Tabela III).
Tabela
III
- Correlação entre as Pressões
Respiratórias Máximas e variáveis comumente analisadas no paciente nefropata
dialítico.
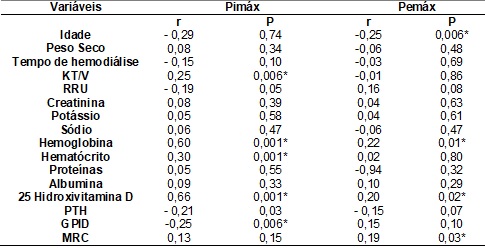
RRU = Redução relativa
da Ureia; PTH = Hormônio Paratireoideano; GPID = Ganho de Peso Interdialítico;
MRC = Medical research council; *Valores com correlação significativa
(p<0,05)
Mediante análise da
figura 1 observa-se que existe uma relação direta e estatisticamente
significativa entre a capacidade de independência funcional e a força muscular
respiratória inspiratória (A) e expiratória (B) nos pacientes com IRC em
tratamento hemodialítica.
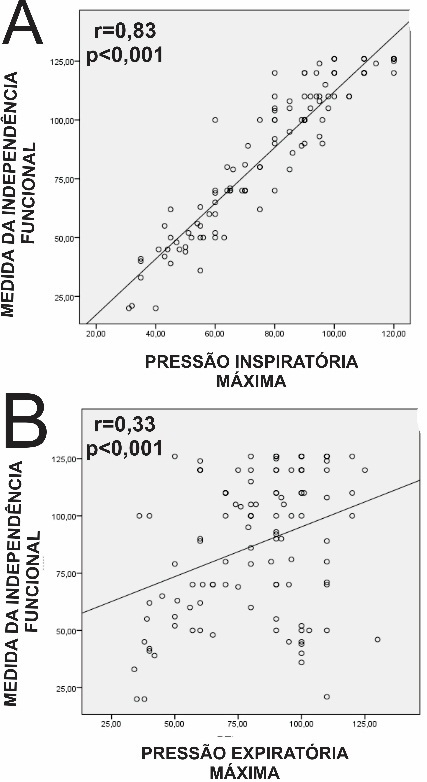
Figura
1 - Correlacoes entre os escores da MIF e
pressao inspiratoria maxima (A) e a pressao expiratoria maxima (B).
A gravidade da doença
renal crônica avaliada através da taxa de filtração glomerular mostrou uma
correlação significativa com as pressões inspiratória máxima (A) e as pressões
expiratórias máximas (B), mostrando que quanto maior o comprometimento renal
maior o impacto na musculatura respiratória.
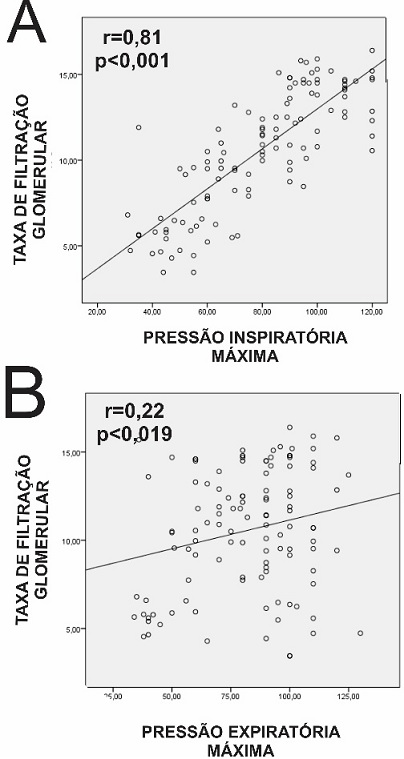
Figura
2 - Correlacoes entre a TFG e pressao
inspiratoria maxima (A) e a pressao expiratoria maxima (B).
Discussão
A prevalência de
comprometimento muscular secundário à doença renal crônica no Brasil ainda se
faz desconhecida, devido à escassez de trabalhos tratando do assunto em
específico. Um estudo sueco avaliou a prevalência de atrofia muscular em
pacientes nefropatas dialíticos em torno de 30% [15]. Dado que corrobora o
presente trabalho, apesar do mesmo ter utilizado metodologias de definição
diferentes. Diversos trabalhos experimentais tentam traçar um perfil
histológico das fibras musculares do paciente urêmico [16,17].
Estudos com
eletromicroscopia revelam que o músculo periférico urêmico apresenta
importantes degenerações das bandas Z, redução dos miofilamentes e dano
mitocondrial, situações que estão intimamente ligadas a alterações
histoquímicas relacionadas a reduções dos agentes oxidativos, aeróbicos e
contrateis das fibras musculares do paciente nefropata [18-20].
Os fatores
etiológicos da miopatia urêmica ainda se fazem obscuros na atualidade, porém
alguns parecem estar relacionados ao comprometimento muscular, tais como:
aumento de toxinas urêmicas, decréscimo do fluxo sanguíneo muscular, anemia,
fraqueza muscular, alterações no metabolismo energético, hipometabolismo de
vitamina D e neuropatia periférica [21].
Por diversas causas
já apresentadas, a força muscular periférica dos pacientes nefropatas
dialíticos estão alterados. A musculatura respiratória por apresentar perfis
histológicos e funcionais semelhantes aos demais músculos periféricos é
comprometido na mesma proporção. No atual estudo foi constatado que a força
muscular inspiratória e expiratória estavam reduzidas
quando comparadas aos valores de referência compatível com idade e gênero,
dados similares aos já descritos pela literatura [22]. Porém, verifica-se que o
processo de degeneração muscular potencializada e acelerada é comum nos
indivíduos com miopatia urêmica [23]. Vale ressaltar que o maior impacto gerado
na musculatura respiratória nos pacientes nefropatas dialíticos é na porção
inspiratória. Esse achado se deve provavelmente aos esforços catabióticos
provenientes de alterações restritivas pulmonares associadas e alterações
tróficas diafragmáticas [19].
O aumento de toxinas
urêmicas acarreta maior comprometimento das funções musculares, gerando
anormalidades no metabolismo energético. Já foi descrito que a depuração dessas
toxinas está diretamente relacionada à qualidade da dose dialítica ofertada ao
paciente [21]. No presente estudo, observou-se uma relação positiva entre a
força muscular inspiratória e o valor do Kt/Vtotal, confirmando o racional de
que quanto maior a depuração das toxinas urêmicas pela hemodiálise, maior o
metabolismo energético celular, sendo necessária a avaliação continua desses
marcadores.
A disfunção muscular
nos pacientes nefropatas está intimamente ligada à presença de anemia crônica,
visto que a mesma reduz a oferta de oxigênio ao músculo e altera a taxa de
fluxo sanguíneo direcionado [24]. Fato também comprovado pelo presente trabalho
quando se verificou a relação significativa entre os níveis de hemoglobina com
as pressões inspiratória e expiratória máxima, confirmando o impacto da
hemoglobinemia na funcionalidade do músculo respiratório.
A vitamina D atua no
complexo celular muscular através de importantes mecanismos de ligações a
receptores nucleares e de membrana. Por meio dessas funções a vitamina D age no
transporte de cálcio, na síntese proteica e com muita eficiência na velocidade
de contração muscular [25]. A descrição dos efeitos da deficiência dessa
vitamina já está exaustivamente descrita pela literatura [25]. Os pacientes com
insuficiência renal crônica comumente cursam com hipovitaminose D, e essa
condição altera o metabolismo energético e o processo de excitação-contração
muscular, tornando o paciente suscetível a desenvolvimento da miopatia urêmica
[26]. Fato confirmado pelo presente estudo, sendo este o fator de maior
relação, analisado através r = 0,66 com a força muscular respiratória.
O ganho de peso
interdialítico está diretamente associado ao acúmulo de líquidos corpóreos e
consequentemente no meio extravascular pulmonar. Essa alteração geralmente se
faz presente quando os níveis de GPID excedem 5%, sendo esses valores
associados a modificações na permeabilidade das vias aéreas e alteração na
complacência pulmonar [27]. Essas alterações presentes no sistema respiratório
configuram uma sobrecarga na musculatura inspiratória, fazendo com que o
aumento substancial da GPID se correlacione inversamente com a pressão
inspiratória máxima.
Os fatores causais
relacionados com a redução das propriedades de força muscular respiratória são
advindos da miopatia urêmica. Eles incluem a redução da massa muscular (área de
secção transversa, principalmente das fibras tipo II), diminuição da síntese
proteica muscular e do metabolismo oxidativo, justificando, assim, a redução da
capacidade de força muscular respiratória dos indivíduos portadores de IRC
[22], consequentemente alterando os perfis metabólicos da musculatura
periférica, reduzindo o limiar de fadiga, aumentando a intolerância precoce ao
exercício físico, fazendo com que os pacientes nefropatas dialíticos cursem com
fragilidade e declínio funcional importante.
A melhor maneira de
avaliar o funcionamento renal se dá através da análise da TFG. Esta pode ser
determinada pela dosagem da creatinina sérica e/ou pela depuração desta pelo
rim, considerando uma TFG com valor menor que 60mL/min/1,73m2
significa uma diminuição de aproximadamente 50% da funcionalidade renal normal
e, abaixo disso, ocorre um aumento da prevalência de complicações relacionadas
a IRC [14]. Nos pacientes idosos, há um maior predomínio da IRC, pois a TFG
diminui com o decorrer dos anos. Cerca de 17% dos
indivíduos com idade maior que 60 anos apresentam TFG menor que 60
mL/min/1,73m2 [28,29].
No presente estudo,
pode-se observar que ao correlacionar a TFG e as pressões respiratórias
máximas, obtiveram-se resultados significativos, podendo-se inferir que quanto
menor a TFG, menor a força da musculatura respiratória. Muitos trabalhos na
literatura têm abordado a IRC, porém, dentre os artigos pesquisados não há
estudos que relacionem a TFG e a análise das pressões respiratórias máximas,
podendo contribuir para a elucidação dos mecanismos da TFG que alteram a
capacidade de força muscular respiratória destes indivíduos.
Conclusão
Conclui-se que os
pacientes com IRC em tratamento dialítico cursam com disfunção na força
muscular respiratória inspiratória e expiratória e tais comprometimentos estão
diretamente relacionados à progressão da patologia renal.
Referências
- Romão Jr JE. Doença
renal crônica: definição, epidemiologia e classificação. J Bras Nefrol 2004;26(3Supl1):S1-3.
- K/DIGO clinical practice guidelines for chronic kidney disease:
evaluation, classification and stratification. Am J Kidney Dis 2013;39
(Suppl 3):S1-S136.
- Ministério da Saúde
do Brasil, Secretaria de Assistência à Saúde – Estudo epidemiológico brasileiro
sobre terapia renal substitutiva. Brasília; 2002.
- Passos VMA, Barreto SM, Lima-Costa MFF. Bambui Health and Ageing Study (BHAS) Group –
Detection of renal dysfunction based on serum creatinine levels in a Brazilian
community. The Bambuí Health and
Ageing Group. Braz J Med Biol
Res 2003;36:393-401.
- Rossert JA, Wauters JP – Recommendations for the
screening and management of patients with chronic kidney disease. Nephrol Dial Transplant 2002;17(Suppl 1):19-28.
- Moore GF, Parsons DB, Stray-Gundersen J,
Painter PL, Brinker KR, Michell JH. Uremic myopathy limits aerobics capacity in hemodialysis patients. Am J
Kidney Dis 1993;22:277-87.
- Pickering M, Jones FX. The
diaphragm: two physiological muscles in one. J Anat
2002;201(4):305-12.
- Fahal IH, Bell GM. Uraemic
myopathy: Fact or fiction. Int J Artif Organs 1998;21(4):185-7.
- Vieira WP, Gomes KW,
Frota NB, Andrade JE, Vieira RM, Moura FE et al.
Manifestações musculoesqueléticas em pacientes submetidos a hemodiálise. Rev
Bras Reumatol 2005;45(6):357-64.
- Moreira PR, Barros E.
Atualização em fisiologia e fisiopatologia renal: bases fisiopatologicas da
miopatia na insuficiência renal crônica. J Bras Nefrol 2000;22(I):201-8.
- Allen DG, Lamb GD, Westerblad H. Skeletal
muscle fatigue: cellular mechanisms. Physiol Rev 2008;88:287-32.
- Black LF, Hyatt RE. Maximal respiratory pressures: normal values and
relationship to age and sex. Am Rev Respir Dis 1969;99(5):696-702.
- Miller MR, Hankinson J, Brusasco V et al. Standardisation of spirometry. Eur
Respir J 2005;26:319.
- Costa D, Gonçalves HA,
Lima LP, Ike D, Cancelliero KM, Montebelo ML. Novos valores de referência para
pressões respiratórias máximas na população brasileira. J Bras Pneumol 2010;36(3):306-12.
- Carrero JJ,
Chmielewski M, Axelsson J, Snaedal S, Heimburger O, Barany P et
al. Muscle atrophy, inflammation and clinical outcome in
incident and prevalent dialysis patients. Clin Nutr 2008;27:557-64.
- Thomas PK, Hollinrake K, Lascelles RG. The polyneuropathy of chronic renal failure.
Brain 1971;94:761-8.
- Bhattacharya A, Muller FL, LiuY, Sabia M, Liang H, Song W et al. Denervation induces cytosol
licphospholipase A2 mediated fatty acid hydro
peroxide generation by muscle mitochondria. J Biol Chem 2009;284:46-55.
- McArdle A, Pattwell D, Vasilaki
A, Griffiths RD, Jackson MJ. Contractile
activity induced oxidative stress: cellular origin and adaptive responses. Am J
Physiol Cell Physiol 2001;280:C621–C7.
- Benedetti TR, Bertoldo APC, Rodriguez-Añez CR, Mazo GZ, Petroski EL. Reprodutibilidade e validade do Questionário
Internacional de Atividade Física (IPAQ) em homens idosos. Rev Bras Med Esporte 2007;13(1):6-13.
- Wang XH, Mitch WE. Muscle
wasting from kidney failure a model for catabolic conditions. Int J Biochem Cell Biol 2013;45:2230-38.
- Floyd M, Ayyar DR, Barwick DD, Hudgson P, Weightman D. Myopathy
in chronic renal failure. QJM 1974;43:509-24.
- Bark H, Heimer D, Chaimovitz
C, Mostos lovski M. Effect
of chronic renal failure on respiratory muscle strength. Respiration 1988;54(3):153-61.
- Cheung WW, Paik KH, Mak RH. Inflammation
and cachexia in chronic kidney disease. Pediatr
Nephrol 2010;25:711-24.
- Bradley JR, Anderson JR, Evans DB, Cowlen Aj. Impaired
nutritive skeletal muscle blood flow in patients with chronic renal failure.
Clin Sci 1990;49:51-5.
- Crowe AV, McArdle A, McArdle F, Pattwell DM,
Bell GM, Kemp GJ et al. Markers of oxidative stress in the skeletal muscle of
patients on hemodialysis. Nephrol Dial Transplant 2007;22:1177-83.
- Maeda SS, Borba VZC,
Camargo MBR, Silva DMW, Borges JLC, Bandeira F. Recomendações da Sociedade
Brasileira de Endocrinologia e Metabologia (SBEM) para o diagnóstico e
tratamento da hipovitaminose D. Arq Bras Endocrinol Metab 2014;58(5):411-33.
- Moore GF, Parsons DB, Stray-Gundersen J, Painter
PL, Brinker KR, Mitchell JH. Uremic
myopathy limits aerobics capacity in hemodialysis patients. Am J Kidney Dis
1993;22:277-87.
- Nerbass FB, Morais
JG, Santos RG, Krüger TS, Koene TT, Luz Filho HA. Fatores relacionados ao ganho
de peso interdialítico em pacientes em hemodiálise. J Bras Nefrol 2011;33(3):300-5.
- Schardong TJ, Lukrafka JL, Garcia VD. Assessment of
pulmonary function and quality of life in patients on maintenance hemodialysis.
J Bras
Nefrol 2008;30(1):40-7.