ARTIGO
ORIGINAL
Efeito
de pistas auditivas rítmicas na marcha de pacientes com Doença de Parkinson
Effect of rhythmic auditory cues on gait in patients with Parkinson’s
disease
Wilma Costa Souza, D.Sc.*, Gabriela de Oliveira Lima
Paim**, Alba Barros Souza Fernandes***, Marco Felipe Bouzada****,
Marco Orsini, D.Sc.*****
*Docente
do curso de Fisioterapia da Universidade Castelo Branco, Responsável pelo
estágio supervisionado em Fisioterapia Neurofuncional
do Centro Municipal de Reabilitação do Engenho de Dentro / CMR-ED, **Discente
do Curso de Graduação em Fisioterapia, Centro Universitário Serra dos Órgãos,
Teresópolis/Rio de Janeiro, ***Professora do Curso de Graduação em
Fisioterapia, Centro Universitário Serra dos Órgãos/Teresópolis, ****Aluno do
Programa de Mestrado e Doutorado em Ciências Aplicadas a Saúde,
USS/Vassouras, *****Professor do Programa de Mestrado e Doutorado em
Ciências da Reabilitação, Unisuam/Rio de Janeiro e
Ciências Aplicadas a Saúde, USS/Vassouras
Endereço
para correspondência:
Marco Orsini, E-mail: orsinimarco@hotmail.com; Wilma
Costa Souza: wilmacosta@fisioscience.com.br; Gabriela de Oliveira Lima Paim:
gabi_paim@hotmail.com; Alba Barros Souza Fernandes: alba.fernandes@gmail.com;
Marco Felipe Bouzada: m.bouzada@hotmail.com
Resumo
Contextualização: Os distúrbios da
marcha na Doença de Parkinson (DP) estão relacionados à inadequada padronização
sequencial dos movimentos. As pistas auditivas rítmicas (PAR) fornecem uma
cadência rítmica que ajuda na execução de movimentos automáticos. Objetivo: verificar o efeito das PAR no equilíbrio, na marcha e na qualidade de vida em
pacientes com DP. Métodos: trata-se
de estudo piloto exploratório e transversal com nove pacientes. Os pacientes
receberam 20 sessões de Fisioterapia convencional e caminharam ouvindo uma
música com ritmos alternados de 60, 80 e 120 batidas/minuto. Os instrumentos de
avaliação foram o Teste de Equilíbrio de Berg (TEB), a Escala Internacional de
Eficácia de Quedas (FES-I), o Parkinson’s Disease Questionnaire (PDQ-
39) e a medida da velocidade da marcha. Resultados:
observou-se melhora significativa (p ≤ 0,05) da velocidade da marcha, do
medo de quedas (FES-I) e da auto avaliação da
qualidade de vida relacionada à saúde (PDQ-39) nos domínios mobilidade,
atividades da vida diária e cognição. Não se observou melhora no TEB. Conclusão: As pistas auditivas
contribuíram para melhora dos parâmetros avaliados, exceto quanto ao
equilíbrio. São necessários mais estudos que apontem o melhor tipo de pista
auditiva, a frequência de uso, o tempo e a duração do tratamento para melhor
efetividade da técnica.
Palavras-chave: doença de
Parkinson, velocidade da marcha, desordens do movimento.
Abstract
Background: gait disorders in Parkinson's disease (PD) are related to
inappropriate movement’s sequential pattern. Rhythmic auditory cues (RAC)
provide a rhythmic cadence that helps automatic movements. Objective: to verify the effect of RAC in balance, gait and quality
of life in patients with PD. Methods:
This is an exploratory and transversal pilot study with nine patients. The
patients received 20 sessions of conventional physiotherapy and walked
listening to music with alternating beats of 60, 80 and 120 beats per minute.
The assessment instruments were the Berg Balance Test (TEB), the Falls Efficacy
Scale- International (FES-I), the Parkinson's disease Questionnaire (PDQ-39)
and the gait speed measurement. Results:
there were a significant improvement (p ≤ 0.05) in gait speed, fear of
falling (FES-I) and self-evaluation of health-related quality of life (PDQ-39)
as to mobility, activities of daily living and cognition. There was no
improvement in the TEB. Conclusion:
The auditory cues contributed to improvement of the evaluated parameters,
except for balance. More studies are needed that point out the best type of
auditory cue, frequency, treatment time and duration for better effectiveness
of the technique.
Key-words: Parkinson
disease, walking speed, movement disorders.
Introdução
A Doença de Parkinson
(DP) é uma desordem neurodegenerativa atribuída à
degeneração progressiva de neurônios dopaminérgicos na substância negra. Mais
recentemente, a doença vem sendo associada a sistemas dopaminérgicos dos
gânglios da base e de outras regiões do sistema nervoso central [1].
Os sintomas
característicos da doença, descritos por James Parkinson em 1817, são: tremor
de repouso, rigidez, instabilidade postural e bradicinesia.
Outros sintomas incluem falta de expressão facial, alteração da deglutição e
marcha de pequenos passos. Com a evolução da doença pode ocorrer declínio
cognitivo, especialmente da função executiva e da atenção [2].
Os distúrbios da
marcha estão entre os sintomas motores mais limitantes da doença. Observa-se
diminuição da velocidade, do comprimento do passo e da cadência além de
deficiência na flexão do quadril, do joelho e no apoio do calcanhar [3]. Há
dificuldades na iniciação, progressão e finalização da marcha [4]. Essas
alterações são resistentes ao tratamento medicamentoso e contribuem para um
risco de quedas nove vezes maior que em idosos sem a doença, pareados por
gênero e idade [5]. As frequentes quedas aumentam o medo de cair levando à
restrição da atividade física a ao isolamento [6].
A marcha normal
envolve a ativação e relaxamento simultâneos de diferentes músculos de forma
coordenada e com grande precisão temporal [1]. A coordenação temporal dos
movimentos parece depender de uma rede subcortical-tálamo-cortical
que inclui o cerebelo, os gânglios da base e a área motora suplementar [5].
A dificuldade de
realizar movimentos automáticos presente na DP relaciona-se ao comprometimento
principalmente do putamen, que garante a execução de
submovimentos em uma sequência automática [7]. Há, na verdade, um controle interno
inato, provavelmente dependente de dopamina estriatal,
que se pode chamar de “marcador do ritmo interno”, responsável pela
padronização sequencial dos movimentos da marcha [8].
Na DP esse marcador
interno está comprometido, mas pode ser substituído por pistas auditivas
rítmicas (PAR). As pistas propiciam uma cadência rítmica que ajuda na execução
de movimentos automáticos, informando ao paciente quando o próximo passo deve
ocorrer [9].
Importante destacar
que caminhar ouvindo música não promove a melhora da marcha. A eficácia do
tratamento com PAR está relacionada com a sincronização dos passos do indivíduo
com o ritmo externo oferecido, sendo necessária ainda discreta correção de
erros em alguns momentos [5].
Um dos primeiros estudos
com PAR, realizado nos anos 1990, mostrou resultados importantes em relação à
melhora dos parâmetros temporo-espaciais
da marcha [3]. Em uma revisão sistemática [10] foram descritos dois estudos
[11,12] randomizados e controlados de boa qualidade que utilizaram
PAR e apresentaram como resultado melhora significativa da marcha, do
comprimento do passo e da cadência.
Estudos atuais utilizam diferentes tipos de estímulo, como batidas de
metrônomo1, metrônomo inserido na música [13]3 ou som
de passos humanos [7].
O objetivo do
presente estudo foi verificar o efeito da PAR, oferecida sob a forma de batidas
de metrônomo inseridas em música, na melhora do equilíbrio, da marcha e da
qualidade de vida em pacientes com Doença de Parkinson.
Material
e métodos
Desenho
do estudo
Trata-se de um estudo
piloto exploratório e transversal com nove pacientes portadores de Doença de
Parkinson. O projeto foi aprovado pelo Comitê de Ética em Pesquisa (CEP) do
Centro Universitário Serra dos Órgãos sob o número CAAE: 48425315.6.0000.5247 e
todos os participantes assinaram o Termo de Consentimento Livre e Esclarecido.
Participantes
Os pacientes
incluídos foram recrutados na Clínica Escola de Fisioterapia do Centro
Universitário Serra dos Órgãos/RJ. Os critérios de inclusão foram: diagnóstico
de Doença de Parkinson até 10 anos; cognição mensurada pelo Mini Exame de
Estado Mental (score total ≥ 27 pontos) e gravidade da doença de leve a
moderada pela escala de Hoehn e Yahr
(1 a 3). Foram excluídos os pacientes com hipertensão sem controle, patologia
musculoesquelética que impeça o paciente de deambular livremente e alterações
respiratórias que impeçam a realização dos exercícios.
Instrumentos
de avaliação
Teste de equilíbrio
de Berg (TEB)
O teste é realizado
com o objetivo de avaliar o equilíbrio estático e dinâmico. Composto por 14
itens avalia atividades como estar de pé apoiando-se em um dos pés, pegar uma
caneta no chão ou colocar os pés alternadamente sobre um banco. A pontuação
máxima é de 56 pontos e quanto menor a pontuação total, maior será a alteração
do equilíbrio e, consequentemente, o risco de quedas [14].
Escala Internacional
de Eficácia de Quedas (FES-I)
A escala é utilizada
para medir o quanto o paciente está preocupado com a possibilidade de quedas em
suas atividades da vida diária. É composta por 16 itens, relacionados a
atividades praticadas durante o seu dia-a-dia, como, por exemplo, limpar a
casa; ir às compras; atender ao telefone. Apresenta um escore mínimo de 16
pontos e máximo de 64 pontos. Quanto maior for o escore total, maior será a
preocupação de quedas em relação à realização das atividades [15].
Parkinson’s Disease
Questionnaire (PDQ- 39)
O teste é composto
por 39 questões, que avalia a auto percepção da
qualidade de vida em pacientes parkinsonianos em relação ao mês anterior. Essas
questões são separadas nos seguintes domínios: mobilidade, atividades da vida
diária, bem-estar emocional, estigma, suporte social, cognição, comunicação e
desconforto corporal. É possível
verificar a pontuação em cada dimensão separadamente. Quando se calcula a
pontuação total, esta poderá variar em uma escala linear que vai de 0 (zero) a 100 (cem). Quanto mais próximo do zero, melhor a
percepção de qualidade de vida [16].
Os pacientes também
foram avaliados quanto à velocidade da marcha.
Procedimentos
O tratamento foi
realizado em vinte sessões, duas vezes na semana. Cada sessão teve a duração de
70 minutos, sendo 50 minutos de Fisioterapia convencional com exercícios de
fortalecimento muscular dos membros inferiores em decúbito dorsal com caneleira
de 1 kg nos tornozelos e rotação de tronco de pé na paralela, realizando três
séries com 10 movimentos cada. Todos os pacientes foram tratados na fase ON, ou
seja, entre 30 minutos a 1 hora após a medicação.
A caminhada com
pistas auditivas rítmicas foi realizada durante 20 minutos em pista de grama
sintética com 30 metros de comprimento livre, sem obstáculos, apenas com dois
cones marcando o ponto inicial da caminhada e o ponto final. Durante a
caminhada de 20 minutos, os pacientes utilizaram um aparelho MP4 da marca FitSport Player conectado a um Headphone tocando
a música Better off Alone,
onde se gravou os ritmos de 60, 80 e 120 batidas/minuto que se alternavam ao
longo da música. Durante a caminhada, os pacientes foram instruídos a
sincronizar seus próprios passos com as batidas contidas na música. Todos os
pacientes foram avaliados pré e pós-aplicação do
protocolo.
Análise
estatística
Os dados obtidos
foram comparados estatisticamente ao nível de 5% de probabilidade, através do
software IBM SPSS Statistics
Version 21. Para a aplicabilidade da comparação
dos resultados obtidos antes e após a aplicação do protocolo de tratamento, foi
testada a normalidade dos dados pelo Teste de Normalidade Kolmogorov-Smirnov.
Em seguida, foi aplicado o teste da mediana de Levene
para verificar a homogeneidade das variâncias. Como os dados apresentaram uma
distribuição normal, as comparações pré e
pós-tratamento foram realizadas através do Teste T- pareado.
Resultados
Participaram do
estudo nove pacientes, sendo dois do gênero feminino e sete do gênero
masculino, com idades entre 46 a 76 anos (67 ± 10,8 anos). O tempo de doença
variou de seis meses a 16 anos (45 ± 59,7 meses).
Todos os
participantes estavam entre os estágios 1,0 e 2,0 na Escala de Hoehn e Yahr Modificada, enquanto
o Mini Exame de Estado Mental variou entre os escores 20 a 30, o que indicava
boa cognição, levando-se em conta o nível de escolaridade de cada paciente. A
velocidade da marcha pré-tratamento foi de 0,87 ±
0,22 m/s e pós-tratamento 1,14 ± 0,27m/s (p = 0,014), apontando que houve
diferença estatística depois do tratamento.
A avaliação do
equilíbrio e do medo de queda através do Teste de Equilíbrio de Berg e da
Escala Internacional de Eficácia de Quedas- FES-1 apontou uma melhora
estatisticamente significativa pós-tratamento na Eficácia de Quedas (Tabela I).
Tabela
I – Análise do equilíbrio e do medo de quedas.

Valores expressos em
média ± desvio padrão. * Estatisticamente diferente dos valores obtidos antes
do tratamento.
Os resultados
pós-tratamento do Parkinson’s Disease Questionnaire (PDQ39) apontaram melhoras da auto percepção da qualidade de vida total (p = 0,014),
quanto nos domínios da mobilidade (p = 0,028), da atividade da vida diária (p =
0,003) e da cognição (p = 0,031). (Figura 1).
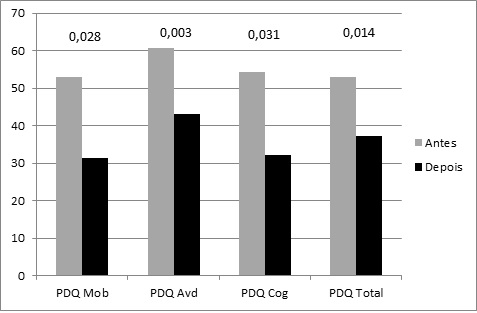
Figura
1 - Resultados do Parkinson’s
Disease Questionnaire
(PDQ-39) Total e suas dimensões
pré e pós-tratamento.
Discussão
Diversos estudos
apontam que o treinamento com PAR contribui para a melhora da marcha [1,3,8,13,17]. Embora haja diferenças em relação ao tipo de
pista utilizada e ao tempo de treinamento, os estudos citados mostraram
melhoras dos parâmetros têmporo-espaciais da marcha.
Um estudo [11] com 15 pacientes utilizou como PAR uma música instrumental, onde
foram inseridas batidas de metrônomo tendo obtido um aumento da velocidade da
marcha de 25%. No presente estudo, verificou-se um aumento de 31% na velocidade
da marcha. A diferença média pré e pós-tratamento foi
de 0,27 m/s. Ganhos acima de 0,22m/s indicam uma diferença clinicamente
importante de grande magnitude em pacientes com Doença de Parkinson [18].
O medo de cair tem
sido definido como uma preocupação que leva o indivíduo a evitar atividades e
tarefas que é capaz de executar, o que contribui para a redução dos níveis de
movimentação e da qualidade de vida [19]. Aproximadamente 15% dos idosos podem
apresentar quedas recorrentes, ou seja, quedas ao menos duas vezes ao ano,
entretanto, quando se trata da população com doença de Parkinson, estima-se que
50% dos pacientes têm quedas recorrentes ao ano [20]. Após tratamento, os
pacientes do estudo apontaram uma diminuição significativa do medo de cair.
Valores ≥ 30 na escala de Eficácia de Quedas indicam pacientes com quedas
recorrentes [21]. A média dos nove pacientes pós-tratamento foi de 34,67,
indicando ainda um risco aumentado de queda. Entretanto, o menor medo de cair
pode indicar uma diminuição de quedas recorrentes em longo prazo [22]. Além
disso, o maior medo de quedas tem sido associado a menor velocidade da marcha
[23]. Os pacientes do estudo apresentaram maior velocidade da marcha e menor
medo de quedas.
A instabilidade
postural presente na Doença de Parkinson não se modifica de forma importante
com a reposição de dopamina, provavelmente porque há envolvimento de outros
circuitos não dopaminérgicos nas alterações do equilíbrio e da marcha [21]. Os
pacientes estudados não apresentaram diferença estatisticamente significativa
em relação ao equilíbrio mensurado pelo Teste de Equilíbrio de Berg (42,78 no
pós-tratamento). Diferentes autores desenvolveram estudos para predição de
quedas a partir do TEB, destacando-se três notas de corte: 49,
47 e 45 pontos [24-26]. Os valores citados, assim como valores acima
destes, indicam ausência de risco de quedas. No presente estudo, o programa de
cinesioterapia aplicado não foi voltado para o treinamento direto de equilíbrio
e sim para o fortalecimento muscular, o que poderia explicar os resultados no
TEB.
O conceito de
qualidade de vida relacionada à saúde (QVRS) refere-se à percepção do
indivíduo, que pode ser afetada por uma condição de saúde ou modificada por uma
determinada terapêutica [27].
A avaliação
pós-tratamento através do PDQ-39 mostrou melhoras nos domínios mobilidade,
atividades da vida diária e cognição. O domínio mobilidade e a melhora da
velocidade da marcha foram relacionados em um estudo [28] com a percepção do
paciente acerca do melhor funcionamento motor. A QVRS está fortemente associada
a aspectos funcionais relacionados a dimensão
Atividade e Participação da Classificação Internacional de Funcionalidade
(CIF). O PDQ-39 em sua dimensão mobilidade formula questões como, cuidar da
casa, caminhar um quilômetro ou movimentar-se em locais públicos, refletindo,
portanto a QVRS [12].
O presente estudo
mostrou melhora pós-tratamento da cognição. O PDQ-39, nesse domínio, apresenta
quatro questões que se relacionam a sono repentino durante o dia, concentração,
memória e sonhos perturbadores. Um estudo [29] mostrou que apenas a memória se
correlacionou significativamente com diversos testes psicológicos. O sono
repentino e sonhos/alucinações sequer foram considerados itens relativos à
cognição. A conclusão desse estudo foi no sentido que o domínio cognição do
PDQ-39 possivelmente mensura um diferente constructo e que futuros estudos são
necessários para melhor compreensão desse domínio.
Conclusão
O presente estudo
apresentou resultados semelhantes a outros, citados nesse artigo, que
utilizaram PAR para melhora da velocidade da marcha, da mobilidade e das
atividades da vida diárias. São necessários mais estudos que apontem o melhor
tipo de pista auditiva, a frequência de uso, o tempo e a duração do tratamento
para melhor efetividade da técnica.
Referências
- Pau M, Corona F, Pill R, Casula C, Sors F,
Agostini T et al. Effects of physical rehabilitation integrated with rhythmic auditory
stimulation on spatio-temporal and kinematic
parameters of gait in Parkinson’s disease. Front Neurol
2016;7:126. https://doi.org/10.3389/fneur.2016.00126.
- Jancovik J. Parkinson’s
disease: clinical features and diagnosis. J
Neurol Neurosurg
Psychiatry 2008;79:368-376.
- McIntosh GC, Brown SH, Rice RR, Thaut MH. Rhythmic auditory-motor facilitation of gait patterns in patients
with Parkinson’s disease. J Neurol Neurosurg Psychiatry 1997;62:22-6.
- Chen PH, Wang RL, Liou DJ, Shaw JS. Gait
disorders in Parkinson’s disease: assessment and management. Int J Gerontol 2013;7:189-93.
- Nobela C, Hughes LE, Owen AM, Grahn JA. Into the groove: Can rhythm influence Parkinson's
disease? Neurosci Biobehavioral
Rev 2013;37(10 part 2):2564-2570.
- Bloem BR, Valkenburgb
VV, Slabbekoornb M, Willemsenb
MD. The multiple tasks test: development and normal strategies. Gait Posture
2001;14(3):191-202.
- Murgia M, Corona F, Pili R, Sors F, Agostini T,
Casual C et al. Rhythmic auditory stimulation (RAS) and motor rehabilitation in
Parkinson’s disease : new frontiers in assessment and intervention protocols.
Open Psychology J 2015;8(suppl3:M7):220-9.
- Ashoori A, Eagleman DM, Jankovic
J. Effects of auditory rhythm and music on gait disturbance in Parkinson’s
disease. Front Neurol
2015;6:234. http://doi.org/10.3389/fneur.2015.00234
- Hausdorff JM, Lowenthal J, Herman T, Gruendlinger
L, Giladi N. Rhythmic auditory stimulation modulates
gait variability in Parkinson's disease. Eur J Neurosci 2007;26(8):2369-75.
- Lim I, van Wegen E, de Goede
C, Deutekom M, Nieuwboer A,
Willems A et al. Effects of
external rhythmical cueing on gait in patients with Parkinson’s disease: a
systematic review. Clin Rehabil
2005;19:695-713.
- Thaut MH, McIntosh GC, Rice RR, Miller
RA, Rathbun J, Brault JM. Rhythmic auditory stimulation in gait training for Parkinson’s
disease. Mov Disord
1996;1:193-200.
- Ellis T, de Goede CJ, Feldman RG, Wolters EC, Kwakkel G, Wagenaar RC. Efficacy of a physical therapy program in
patients with Parkinson1s disease: a randomized controlled trial. Arch Phys Med Rehabil 2005(86):626-32.
- Benoit CE, Dalla Bella S, Farrugia
N, Obrig H, Mainka S, Kotz SA. Musically cued gait-training improves both
perceptual and motor timing in Parkinson’s disease. Front Hum Neurosci 2014;8:494. https://doi.org/10.3389/fnhum.2014.00494.
- Scalzo PL, Nova IC, Perracini MR, Sacramento DRC, Cardoso F, Ferraz HB. Validation of the Brazilian version of the Berg balance scale for
patients with Parkinson’s disease. Arq Neuropsiquiatr
2009;67(3-B):831-5.
- Camargos FFO, Dias RC, Dias
JMD, Freire MTF. Adaptação transcultural e avaliação das propriedades
psicométricas da Falls Efficacy Scale
– International em idosos brasileiros (FES-I-BRASIL).
Rev Bras Fisioter 2010;14(3):227-43.
- Carol-Dartal FJ, Martinez-Martin P, Vargas AP. Independent validation of SCOPA-Psychosocial and metric properties of
the PDQ-39 Brazilian version. Mov Disord
2007;22:91-8.
- Ford MP, Malone LA, Nyikos I, Yeliselty R, Bickel CS. Gait training
with progressive external auditory cueing in person with Parkinson’s
disease. Arch Phys Med Rehabil
2010;9(8):1255-61.
- Hass CJ, Bishop M, Moscovich M, Stegemöller EL, Skinner J, Malaty
IA et al. J Neurol Phys Ther 2014;38(4):233-8.
- Adkin AL, Frank JS, Jog MS. Fear of falling and postural control in
Parkinson’s disease. Mov
Disord 2003;18(5):496-502.
- Wood BH, Biclough JA, Boenon
A, Walker RW. Incidence and prediction of fall in Parkinson’s disease: a
prospective multidisciplinary study. J Neurol Neurosurg Psych 2002;72(6):721-5.
- Seth K. Levodopa unresponsive symptoms in Parkinson disease. Mov Disord 2008,
23(Supl3):S521-S533.
- Mak MKY, Pang MYC. Parkinsonian single fallers versus recurrent fallers:
different fall characteristics and clinical features. J Neurol
2010;259(9):1543-51.
- Bryant MS, Rintala DH, Hou
JG, Protas EJ. Influence of fear of falling on gait and balance in Parkinson's
disease. Disabil Rehabil
2014;36(9):744-8.
- Shumway-Cook A, Baldwin M, Polissar NL, Gruber
W. Predicting the probability for falls in community-dwelling older adults. Phys Ther 1997;77(8):812-9.
- Chiu AY, Au-Yeung SS, Lo SK. A comparison of four functional tests in
discriminating fallers from non-fallers in older people. Disabil Rehabil 2003;25(1):45-50.
- Berg KO, Wood-Dauphinee SL, Williams JI, Maki
BE. Measuring balance in the elderly: validation of an instrument. Can J Public
Health. 1992;83(Supl
2)S7-11.
- Williams LS, Weinberger M, Harris L, Clark DO, Biller J. Development of
a stroke-specific quality of life scale. Stroke 1999;30:1362-9.
- Curtze C, Nutt JG, Carlson-Kuhta P, Mancini M, Horak FB. Objective
gait and balance impairments relate to balance confidence and perceived
mobility in people with Parkinson Disease. Phys Ther 2016;96(11):1734-43.
- Jones JD, Hass C, Mangal P, Lafo J, Okun MS, Bowers D. The cognition and emotional well- being indices of the Parkinson’s
disease questionnaire-39: what do they really measure? Parkinsonism Relat
Disord 2014;20(11):1236-41.