ARTIGO
ORIGINAL
Avaliações
funcionais e morfométrica de modelo de lesão muscular
por agulha de biópsia em gastrocnêmio de ratos
Functional and morphometric evaluations of model of muscle lesion with
biopsy needle in gastrocnemius of rats
Maria Cecília Ribeiro
Bruning, Ft. M.Sc.*, Alana Ludemila de Freitas Tavares**, Aline Daiane de Lima**,
Juliana Roncini Gomes da Costa**, Lucinéia de Fátima Chasko Ribeiro, D.Sc.**,
Rose Meire Costa Brancalhão**, Adriana Pertille, Ft. D.Sc*, Gladson Ricardo
Flor Bertolini, Ft., D.Sc.**
*Programa
de Pós-Graduação em Ciências do Movimento Humano da Universidade Metodista de
Piracicaba (UNIMEP), Piracicaba/SP, **Universidade Estadual do Oeste do Paraná
(UNIOESTE), Cascavel/PR
Recebido em 26 de
abril de 2018; aceito em 6 de novembro de 2018.
Endereço
de correspondência:
Maria Cecília Ribeiro Bruning, Rua Fagundes Varela, 2548, 85807-480 Cascavel
PR, E-mail: marycribeiro6@hotmail.com; Alana Ludemila de Freitas Tavares:
alanatavares-@hotmail.com; Juliana Roncini Gomes da Costa: ronciniju@gmail.com;
Lucinéia de Fátima Chasko Ribeiro: lucineia.cr@gmail.com; Rose Meire Costa
Brancalhão: rosecb@gmail.com; Adriana Pertille: pertille.adri@gmail.com;
Gladson Ricardo Flor Bertolini: gladsonricardo@gmail.com
Resumo
Introdução: Dentre os modelos
experimentais, o uso de agulha de biópsia mostrou ser eficaz para reproduzir as
lesões em atletas. Objetivo: Avaliar
a força de preensão, a nocicepção e as alterações
morfológicas do músculo gastrocnêmio de animais
submetidos à lesão muscular. Métodos:
Foram utilizados seis ratos Wistar. A lesão foi
realizada na junção miotendínea do músculo gastrocnêmio direito, utilizando agulha de biópsia. Para
avaliação funcional utilizou-se o teste de força de preensão e avaliação nociceptiva em três momentos: 24 horas antes da lesão
(AV1); no segundo dia pós-lesão (AV2) e no sexto dia pós-lesão (AV3). Ao final
do experimento o músculo foi retirado para análise morfológica. Resultados: Houve redução da força de
preensão entre AV1 e AV2 (p=0,0031). Para a nocicepção
os valores de AV2 (p<0,001) e AV3 (p=0,0109) foram maiores que AV1. Na
região das fibras musculares observou-se desarranjo do padrão fascicular,
aumento do calibre de vasos sanguíneos, da quantidade de tecido conjuntivo, de
fibroblastos e de células inflamatórias. Conclusão:
A lesão muscular por agulha de biópsia provocou redução da força de preensão e
da nocicepção do membro lesado, como também
evidenciou as etapas características do processo de degeneração muscular e
início do processo de regeneração.
Palavras-chave: força, nociceptividade, músculo esquelético, biópsia por agulha.
Abstract
Introduction: Among the experimental models, the use of a biopsy needle was shown to
be effective to reproduce lesions that occur with athletes. Objective: To evaluate the grip
strength, nociception and morphological alterations of the gastrocnemius muscle
of animals submitted to muscle injury. Methods:
Six Wistar rats were used. The lesion was performed
at the myotendinous junction of the right
gastrocnemius muscle using a biopsy needle. For functional evaluation, the grip
strength test and nociceptive evaluation were used at three moments: 24 hours
before the injury (AV1); on the second postoperative day (AV2) and on the sixth
postoperative day (AV3). At the end of the experiment the muscle was removed
for morphological analysis. Results:
There was a reduction in grip strength between AV1 and AV2 (p = 0.0031). For
the nociception the values of AV2 (p < 0.001) and AV3 (p = 0.0109) were
higher than AV1. In the muscle fibers region, there was disarrangement of the
fascicular pattern, increased blood vessel size, the amount of connective
tissue, fibroblasts and inflammatory cells. Conclusion:
Muscle lesion by biopsy needle caused reduction of grip strength and
nociception of the damaged limb, as well as the characteristic stages of the
muscular degeneration process and the beginning of the regeneration process.
Key-words: force,
nociception, skeletal muscle, biopsy needle.
Introdução
As lesões musculares
são comuns em atletas e indivíduos fisicamente ativos, causam transtornos e
gastos tanto pessoais como institucionais, e seu tratamento depende de um
diagnóstico eficiente e monitorização do estado da lesão [1]. A alta taxa de
recidivas representa um grande desafio para a medicina esportiva e um grande
impacto para atletas e clubes esportivos. Atualmente existem várias modalidades
terapêuticas para seu tratamento, porém as evidências de eficácia dessas
modalidades nas lesões musculares ainda não estão bem estabelecidas [2].
As lesões musculares
se caracterizam por alterações no aspecto morfológico e histoquímico, levando a
déficit de funcionalidade no segmento acometido. As principais formas de lesão
na prática esportiva são o estiramento e a contusão. O estiramento é mais
frequente sendo classificado em: grau I, no qual há ruptura estrutural mínima e
retorno rápido a função normal; grau II, ruptura parcial com dor e alguma perda
de função; e grau III, ruptura tecidual completa com retração muscular e
incapacidade funcional [3,4]. A contusão muscular ocorre por um trauma direto,
resultado de forças externas, caracterizada pela presença de dor, edema,
rigidez muscular e restrição na amplitude de movimento, atingindo quaisquer
músculos, sendo o quadríceps e o gastrocnêmio os mais
acometidos [3].
Um novo sistema de
classificação denominado consenso de Munique, distingue os seguintes tipos de
lesões musculares: desordem muscular funcional (tipo 1: relacionada com esforço
excessivo, e tipo 2: distúrbios de origem neuromuscular), sendo essas
caracterizadas por não apresentarem evidências macroscópicas de lesão na fibra
muscular; e desordem muscular estrutural (tipo 3: lesões musculares parciais
e o tipo 4: lesões totais ou subtotais que podem apresentar avulsão tendínea), oferecem evidência macroscópica de lesão, ou
seja, dano estrutural [5].
A busca do
entendimento de mecanismos e tratamento das doenças tem levado ao
desenvolvimento de vários modelos animais de lesões ou outras patologias. Para
que essas sejam investigadas a condição ou doença é induzida de forma
experimental [6]. O uso do modelo animal permite superar limitações de estudos
com humanos, como alguns aspectos éticos de experimentação em seres humanos e
obtenção de número suficiente de casos com características homogêneas [7].
Pesquisas com lesão
muscular têm sido realizadas com diversos protocolos, como trauma direto, lesão
cirúrgica e tração mecânica [8-14]. Contreras-Muñoz et al. [15] apresentaram um modelo, no
qual a lesão foi realizada com uso de agulha de biópsia transfixando os gastrocnêmios, que mimetizam lesões musculares observadas
em atletas humanos. Os resultados foram observados por análises histológicas e imunofluorescência, por imagens de ressonância nuclear
magnética, por avaliação da força tetânica e mostraram que esse tipo de lesão
muscular reproduziu as lesões grau I-II observadas em profissionais de futebol,
incluindo edema ao redor do tendão, alteração da morfologia das fibras musculares
e uma redução significativa de 30% na força tetânica máxima registrada após
duas semanas de lesão muscular.
Considerando a
importância do estudo do processo de regeneração muscular, como também a
disponibilidade de recursos dos laboratórios de pesquisa, a hipótese do
presente estudo é que o modelo de lesão por agulha de biópsia permite a
avaliação funcional e morfológica por meio de técnicas mais simples, como a
força de preensão e nocicepção. Assim, o objetivo do
estudo foi avaliar a força de preensão e a nocicepção,
além de descrever as alterações histológicas do músculo gastrocnêmio
de animais submetidos à lesão muscular por agulha de biópsia.
Material
e métodos
Foram utilizados 6
ratos machos da linhagem Wistar,
com 320 ± 20,8 g, obtidos do Biotério Central da
Universidade Estadual do Oeste do Paraná (Unioeste),
mantidos em ambiente com temperatura (23 ± 1ºC), fotoperíodo
(12 horas) e higiene controlados, recebendo água e ração ad libitum. Após a aclimatação de uma semana, os animais foram
submetidos ao protocolo de lesão. Todos os procedimentos experimentais foram
previamente aprovados pelo Comitê de Ética em Uso Animal da Unioeste.
Protocolo
de lesão
Inicialmente os
animais foram anestesiados com cloridrato de quetamina
(80 mg/kg) e cloridrato de xilazina (10 mg/kg). Após
verificação do estado de consciência (observado pela ausência de resposta
motora ao pinçamento da cauda e pregas interdigitais),
foi feita a tricotomia da região do músculo tríceps sural
direito e os animais colocados em posição prona para fixação do membro e
exposição do ventre muscular. O procedimento de lesão foi realizado com o
auxílio de agulha de biópsia (AdvantiVe® - 18G, 1,2
mm de diâmetro) que foi inserida na junção miotendínea
do músculo gastrocnêmio a 90º no membro pélvico
direito (3 mm do início do tendão muscular e 2 mm de profundidade), a agulha foi inserida uma vez em cada animal
seguindo o protocolo de Contreras-Muñoz et al. [15], após o procedimento os
animais foram realocados de dois em dois nas gaiolas.
Análises
funcionais
Previamente à
cirurgia, os animais foram adaptados e treinados no equipamento por três dias
durante uma semana. A primeira avaliação (AV1) foi realizada 24 horas antes da
lesão muscular, para obtenção de valores basais, a segunda avaliação no segundo
dia após a lesão (AV2) e a terceira avaliação (AV3) no sexto dia após a lesão.
Para a avaliação da
força muscular foi usado um medidor de força de preensão (Insight®) [16]. Na
avaliação, o animal era posicionado de modo que agarrasse em uma grade
conectada a um transdutor de força com o membro pélvico direito, sendo em
seguida tracionado pela cauda com força crescente até que a preensão fosse
perdida, momento no qual o aparelho fornecia a força exercida pelo animal. O
membro pélvico esquerdo foi imobilizado pela mão do avaliador para não
interferir na avaliação. O teste foi repetido três vezes e utilizado o valor
médio das repetições.
A avaliação da nocicepção foi realizada por meio do filamento de Von Frey
digital (Insight®) graduado em gramas (g) [17]. Para isto o animal foi contido
manualmente e a ponteira do equipamento aplicada na região do procedimento
lesivo no membro pélvico direito. A ponta de polipropileno foi aplicada
perpendicularmente à área, com gradual aumento de pressão, e logo que o animal
retirou a pata o teste foi interrompido para o registro do limiar de retirada.
Avaliação
histomorfométrica
No último dia de
experimento, com os animais anestesiados com cloridrato de quetamina
(80 mg/kg) e cloridrato de xilazina (10 mg/kg), os
mesmos foram eutanasiados por meio de decapitação em
guilhotina. Posteriormente, o músculo gastrocnêmio
lateral direito foi dissecado, seccionado em seu sentido transversal, fixado em
metacarn durante 2 horas e armazenados em álcool 70%
até o momento do procedimento histológico. Os músculos foram desidratados em
série crescente de álcoois, diafanizados, infiltrados e emblocados
em parafina histológica, para a obtenção de lâminas com cortes transversais de
espessura de 7 µm.
As lâminas foram
coradas em hematoxilina e eosina (HE), e avaliadas em microscópio de luz, com
objetiva de 40x. Posteriormente, as lâminas foram fotomicrografadas
em 10 campos por músculo e analisadas quanto a formato das fibras, presença de
fibroblastos e tecido conjuntivo.
Análise
estatística
Os dados foram
apresentados em média e desvio-padrão e a análise estatística foi realizada no
programa Biostat 5.0 utilizando-se Anova
unidirecional com pós-teste t. O nível de significância foi 5%.
Resultados
Para a força de
preensão houve redução significativa nos valores (F = 6,18; p = 0,011), sendo
encontradas as diferenças entre AV1 e AV2 (p = 0,0031). Para a nocicepção também foram observadas diferenças
significativas (F = 9,25, p = 0,0027), os valores de AV2 (p<0,001) e AV3 (p
= 0,0109) foram maiores do que AV1 (Tabela I).
Tabela
I - Análise da força e da nocicepção
nos três períodos de avaliação.

AV1 = pré-lesão; AV2 = segundo dia pós-lesão; AV3 = sexto dia
pós-lesão; g = gramas; ms = milissegundos; Letras diferentes apresentam diferenças estatísticas
significativas.
Na análise
morfológica do músculo gastrocnêmio dos animais em
região controle (fora da lesão), foram visualizadas fibras musculares com
aspecto normal, ou seja, formato poligonal, núcleos dispostos perifericamente,
com padrão fascicular de organização, delimitado pelo perimísio e cada fibra
circundada pelo endomísio. O conjuntivo de aspecto
frouxo, com fibras colágenas eosinófilas,
fibroblastos e presença de vasos sanguíneos. Na região das fibras musculares,
adjacentes à lesão induzida por agulha, observou-se a redução do tamanho da
área de secção transversa, fibras em formato polimórfico, presença de núcleos
centrais, bem como alinhados na periferia da fibra, desarranjo do padrão
fascicular, aumento do calibre de vasos sanguíneos, aumento da quantidade de
tecido conjuntivo entre as fibras e fascículo, bem como de fibroblastos e
células inflamatórias (Figura 1).
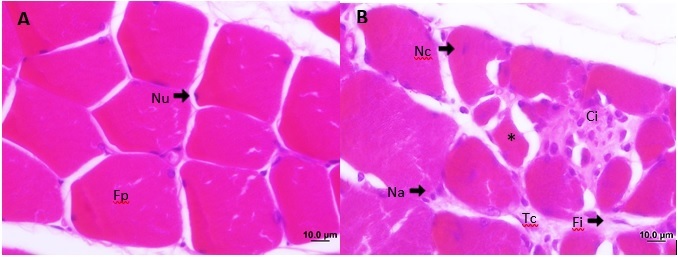
Em A, região controle
(sem lesão): fibras poligonais (Fp) com seus
respectivos núcleos periféricos (Nu), organizados em fascículos. Em B, região
lesão, fibras musculares polimórficas (*), alguns núcleos centrais (Nc), outros aglomerados (Na) na periferia da fibra, fibroblastos
(Fi), células inflamatórias (Ci),
proliferação e desorganização do tecido conjuntivo (Tc).
Barra 10 µm.
Figura
1 - Fotomicrografias do músculo gastrocnêmio
de ratos Wistar, corte transversal, coloração
hematoxilina e eosina.
Discussão
As lesões musculares
são extremamente comuns, principalmente na prática esportiva, contudo, ainda é
relativamente pouco explorada, com relação aos seus mecanismos e formas de
tratamento [18]. Assim, o presente estudo buscou avaliar um modelo de lesão
muscular proposto, tendo como base tanto avaliações funcionais quanto
morfológicas teciduais, mais simples e factíveis a maior parte de laboratórios
de pesquisa, do que imunofluorescência, imagens de
Ressonância Nuclear Magnética e força tetânica utilizada por Contreras-Muñoz et al. [15].
No presente estudo, o
modelo de lesão por agulha de biópsia proposto por Contreras-Muñoz
et al. [15] se mostrou eficaz na
indução da lesão muscular, com evidente diminuição da força no segundo dia
pós-lesão. Paulsen et al. [19] relatam que alterações
nas capacidades funcionais estão associadas às mudanças histológicas e
histoquímicas do tecido muscular estriado esquelético, caracterizadas por
presença de células inflamatórias, degeneração das miofibrilas,
rompimento dos miofilamentos e desorganização da
arquitetura dos sarcômeros, prejudicando a
funcionalidade muscular.
Contreras-Muñoz et al.
[15] observaram redução na capacidade contrátil
muscular,
porém para isso realizaram isolamento do músculo e
eletroestimulação. No
presente estudo buscou-se analisar a força muscular com o animal
vivo,
realizando uma tarefa funcional, que é a preensão. Assim,
provavelmente o
prejuízo funcional causado pela redução da
força muscular observada nos animais
após a lesão é consequência direta das
alterações morfológicas e bioquímicas
promovidas pelo processo inflamatório em curso, e mesmo que para
a preensão o músculo
gastrocnêmio não seja efetor primário, pela
característica de sinergismo muscular [20,21] afetou tal função.
As lesões musculares,
além de promoverem o quadro álgico, geram edema e aumento da síntese de
proteínas, caracterizando o início do processo inflamatório [22]. Na análise
morfológica foi possível observar a presença de vasos, células inflamatórias,
fibroblastos além de aumento no tecido conjuntivo, característico do processo
de inflamação/reparo tecidual [18,23]. O que também responde ao período de
redução do limiar nociceptivo, observado tanto no
segundo quanto no sexto dia de avaliação.
Com o modelo de lesão
utilizado foi possível avaliar o estado da lesão, por meio de avaliações
funcionais simples, como força de preensão e nocicepção,
bem como achados morfológicos com coloração por HE.
Conclusão
A lesão muscular por
agulha de biópsia provocou redução da força de preensão e da nocicepção do membro lesado dos animais. Além disso, a
análise morfológica do músculo gastrocnêmio
evidenciou as etapas características do processo de degeneração muscular e
início do processo de regeneração.
Referências
- Bandeira F, Neves EB,
Barroso GC, Nohama P. Métodos de apoio ao diagnóstico
de lesões musculares. Revista Brasileira de
Inovação Tecnológica em Saúde 2013;3(3):27-44.
https://doi.org/10.18816/r-bits.v3i3.4509
- Ramos GA, Arliani GG, Astur DC, Pochini A de C, Ejnisman B, Cohen
M. Reabilitação nas lesões musculares dos isquiotibiais:
revisão da literatura. Rev Bras Ortop 2017;52(1):11-6. https://doi.org/10.1016/j.rbo.2016.02.006
- Ueblacker P, Müller-Wohlfahrt HW, Ekstrand J.
Epidemiological and clinical outcome comparison of indirect (’strain’) versus
direct (’contusion’) anterior and posterior thigh muscle injuries in male elite
football players: UEFA Elite League study of 2287 thigh injuries (2001-2013).
Br J Sports Med 2015;49(22):1461-5.
https://doi.org/10.1136/bjsports-2014-094285
- Ekstrand J, Hägglund M, Waldén M.
Epidemiology of muscle injuries in professional football (soccer). Am J Sports
Med 2011;39(6):1226-32. https://doi.org/10.1177/0363546510395879
- Mueller-Wohlfahrt H-W, Haensel
L, Mithoefer K, Ekstrand J,
English B, McNally S et al. Terminology and classification of muscle injuries
in sport: the Munich consensus statement. Br J Sports Med 2013;47(6):342–50.
https://doi.org/10.1136/bjsports-2012-091448
- Monteiro R, Brandau R, Gomes WJ, Braile DM. Tendências em
experimentação animal. Rev Bras
Cir Cardiovasc
2009;24(4):506-13. https://doi.org/10.1590/s0102-76382009000500012
- Fagundes DJ, Taha MO. Animal disease model: choice’s criteria and
current animals specimens. Acta Cir Bras
2004;19(1):59-65. https://doi.org/10.1590/s0102-86502004000100010
- Abreu VGC, Correa GM,
Silva TM, Fontoura HS, Cara DC, Piló-Veloso D et al. Anti-inflammatory effects in muscle injury by transdermal application of
gel with Lychnophora pinaster
aerial parts using phonophoresis in rats. BMC
Complement Altern Med 2013;13(270).
https://doi.org/10.1186/1472-6882-13-270
- Borrione P, Grasso L, Chierto E, Geuna S, Racca S, Abbadessa G et al.
Experimental model for the study of the effects of platelet-rich plasma on the
early phases of muscle healing. Blood Transfus
2014;12(Supl1):s221-8.
- Criswell TL, Corona BT, Ward CL, Miller M, Patel M, Wang Z et al.
Compression-induced muscle injury in rats that mimics compartment syndrome in
humans. Am J Pathol 2012;180(2):787-97.
https://doi.org/10.1016/j.ajpath.2011.10.012
- Eardley WGP, Martin KR,
Taylor C, Kirkman E, Clasper JC, Watts SA. The
development of an experimental model of contaminated muscle injury in rabbits. Int J Low Extrem Wounds
2012;11(4):254-63. http://journals.sagepub.com/doi/10.1177/1534734612465623
- Filippin LI, Cuevas MJ, Lima
E, Marroni NP, Gonzalez-Gallego
J, Xavier RM. The role of nitric oxide during healing of trauma to the skeletal
muscle. Inflamm Res 2011;60(4):347-56.
https://doi.org/10.1007/s00011-010-0277-2
- Karamanos DG, Karkos CD, Kambaroudis AG, Kritsepi M, Papadopoulos S, Spyridis
CT et al. The effect of antithrombin-III on routine
hematological and biochemical parameters in an experimental animal model of
skeletal muscle ischemia-reperfusion injury. Hippokratia 2014;18(3):234-9.
- Ramos L, Leal Junior
ECP, Pallotta RC, Frigo L,
Marcos RL, De Carvalho MHC et al. Infrared (810
nm) low-level laser therapy in experimental model of strain-induced skeletal
muscle injury in rats: Effects on functional outcomes. Photochem
Photobiol 2012;88(1):154-60.
https://doi.org/10.1111/j.1751-1097.2011.01030.x
- Contreras-Muñoz P, Fernández-Martín A, Torrella R, Serres X, De La Varga M, Viscor G et al. A new
surgical model of skeletal muscle injuries in rats reproduces human sports
lesions. Int J Sports Med 2016;37(3):183-90.
https://doi.org/10.1055/s-0035-1555933
- Bertelli JA, Mira JC. The grasping test: a simple behavioral method assessment of peripheral
nerve regeneration in the rat. J Neurosci Methods
1995;58(1-2):151-5. https://doi.org/10.1016/0165-0270(94)00169-h
- Vivancos GG, Verri Jr WA, Cunha TM, Schivo
IRS, Parada CA, Cunha FQ et al. An electronic
pressure-meter nociception paw test for rats. Brazilian J Med Biol Res 2004;37(3):391-9.
https://doi.org/10.1590/s0100-879x2004000300017
- Järvinen TAH, Järvinen M, Kalimo H.
Regeneration of injured skeletal muscle. Muscles Ligaments Tendons J
2013;3(4):337-45.
- Paulsen G, Mikkelsen UR, Raastad
T, Peake JM. Leucocytes, cytokines and satellite
cells: what role do they play in muscle damage and regeneration following
eccentric exercise? Exerc Immunol Rev 2012;18:42-97.
- Ribeiro SR, Tierra-Criollo CJ, Martins RÁBL. Efeitos de diferentes
esforços de luta de judô na atividade enzimática, atividade elétrica muscular e
parâmetros biomecânicos de atletas de elite. Rev Bras Med Esporte
2006;12:27-32. https://doi.org/10.1590/s1517-86922006000100006
- Resende APM, Nakamura
MU, Ferreira EAG, Petricelli CD, Alexandre SM et al.
Eletromiografia de superfície para avaliação dos músculos do assoalho pélvico
feminino: revisão de literatura. Fisioter Pesqui
2011;18(3):292-7. https://doi.org/10.1590/s1809-29502011000300016
- Liu C, Zhi Z, Tuchin
V V., Luo Q, Zhu D.
Enhancement of skin optical clearing efficacy using photo-irradiation. Lasers Surg Med 2010;42(2):132-40.
https://doi.org/10.1002/lsm.20900
- Järvinen TAH, Järvinen TLN, Kääriäinen M, Kalimo H, Järvinen M. Muscle
Injuries. Am J Sports Med
2005;33(5):745-64. https://doi.org/10.1177/0363546505274714