ARTIGO ORIGINAL
Percepção subjetiva de
esforço e recuperação da fadiga pós-sessão
fisioterapêutica em pacientes com paraparesia espástica tropical
Subjective effort perception and fatigue recovery after physical therapy session in patients with tropical spastic paraparesis
Yana Mendonça Fonseca*,
Leonardo Brynne Ramos de Souza*, Denise da Silva
Pinto, D.Sc.**
*Graduando em
Fisioterapia, Universidade Federal do Pará, **Docente do curso de Fisioterapia
da Universidade Federal do Pará e Fisioterapeuta
Recebido em 13 de abril
de 2020; aceito em 19 de novembro de 2020.
Correspondência: Yana
Mendonça Fonseca, Avenida D (Conjunto Costa e Silva), 188 B, Castanheira,
66645-675 Belém PA
Yana Mendonça Fonseca:
yanamfonseca@gmail.com
Leonardo Brynne Ramos de Souza: leonardobrynner@gmail.com
Denise da Silva Pinto:
denisepinto@ufpa.br
Resumo
Introdução: Vírus Linfotrópico de
Células T Humana do Tipo-1 (HTLV-1) é um retrovírus que afeta os linfócitos T
humano e desencadeia inflamação na medula, levando à paraparesia espástica
tropical/mielopatia associada ao HTLV-1 (PET/MAH) com
prejuízos funcionais. Tais disfunções podem influenciar nos efeitos da
fisioterapia, gerando diferentes níveis de fadiga. Objetivo: Avaliar a
percepção subjetiva de esforço e de recuperação de indivíduos com PET/MAH após
sessão única de fisioterapia. Métodos: Incluíram-se 12 participantes
sintomáticos para PET/MAH, de ambos os sexos, que foram submetidos uma vez ao
protocolo fisioterapêutico. Os instrumentos avaliativos foram: Escala
Modificada de Borg, Escala de Percepção Subjetiva de
Recuperação (1º, 5º e 10º minuto após a sessão) e Escala de Incapacidade
Neurológica do Instituto de Pesquisa Clínica Evandro Chagas – 2 (EIPEC). Resultados:
Encontrou-se correlação moderada entre idade e taxa de percepção subjetiva de
recuperação ao 1º (r = - 0,4923) e 5º (r = - 0,4913) minuto e entre índice do
EIPEC-2 e taxa de percepção subjetiva de recuperação ao 1º (r = 0,3592) e 5º (r
= - 0,3772) minuto. Conclusão: Indivíduos deste estudo com maior idade e
grau de incapacidade neurológica têm menor percepção subjetiva de recuperação.
Palavras-chave: infecções por HTLV-1,
paraparesia espástica tropical, fadiga, exercício.
Abstract
Introduction: Human T-Cell Lymphotropic Virus Type-1 (HTLV-1) is a retrovirus that
affects human T lymphocytes and triggers inflammation in the spinal cord,
leading to tropical spastic paraparesis / HTLV-1 associated myelopathy
(TSP/HAM) with functional impairments. Such dysfunctions can influence the
effects of physical therapy, generating different levels of fatigue. Objective:
To evaluate the subjective perception of effort and recovery of individuals
with TSP/HAM after a single session of physical therapy. Methods: 12
symptomatic participants for TSP/HAM, of both sexes, who were submitted once to
a physiotherapeutic protocol were included. The evaluative instruments were:
Modified Borg Scale, Scale of Subjective Perception of Recovery (1st, 5th and
10th minute after the session) and Scale of Neurological Disability at the Evandro Chagas Clinical Research Institute - 2 (EIPEC). Results:
A moderate correlation was found between age and subjective perception rate of
recovery at the 1st (r = - 0.4923) and 5th (r = - 0.4913) minute and between
the EIPEC-2 index and the subjective perception rate of recovery at the 1st (r
= 0.3592) and 5th (r = - 0.3772) minute. Conclusion: Individuals in this
study with older age and degree of neurological disability have less subjective
perception of recovery.
Keywords: HTLV-I infections, tropical spastic paraparesis, fatigue, exercise.
Introdução
O vírus linfotrópico T
humano 1 (HTLV-1) é um retrovírus da família Retroviridae
que afeta os linfócitos T do sangue humano e pode causar distúrbios
neurológicos [1]. Acredita-se que existam atualmente 15 a 20 milhões de pessoas
infectadas em todo o mundo [2,3] e vários países da América do Sul são
frequentemente relatados com alta endemia, dentre eles, o Brasil [4,5], com a
maior prevalência nas regiões Norte e Nordeste [6].
A transmissão viral
ocorre principalmente via aleitamento materno, sexual, transfusão e demais
contatos diretos com sangue contaminado. Das pessoas infectadas, somente uma
parcela de 10% experimentam os múltiplos sintomas associados ao vírus, dentre
comprometimentos motores e imunológicos [4].
As células T CD4+
representam os principais reservatórios do vírus e são responsáveis pelo
aumento da produção de citocinas inflamatórias, como IFNg,
TNFα e IL1b [2,7]. Esta resposta
inflamatória ao HTLV-1, se perdurar, causará lesão no Sistema Nervoso Central e
resultará na situação neuropatológica mais claramente relacionada à infecção
viral crônica: a Paraparesia Espástica Tropical/Mielopatia
associada ao HTLV-1 (PET/MAH) [2,7,8,9,10]. Assim, a PET/ MAH é considerada uma
doença inflamatória crônica na qual o dano celular levou à desmielinização
da medula espinhal [2,8,9]. Toda a medula espinhal pode ser afetada, mas há
tropismo pelo nível torácico na porção inferior [7].
Tal condição tem sua
prevalência aumentada gradualmente com a idade, com início dos sintomas na
idade adulta com média de 40-50 anos e atinge principalmente as mulheres
[2,11,12].
A PET/MAH, condição
inflamatória e desmielinizante, causa degeneração das
vias ascendentes e descendentes que cursam no interior da medula espinhal, o
que leva à diminuição da sensibilidade, perda de força muscular e espasticidade
(aumento de tônus muscular), características da lesão dos neurônios motores
superiores [2].
Estas características
geram paulatinamente a incapacidade física, cuja velocidade de progressão
depende de fatores variados, como a carga proviral, a
realização de intervenção paliativa e o tempo de diagnóstico [2,13].
As queixas mais
relatadas em pacientes com PET/MAH, demonstradas em estudos, são: dificuldade
para andar, dor lombar e parestesia nos membros inferiores [2]. Além de
incontinência urinária, disfunção sexual, constipação, mialgias, depressão e
fadiga, com repercussões profundas na qualidade de vida [12-15].
O termo fadiga é usado
para descrever uma sensação avassaladora de cansaço, exaustão, fraqueza e falta
de força e/ou energia também devido ao exercício físico [16,17], com
fisiopatologia distinta, complexa, multifatorial e heterogênea. É uma queixa
frequente em pacientes com distúrbios neurológicos e crônicos [16-20], sendo
presente em até 57% dos pacientes com mielopatias,
principalmente em lesões incompletas [21], como a PET/MAH.
A fadiga crônica reduz
a capacidade de realizar atividades de vida diária e tem um impacto negativo na
qualidade de vida [16-18]. Sua avaliação é quase inteiramente baseada em
escalas subjetivas de autorrelato, as quais são aliadas de suma relevância no
programa de fisioterapia [16].
A abordagem
fisioterapêutica é uma das várias opções disponíveis para o tratamento da
PET/MAH [1]. Para evitar o sintoma de fadiga, o exercício terapêutico deve ser
adequado, de intensidade baixa a moderada, com um programa de exercícios
individualizados para tratar a queixa principal do paciente, melhorando, assim,
a aptidão, a capacidade funcional e a qualidade de vida [21,22].
Nesse contexto, o
objetivo deste trabalho é avaliar a percepção subjetiva de esforço e de
recuperação em indivíduos sintomáticos para PET/MAH após a aplicação de
protocolo fisioterapêutico em uma única sessão. Além de correlacionar estas
variáveis com a idade e o nível de comprometimento neurológico.
Material e métodos
Trata-se de um ensaio
clínico não-controlado, de caráter descritivo, no qual as variáveis utilizadas
foram avaliadas após sessão única de fisioterapia. A realização deste estudo
obedeceu aos princípios éticos para pesquisa envolvendo seres humanos, sobre o
parecer do Comitê de Ética e Pesquisa – 3.844.743-2020-CEP/ICS/UFPA.
Amostra
Intencional com a
seleção dos participantes do estudo feita por conveniência, respeitando a ordem
de chegada no serviço e o enquadramento nos critérios de inclusão propostos
pelos pesquisadores.
Foram inseridos
participantes portadores de HTLV-1, com confirmação clínica e molecular,
sintomáticos para PET/MAH, de ambos os sexos, que tivessem maioridade,
matriculados no Laboratório de Clínica e Epidemiologia de Doenças Endêmicas do
Núcleo de Medicina Tropical da Universidade Federal do Pará e que concordaram
fazer parte do estudo com assinatura do Termo de Consentimento Livre e
Esclarecido (TCLE).
Foram excluídos
pacientes com indícios de outras incapacidades neurológicas, infecção por outro
subtipo de HTLV e histórico de co-infecção.
Intervenção
Os participantes foram
submetidos a um mesmo protocolo fisioterapêutico padronizado de sessão única
com duração de 50 minutos, tendo lócus no Laboratório de Estudos em
Reabilitação Funcional (LAERF) do Instituto de Ciências da Saúde da UFPA. Foi
composto por: aquecimento na bicicleta ergométrica por 10 minutos, treino de
equilíbrio estático e dinâmico na cama elástica, treino de marcha com
obstáculos (cones), exercícios ativos-resistidos para MMSS e MMII e
alongamentos globais. Ao final da sessão foram avaliadas a percepção subjetiva
de esforço e a percepção subjetiva de recuperação no 1o, 5o e 10o minuto após o
término.
Instrumentos de
avaliação
Para avaliar a
percepção subjetiva de esforço, foi utilizada a Escala modificada de Borg, escala numérica de 0 a 10, considerando-se que quanto
maior o escore maior a intensidade do exercício percebida [23]. Além disso, com
o intuito de avaliar a taxa de recuperação após o exercício por meio da
variação dos escores, foi utilizada a Escala de Percepção Subjetiva de
Recuperação que varia de 0 a 10, sendo considerado maior escore melhor
recuperação [24]. Após a aplicação dessas escalas, foi comparado o resultado
com a Escala de Incapacidade Neurológica do Instituto Evandro Chagas 2
(EIPEC-2) [25]. Trata-se de um instrumento desenvolvido unicamente para
avaliação de pacientes com PET/MAH conforme seu nível de incapacidade nas
variáveis motoras, sensitivas e esfincterianas. Neste estudo a aplicação da
EIPEC-2 teve intenção de observar possíveis relações entre o nível de
comprometimento neurológico e a taxa registrada de fadiga e recuperação.
Análise dos dados
Os dados foram
armazenados em um banco de dados utilizando o programa Microsoft Excel (versão
2016). A análise dos dados foi realizada por meio do software BioEstat 5.0 com a normalidade das variáveis contínuas
verificada pelo teste de D’Agostino, bem como as associações estatísticas pelos
testes de correlação linear de Pearson para dados paramétricos e o teste de
correlação de Spearman para dados não paramétricos. A
produção de gráficos se deu pelo software GraphPad Prism
5.03. Para este estudo foi considerado nível alfa de 5%.
Resultados
Foram incluídos na
pesquisa 12 pacientes com confirmação clínica e molecular para HTLV-1,
sintomáticos para PET/MAH, com médias de idade de 58,4 ± 7,93 anos.
Aproximadamente 83% dos pacientes pertencem ao sexo feminino, enquanto 57% dos
pacientes incluídos são considerados idosos, acima de 60 anos.
Os dados mostram que,
após sessão única de fisioterapia, a maioria dos indivíduos consideraram uma
Percepção Subjetiva de Esforço - Escala modificada de Borg,
moderada-intensa (escore de 3 a 5) e que nos momentos iniciais de recuperação
houve baixa recuperação (escore de 3). Além disso, é notável que no 10º minuto
após sessão houve uma concentração de respostas em escores mais altos (4, 5 e
10), demonstrando melhora da recuperação ao passar os minutos iniciais. Dados
representados nos gráficos a seguir.
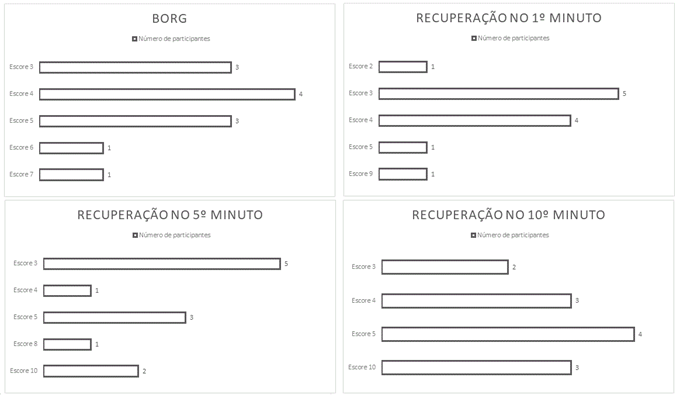
Figura 1 - Gráficos de
representação numérica de participantes que responderam determinado escore das
escalas de Borg e de Percepção Subjetiva de
Recuperação no 1º, 5º e 10º minuto.
As figuras 2, 3 e 4
apresentam a associação das variáveis, idade, EIPEC-2 e tempo de diagnóstico
com o índice de Borg e as taxas de recuperação
subjetivas no 1º, 5º e 10º minuto, após intervenção.
Idade
Foi encontrada índice
de correlação moderada e negativa entre a idade dos sujeitos do estudo e a taxa
de recuperação subjetiva ao 1º (r de Spearman de -
0,4913), 5º (r de Pearson de - 0,4923) e 10º minuto (r de Pearson de - 0,4153).
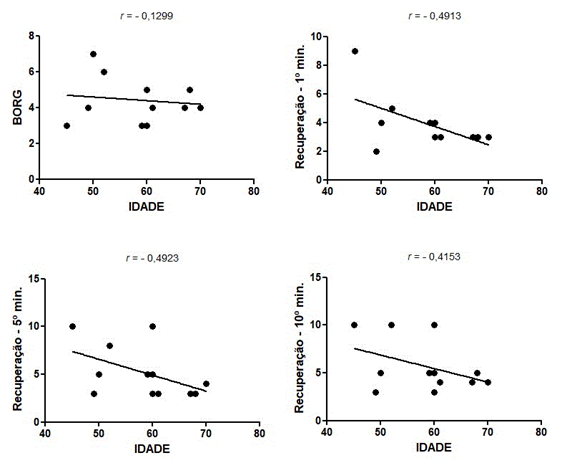
Figura 2 - Gráficos de
correlação entre idade e Índice de Borg e a Percepção
Subjetiva de Recuperação no 1º, 5º e 10º minuto.
EIPEC-2
Foi encontrada
correlação moderada e negativa entre os índices do EIPEC-2 e a taxa de
recuperação subjetiva ao 1º (r de Spearman de -
0,3592) e ao 5º minuto (r de Pearson de 0,3772).
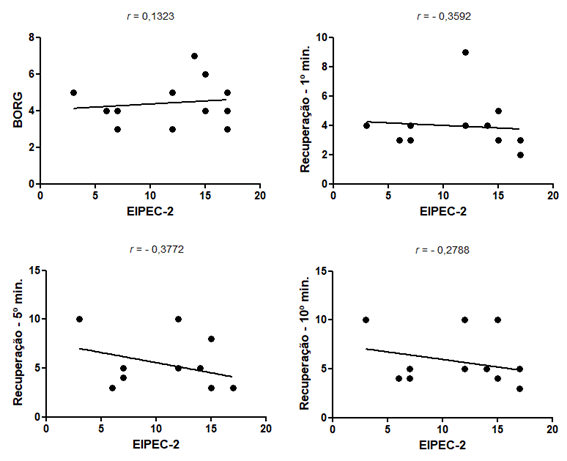
Figura 3 - Gráficos de
correlação entre EIPEC-2 e Índice de Borg e a
Percepção Subjetiva de Recuperação no 1º, 5º e 10º minuto.
Tempo de diagnóstico
Foi encontrado índice
de correlação fraco e positivo entre o tempo de diagnóstico dos sujeitos do
estudo e a taxa de recuperação subjetiva ao 1º minuto (r de Spearman
de 0,2786).
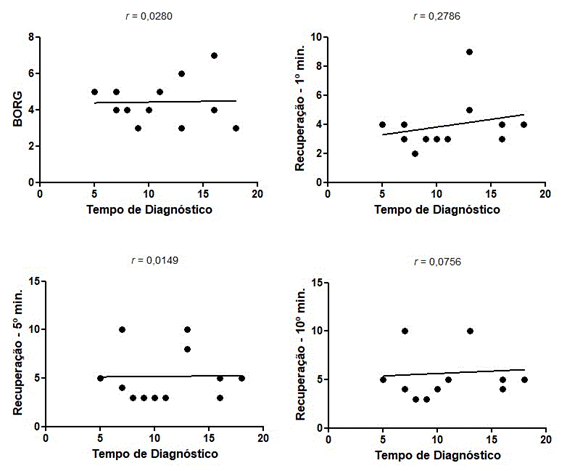
Figura 4 - Gráficos de
correlação entre tempo de diagnóstico e Índice de Borg
e a Percepção Subjetiva de Recuperação no 1º, 5º e 10º minuto.
No que diz respeito à
associação dos resultados do EIPEC-2 com o tempo de diagnóstico, é possível
perceber, com correlação fraca, que quanto maior o tempo de diagnóstico, maior
o EIPEC-2.
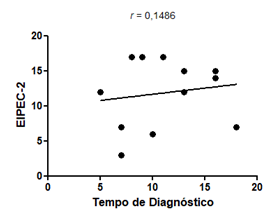
Figura 5 - Gráfico de
correlação entre EIPEC-2 e o tempo de diagnóstico dos participantes do estudo.
Todas as correlações
realizadas não foram estatisticamente significantes (p > 0,05).
Discussão
Foi possível encontrar
moderada, mas importante relação da idade mais avançada e do nível de gravidade
da incapacidade neurológica causada pelo HTLV-1 com o nível de fadiga e os
momentos iniciais da recuperação subjetiva do esforço.
Estudos da década de
90, como o de Sairenji [26], já traçaram correlações
entre a Síndrome da Fadiga Crônica (SFC) com infecções virais, relatando que
anticorpos para o Vírus Epstein-Barr (EBV), alguns
enterovírus, o Herpesvirus Humano (HHV-6) e,
finalmente, o HTLV eram encontrados nos pacientes que desenvolviam a SFC.
Outros distúrbios neurológicos também evoluem com fadiga, tanto na sua forma
persistente quanto na induzida pelo exercício, como no Acidente Vascular
Encefálico (AVE) [27] e na Esclerose Lateral Amiotrófica [28]. No estudo de Vries et al. [29], os índices de fadiga foram considerados
como parte das disfunções neurológicas da Síndrome de Guillain-Barré.
É necessário, além
disso, analisar as várias associações de inúmeras situações clínicas com o
HTLV-1, a exemplo de fibromialgia, importante quadro dentro da população de
infectados, outras doenças reumáticas (Osteoartrite, Artrite Reumatoide, Lúpus
Eritematoso Sistêmico, Síndrome de Sjogren) e doenças
respiratórias, as quais também estão relacionadas à fadiga [30].
Outro aspecto demonstrado
neste estudo é a baixa relação entre o tempo de diagnóstico e o comprometimento
neurológico dos participantes. Estudos apontam que o aparecimento de sinais
neurológicos está diretamente relacionado à carga viral, pois esse é o fator
que promove a intensificação da resposta inflamatória sobre a substância branca
do Sistema Nervoso Central (SNC) e que, assim, cria relações com formas da
PET/MAH mais leves ou precoces e/ou mais crônicas e severas [31]. Também é
sugerido que o desenvolvimento de complicações associadas ao HTLV pode estar
relacionado ao fenômeno da imunosenescência, o que
viabiliza a expansão oligoclonal e a ativação de
células infectadas pelo HTLV-1 em indivíduos mais velhos. Isso explica a
relação da idade e a gravidade da PET/MAH, mas não necessariamente ao tempo de
diagnóstico [32].
Em relação ao esforço
percebido, a escala de percepção subjetiva de esforço é um método de mensuração
e monitoração da intensidade do esforço que pode ser implementada em ambientes
que não tenham a possibilidade de monitorar ativamente a frequência cardíaca.
Em pacientes com Doença de Parkinson (DP), o exercício aeróbico é uma
intervenção terapêutica de potencial já estabelecido na literatura. O estudo de
Penko et al. [33], apoia o uso da Escala de Borg como uma ferramenta apropriada para ajudar a garantir
que aqueles com DP estejam se exercitando nas intensidades de exercício
adequadas. Esta escala deve ser aliada continuamente ao exercício físico para
avaliar o nível de esforço do paciente.
Além disso, enfatiza-se
a percepção subjetiva de recuperação ao exercício como uma variável que revela
a taxa de recuperação após uma atividade física, a qual associada com o esforço
percebido, aprimora o conhecimento do nível de tolerância ao exercício dos
pacientes. Dessa forma, o conhecimento do nível de tolerância ao exercício dos
pacientes permite a personalização de um programa de tratamento individualizado
[34], de modo a evitar a queixa de fadiga, a qual pode levar a efeitos não
desejados do exercício.
A fadiga crônica pode
levar à inatividade física, pelo fato de que os pacientes que a experimentam
apresentam deficiências associadas (como fraqueza muscular e dor), atingindo a
saúde cardiovascular e o funcionamento muscular. O acompanhamento individualizado,
nesse sentido, evidencia sobre a regularidade e não o nível da performance no
exercício físico, além dos padrões acerca dele que podem ser especificamente
adotados [35]. Também é apontado que exercícios de alta-intensidade induzem a
maiores níveis de estresse e que a resposta fisiológica a essa modalidade de
exercício pode desregular a capacidade do organismo de responder eventos
estressores, além de fortalecer a resposta inflamatória (com aumento de IL-6,
na sua forma pró-inflamatória, e TNF-α circulantes), influenciando o
comportamento mais intenso de doenças e um certo padrão depressivo [36]. Nesse
caso, exercícios que geram maiores esforços poderiam paralelamente acentuar a
severidade da PET/MAH nos pacientes do estudo.
Dentro desses aspectos,
o estudo ressalta a importância da elaboração personalizada de objetivos e
condutas terapêuticas, uma vez que foi possível observar que, ao se tratar de
um protocolo padronizado aplicado a um grupo com PET/MAH de idades e
comprometimentos variados, os pacientes que tendem a apresentar maior percepção
subjetiva de esforço e menor percepção subjetiva de recuperação são justamente
os que possuem maior idade e maior comprometimento neurológico.
O estudo encontrou como
principal fator limitante a amostra reduzida, em decorrência da baixa adesão
dos pacientes à pesquisa. Entretanto, é possível que haja a expansão dos
resultados e o uso desses para atuação profissional.
Conclusão
Por meio deste estudo,
a análise dos dados permite concluir que os indivíduos com maior grau de
prejuízo na capacidade neurológica e idade mais avançada têm uma maior
Percepção Subjetiva de Esforço (PSE) e uma menor Percepção Subjetiva de
Recuperação (PSR) após um protocolo fisioterapêutico de sessão única.
Ademais, destaca-se a
importância de um programa fisioterapêutico individualizado para pacientes com
doenças neurológicas e crônicas devido a que neste estudo os participantes com
idades e níveis de comprometimento neurológico diferentes submetidos ao mesmo protocolo
apresentou variadas percepções subjetivas de esforço e recuperação após o
exercício, o qual pode ser prejudicial aos efeitos do exercício físico, levando
a sensação de fadiga.
Referências
- Sá KN, Macêdo MC,
Andrade RP, Mendes SD, Martins JV, Baptista AF. Physiotherapy
for human T-lymphotropic virus 1-associated myelopathy: review of the
literature and future perspectives. J Multidiscip Healthc 2015;8:117-25.
https://doi.org/10.2147/jmdh.s71978
- Takatani M, Crispim
ME, Fraiji N, Stefani MMA, Kiesslich
D. Clinical and laboratory features of HTLV-I asymptomatic carriers and
patients with HTLV-I-associated myelopathy/tropical spastic paraparesis from
the Brazilian Amazon. Rev Inst Med Trop 2017;59(5).
https://doi.org/10.1590/s1678-9946201759005
- Thé G, Kazanji
M. Na HTLV-I / II Vaccine: from animal models to clinical trials? J Acquir Immune Defic Syndr Hum Retrovirol 1996;13(1):S191-8. https://doi.org/10.1097/00042560-199600001-00029
- Watanabe
T. Current status of HTLV-1 infection. Int J Hematol 2011;94:430-4. https://doi.org/10.1007/s12185-011-0934-4
- Gessain A, Cassar
O. Epidemiological aspects and world distribution of HTLV-1 Infection. Front
Microbiol 2012;3:388.
https://doi.org/10.3389/fmicb.2012.00388
- Catalan-Soares
B, Carneiro-Proietti ABF, Proietti
FA, Group IHR. Heterogeneous geographic distribution of human T-cell
lymphotropic viruses I and II (HTLV-I/II): serological screening prevalence
rates in blood donors from large urban areas in Brazil. Cad Saúde Pública
2005;21(3):926-31. https://doi.org/10.1590/s0102-311x200500030002
- De Castro-Costa CM,
Araújo AQC, Barreto MM, Takayanaqui OM, Sohler MP, Silva ELM et al. Proposal
for diagnostic criteria of tropical spastic paraparesis/HTLV-I-associated myelopathy
(TSP/HAM). AIDS Res Hum Retroviruses 2006;22(10):931-5.
https://doi.org/10.1089/aid.2006.22.931
- Bangham CRM, Osame M. Cellular immune response to HTLV-1. Oncogene 2005;24:6035-46. https://doi.org/10.1038/sj.onc.1208970
- Gonçalves
DU, Proietti FA, Barbosa-Stancioli
EF, Martins ML, Ribas JG, Martins-Filho OA et al.
HTLV-1-associated myelopathy/tropical spastic paraparesis (HAM/TSP)
inflammatory network. Inflamm Allergy Drug Targets
2008;7(2):98-107. https://doi.org/10.2174/187152808785107642
- Izumo
S, Umehara F, Osame M.
HTLV-I-associated myelopathy. Neuropathology 2000;20:S65-8.
https://doi.org/10.1046/j.1440-1789.2000.00320.x
- Moxoto I, Boa-Sorte N, Nunes
C, Mota A, Dumas A, Dourado I et al. Perfil sociodemográfico, epidemiológico e
comportamental de mulheres infectadas pelo HTLV-1 em Salvador-Bahia, uma área
endêmica para o HTLV. Rev Soc
Bras Med Trop 2007;40(1):37-41.
https://doi.org/10.1590/s0037-86822007000100007
- Gonçalves DU, Proietti FA, Ribas JGR, Araújo MG, Pinheiro SR, Guedes AC
et al. Epidemiology, treatment, and prevention of human
T-Cell Leukemia Virus Type 1-associated diseases. Clin Microbiol Rev
2010;23(3):577-89. https://doi.org/10.1128/cmr.00063-09
- Reiss DB, Freitas GS, Bastos
RHC, Souza MA, Horiguchi CLF, Martins ML et al. Neurological
outcomes analysis of HTLV-1 seropositive patients of the Interdisciplinary
Research HTLV Group (GIPH) cohort, Brazil. Retrovirology 2014;11(1).
https://doi.org/10.1186/1742-4690-11-s1-p51
- Yamano Y, Sato T. Clinical
pathophysiology of human T-lymphotropic virus-type 1-associated
myelopathy/tropical spastic paraparesis. Front Microbiol
2012;3. https://doi.org/10.3389/fmicb.2012.00389
- Gotuzzo E, Cabrera J, Deza L, Verdonck K, Vandamme AM, Cairampoma R et al. Clinical characteristics of patients in Peru with human T Cell
Lymphotropic Virus Type 1-associated tropical spastic paraparesis. Clin Infect
Dis 2004;39(7):939-44. https://doi.org/10.1086/423957
- Kumor K, Pierzchala
K. The problem of fatigue in neurological disorders. Wiad
Lek 2006;59(9-10):685-91.
- Twomey
R, Saied JÁ, Kruger R, Culus-Reed SN, Temesi J, Millet JY. Neuromuscular fatigue during exercise:
Methodological considerations, etiology and potential role in chronic fatigue. Neurophysiol Clin 2017;47(2):95-110.
https://doi.org/10.1016/j.neucli.2017.03.002
- Penner
IK, Paul F. Fatigue as a symptom or comorbidity of neurological diseases. Nat
Rev Neurol 2017;13(11):662-75. https://doi.org/10.1038/nrneurol.2017.117
- Chaudhuri
A, Behan PO. Fatigue in neurological disorders. Lancet 2004;363(9413):978-88.
https://doi.org/10.1016/s0140-6736(04)15794-2
- Swain
MG. Fatigue in chronic disease. Clin Sci 2000;99(1):1-8.
https://doi.org/10.1042/CS19990372
- Menon
N, Gupta A, Khanna M, Taly AB, Thennarasu
K. Prevalence of depression, fatigue, and sleep disturbances in patients with
myelopathy: Their relation with functional and
neurological recovery. J Spinal Cord Med 2016;39(6):620-6.
https://doi.org/10.1179/2045772314y.0000000284
- Halabchi F, Alizadeh Z, Sahraian MA, Abolhasani M.
Exercise prescription for patients with multiple sclerosis; potential benefits
and practical recommendations. BMC Neurol 2017;17(1):185.
https://doi.org/10.1186/s12883-017-0960-9
- Borg
GA. Psychophysical bases of perceived exertion. Med Sci Sports Exerc 1982;14(5):377-81.
https://doi.org/10.1249/00005768-198205000-00012
- Laurent
CM, Green JM, Bishop PA, Sjokvist J, Schumacker RE, Richardson MT et al. A practical approach to
monitoring recovery: development of a perceived recovery status scale. J
Strength Cond Res 2011;25(3):620-8.
https://doi.org/10.1519/JSC.0b013e3181c69ec6
- Schmidt
FR. Avaliação
do desempenho da escala de incapacidade neurológica do Instituto de Pesquisa
Clínica Evandro Chagas (EIPEC-2) para pacientes com mielopatia
associada ao HTLV-1 [Dissertação]. Rio de Janeiro: Fiocruz; 2014.
- Sairenji T, Yamanishi
K, Tachibana Y, Bertoni G, Kurata
T. Antibody responses to
Epstein-Barr virus, human herpesvirus 6 and human herpesvirus
7 in patients with chronic fatigue syndrome. Intervirology 1995;38(5):269-73.
https://doi.org/10.1159/000150450
- Kuppuswamy A. The fatigue conundrum. Brain
2017;140(8):2240-45. https://www.doi.org/10.1093/brain/awx153
- Pardini M1, Bonzano L, Roccatagliata L, Mancardi GL, Bove M. The
fatigue-motor performance paradox in multiple sclerosis. Sci Rep 2013;3:2001.
https://doi.org/10.1038/srep02001
- De
Vries JM, Hagemans ML, Bussmann JB, van der Ploeg AT,
van Doorn PA. Fatigue in neuromuscular disorders:
focus on Guillain-Barré syndrome and Pompe disease.
Cell Mol Life Sci 2010;67(5):701-13. https://doi.org/10.1007/s00018-009-0184-2
- Umekita K, Okayama A. HTLV-1
Infection and rheumatic diseases. Front Microbiol 2020;11.
https://doi.org/10.3389/fmicb.2020.00152
- Haziot
ME, Gascon MR, Assone T, Fonseca LAM, Luiz OC, Smid J et al. Detection of clinical and neurological signs in apparently asymptomatic
HTLV-1 infected carriers: Association with high proviral
load. PLoS Negl Trop Dis 2019;13(5):e0006967.
https://www.doi.org/10.1371/journal.pntd.0006967
- Asquith
B, Zhang Y, Mosley AJ, Lara CM, Wallace DL, Worth A et al. In vivo T lymphocyte dynamics in humans and the impact of human
T-lymphotropic virus 1 infection. PNAS 2007;104(19):8035-40. https://doi.org/10.1073/pnas.0608832104
- Penko AL, Barkley JE, Koop MM, Alberts
JL. Borg scale is valid for ratings of perceived exertion for individuals with
Parkinson’s disease. Int J Exerc Sci 2017;10(1):76-86.
https://doi.org/10.1249/01.mss.0000402937.98368.9a
- Ponina
IV, Novoselova IN, Valiullina SA, Machalov VA, Lukyanov VI. Personalized approach column and spinal cord injury, taking
into account exercise tolerance. Vopr Kurortol Fizioter Lech Fiz Kult. 2019;96(4):25-35.
https://www.doi.org/10.17116/kurort20199604125
- Chaudhuri
A, Behan PO. Fatigue in neurological disorders. Lancet 2004;363(9413):978-88.
https://www.doi.org/10.1016/s0140-6736(04)15794-2
- Paolucci EM, Loukov D, Bowdish DME, Heisz, JJ. Exercise reduces depression and inflammation but
intensity matters. Bio Psycho 2018;133:79-84.
https://www.doi.org/10.1016/j.biopsycho.2018.01.015