Fisioter Bras 2021;2292):154-67
Uso
da eletromiografia de superfície na resultância do
treinamento muscular inspiratório com carga linear em portadores do vírus
linfotrópico humano tipo 1
Use of surface electromyography in
results of inspiratory muscle training with linear load in patients with type 1 human
lymphotropic virus
Amanda
Caroline Lobato Dias*, Kayonne Campos Bittencourt,
Ft., D.Sc.**, Isabelle Farias Gomes*, Denise da Silva
Pinto, Ft., D.Sc.**, Luiz Fábio Magno Falcão, Ft., D.Sc.**, João Sérgio de Sousa
Oliveira, Ft., D.Sc.**, Valéria Marques Ferreira
Normando, Ft., D.Sc.**
*Acadêmica
de Fisioterapia da Universidade do Estado do Pará (UEPA), Belém, PA, **Professor
Universidade do Estado do Pará (UEPA), Belém, PA
Recebido
em 6 de janeiro de 2021; aceito em 16 de abril de 2021.
Correspondencia: Amanda Caroline Lobato Dias, Tv. Perebebuí,
2623, Marco, 66087-662 Belém, PA, Brasil
Amanda Caroline Lobato Dias: amandacarolineld11@gmail.com
Kayonne Campos Bittencourt:
kayonnebitten@gmail.com
Isabelle Farias Gomes: isabelleffisio@gmail.com
Denise da Silva Pinto: denisepinto@ufpa.br
Luiz Fábio Magno Falcão: fabiofisiofalcao@yahoo.com.br
João Sérgio de Sousa Oliveira:joaosergio@uepa.br
Valéria Marques Ferreira Normando: valeriafisio@gmail.com
Resumo
Este
estudo visa avaliar por eletromiografia de superfície o comportamento dos
músculos inspiratórios no treinamento muscular em voluntários com vírus
linfotrópico de célula T humana do tipo 1. Trata-se de um ensaio clínico. Sete
voluntários, com idade 58,85 ± 7,2) anos, realizaram treinamento muscular
inspiratório domiciliar por 4 semanas, 3 vezes por semana, 30 minutos diários
por meio de incentivador de carga linear. Para avaliação utilizou-se os dados
de pressão inspiratória máxima e os dados da eletromiografia de superfície nas
fases pré (T0), segunda semana (T2) e após a quarta
semana (T4) de treinamento. Observou-se aumento progressivo da força muscular
inspiratória de T0 a T4 (p = 0,007), assim como, aumento do recrutamento das
unidades motoras pela análise da amplitude do sinal eletromiográfico,
sendo mais evidente para o músculo esternocleidomastóideo
(p = 0,12) em comparação ao músculo diafragma (p = 0,6). Verificou-se que no
decurso do treinamento muscular ocorreu melhora significativa da força muscular
inspiratória com maior recrutamento das fibras musculares dos músculos
analisados na amostra.
Palavras-chave: vírus linfotrópico de célula T humana
do tipo 1; músculos respiratórios; eletromiografia.
Abstract
This study aimed to evaluate by surface
electromyography the behavior of inspiratory muscles in the muscle training of
volunteers with human T-cell lymphotropic virus type 1. This was a clinical
trial. Seven volunteers, 58,85 ± 7.21 years old, underwent inspiratory muscle
training at home for 4 weeks, 3 times a week, 30 minutes daily by means of a
linear load stimulator. The maximum inspiratory pressure data and the surface
electromyography data were used for evaluation in the pre (T0), second week
(T2) and after the fourth week (T4) training phases. There was a progressive
increase in inspiratory muscle strength from T0 to T4 (p = 0.007), as well as
an increase in the recruitment of motor units by analyzing the amplitude of the
electromyographic signal, being more evident for the sternocleidomastoid muscle
(p = 0.12) in comparison to the diaphragm muscle (p = 0.6). During the muscle training inspiratory
muscle strength improves with greater recruitment of muscle fibers from the muscles
analyzed in the sample.
Keywords: Human T-cell lymphotropic virus
type 1; respiratory muscles; electromyography.
Introdução
O vírus linfotrópico de célula T humana, HTLV (Human T Lymphotrophic Viruse) tipo 1 (HTLV-1) é um retrovírus associado a
patologias como leucemia/linfoma de células T do adulto (LLcTA),
paraparesia espástica tropical/mielopatia associada ao HTLV-1 (PET/MAH),
distúrbios inflamatórios oftalmológicos, dermatológicos, reumatológicos e osteomioarticulares não malignos [1].
Caribe, América do Sul, Ilhas da Melanésia, Oeste Africano
e Japão são países prevalentes ao vírus. No Brasil, estima-se que existam cerca
de 2,5 milhões de pessoas infectadas, há prevalências mais elevadas nos estados
da Bahia, Pernambuco e Pará. As formas de transmissão são por via sexual, via
sanguínea por meio de transfusões, por transplante de órgãos ou pelo uso de
fômites, por via vertical de mãe para filho, pela passagem de linfócitos
infectados pelo leite materno e no período perinatal [2].
Na maioria dos casos o vírus persiste de forma
assintomática e indetectável pelo sistema imune, por anos ou até a morte.
Quando sintomático, o indivíduo é acometido por infecção crônica que pode estar
associada a doenças incapacitantes, que comprometem a qualidade de vida, como a
doença neurológica PET-MAH, o qual por estímulos de linfócitos, atravessam a
barreira hematoencefálica com formação de quimiocinas
e citocinas pró-inflamatórias neurotóxicas [3].
Desta forma, destaca-se a possibilidade do surgimento de
alterações morfológicas e funcionais também no sistema respiratório, no qual
decorre de um processo inflamatório ocasionado pelo vírus com infiltração linfocítica e liberação de citocinas lesivas ao tecido
pulmonar [4].
Atenta-se para alveolíte T linfocítica, pneumonia interesticial,
bronquiolite e panbronquiolite difusa, risco
aumentado para cryptococcose pulmonar, tuberculose
pulmonar e pneumonia adquirida na comunidade, patologias que podem ser
percebidas em portadores assintomáticos e em pacientes com PET/MAH [5,6].
Segundo Falcão [7], os dados obtidos apontam que o pulmão é
um sítio preferencial para o HTLV-1 e que este tropismo possa ser o causador
das lesões pulmonares. A sintomatologia pulmonar é subclínica, em tal caso são
descobertas ocasionalmente ou diante de sintomatologia grave, sendo esta menos comum e restrita a alguns casos, requisitando,
assim, internações hospitalares.
Na qualidade das possibilidades terapêuticas preventivas, o
treinamento muscular respiratório (TMR) surge e reflete diretamente na
funcionalidade do paciente, tendo como diretriz a condução de protocolos de
treinamento [8].
Como ferramenta para avaliar as atividades elétricas
musculares durante o TMR, a eletromiografia de superfície (EMGs)
se destaca como método não invasivo, refletindo a soma da atividade elétrica de
todas as fibras musculares esqueléticas ativas [9].
Essa técnica auxilia a
análise da relação entre a
sincronização, o tempo de ativação dos
músculos, a
relação do sinal de força e o uso do sinal eletromiográfico
como um índice de fadiga [10,11].
Dessa forma, este estudo teve como objetivo avaliar o
comportamento eletromiográfico de músculos
inspiratórios na proposta do treinamento muscular em voluntários com vírus
linfotrópico de célula T humana do tipo 1.
Métodos
Aspectos
éticos
Trata-se de um estudo tipo ensaio clínico, com abordagem
quantitativa, disponível em https://clinicaltrials.gov com ID NCT03829709 e com
aprovação do Comitê de Ética e Pesquisa com Seres Humanos - UEPA (parecer nº.
2.695.505), realizado no período de janeiro a agosto de 2019, na Unidade de
Ensino e Assistência em Fisioterapia e Terapia Ocupacional (UEAFTO) da
Universidade do Estado do Pará (UEPA), com voluntários infectados pelo HTLV-1
que assinaram o Termo de Consentimento Livre e Esclarecido (TCLE).
Amostra
A amostra foi estabelecida segundo os seguintes critérios
de inclusão: indivíduos infectados exclusivamente pelo HTLV-1, de ambos os
sexos, com faixa etária entre 50 e 70 anos, cadastrados no Laboratório de
Estudo em Reabilitação Funcional (LAERF) localizado no Núcleo de Medicina
Tropical da Universidade Federal do Pará. Foram excluídos indivíduos com outros
acometimentos pulmonares, comorbidades como: cardiopatia e hipertensão arterial
não controlada e alterações cognitivas. (Figura 1)
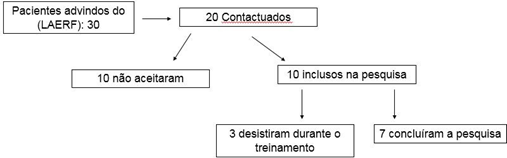
Figura
1 - Fluxograma do
encaminhamento inclusivo de portadores do vírus HTLV-1 no estudo. Belém, 2019
Protocolo
de avaliação
Os dados foram coletados em formulário-padrão, incluindo:
dados pessoais e clínicos, além da força muscular inspiratória e da eletromiografia
de superfície.
Força
muscular inspiratória
A leitura da pressão inspiratória máxima (PImáx) foi conduzida por meio do manovacuômetro, modelo Digital MVD 300 (GlobalMed™,
Porto Alegre/RS, Brasil), adotando valores teóricos previstos por Neder et
al. [12].
Para tal, os voluntários foram posicionados em sedestação na cadeira com encosto, com o bocal na posição
intraoral e vedação da cavidade nasal por meio de um clipe. A partir do comando
verbal, o voluntário gerou o esforço inspiratório até a capacidade pulmonar
total (CPT), a partir do volume residual (VR), para o registro da medida. As
técnicas de mensuração foram repetidas até completarem três medidas
satisfatórias da PImáx com variação de até
10% entre estas, com intervalo de repouso de 1 minuto.
Eletromiografia
de superfície
Foi utilizado o eletromiógrafo
modelo Miotool 400 (Miotec®,
Porto Alegre/RS, Brasil), com conversor analógico-digital de quatro canais.
Para processamento dos dados foi usado o software Miograph
versão MiotecSuite1.0.1108 (Miotec®, Porto Alegre/RS,
Brasil), com resolução de 16 bits.
Os parâmetros do equipamento foram ajustados para um ganho
final de 1000 vezes, com filtros gerando uma banda passante entre 10 e 500 Hz
(passa-alta de 10 Hz e passa baixa de 500 Hz), filtro Notch
sintonizado para 60 Hz para redução da amplitude gerada pela eletricidade da
rede ambiente [13].
Os sinais do equipamento utilizaram frequência de
amostragem de 2.000 amostras/segundo por canal e captados por sensores
diferenciais de superfície (SDS500). Utilizando eletrodos de superfície de
prata cloreto de prata (Ag/AgC) com adesivos de hidrogel condutor da marca (KendalTM,
Mansfield – EUA), com formato circular e diâmetros de 10 mm, posicionados em
pares com distância entre os eletrodos de 14 mm. Antes da colocação dos
eletrodos, a pele foi tricotomizada com lâmina
descartável e limpa com álcool etílico 70%. O procedimento de preparo e as
orientações do paciente seguiram as recomendações da Surface Electromyography for the Non-Invasive Assessment of Muscles (SENIAM) [14].
Os posicionamentos dos eletrodos nos músculos seguiram as
recomendações padronizadas de Wu et al. [15] modificado, os quais foram
posicionados no hemicorpo direito. Para o músculo diafragma, utilizou-se o
primeiro ponto de intersecção no sexto espaço intercostal e o segundo no oitavo
espaço intercostal. Para o músculo esternocleidomastóideo,
os eletrodos foram posicionados em 1/3 e 2/3 do comprimento total do músculo. O
eletrodo de referência foi colocado no processo estilóide
da ulna do lado contralateral aos eletrodos de superfície.
A coleta dos dados eletromiográficos
foi realizada a cada semana de avaliação em dois momentos, o primeiro momento,
paciente sentado em uma posição confortável, ocorreu durante a verificação da PImáx e a obtenção do recrutamento das unidades
motoras por meio da amplitude do sinal eletromiográfico
pela expressão da raiz quadrada da média dos quadrados (RMS). No segundo
momento, foi solicitado que o voluntário realizasse uma inspiração (contração
isométrica) com duração de 10 segundos, por meio do dispositivo linear
respiratório com a carga determinada da semana.
A normalização dos valores eletromiográficos
da RMS foi direcionada para ações musculares isométricas, sendo disponibilizada
em % contração voluntária máxima (CVM), obtidas dos músculos diafragma e esternocleidomastóideo. O valor final foi normalizado por
meio de variáveis quantitativas contínuas expressas em valores percentuais.
Sendo associado há um maior percentual de atividade elétrica do músculo, um
maior recrutamento de unidades motoras, porém com menor eficiência para o
desempenho biomecânico para uma tarefa determinada.
Protocolo
terapêutico
O treinamento muscular inspiratório (TMI) foi realizado 3
vezes na semana, sendo que 1 sessão monitorada pelo pesquisador na UEAFTO e 2
sessões realizadas em domicílio, por 30 minutos, ao longo de 4 semanas com base
no protocolo de Ray et al. [16] modificado.
Os indivíduos receberam o dispositivo de carga linear Threshold® IMT, e as orientações devidas quanto ao
manuseio, postura e assepsia. Realizaram o treinamento em sedestação
com o dorso no encosto e os cotovelos apoiados em um anteparo. Foram solicitados
a utilizar o clipe nasal e inspirar completamente contra uma resistência
pré-ajustada pelos pesquisadores e expirar dentro do aparelho sem resistência,
em seguida retiravam o aparelho e continuavam a respirar normalmente até o
próximo ciclo cronometrado. Cada ciclo durou 10 segundos com descanso de 30
segundos, durante o treinamento contabilizou-se 45 incursões respiratórias com
ritmo tranquilo para evitar tontura ou enjoo.
A carga de treinamento inicial para cada participante foi
ajustada em 25% da PImáx. Os voluntários foram
treinados e instruídos a conduzir o programa de exercícios por conta própria no
seu domicílio sob monitoração à distância pelos pesquisadores. Uma vez por
semana, presencialmente na UEAFTO, o pesquisador determinava os novos valores
para carga a partir do novo registro da Pimáx.
Para a 1a avaliação 25%; 2a. avaliação 35%;
3a. avaliação 40%; 4a. avaliação
45%; 5ª. avaliação 50%. O dispositivo foi coberto
com material isolante para
que os participantes não tivessem acesso a mudança na
carga de treinamento.
Análise
estatística
Os dados coletados foram organizados em planilhas Excel
2007, submetidas à análise estatística por meio do programa Bioestat
5.0®, para verificação da normalidade adotou-se o teste de Shapiro-Wilk, para
inferência estatística dos dados paramétricos foram utilizados o teste T Student ou análise de variância (ANOVA) e para inferência
dos dados não paramétricos o teste de Wilcoxon.
Adotou-se nível alfa de significância de 5%.
Resultados
Dos sete voluntários portadores do HTLV-1 envolvidos na
pesquisa, 5 (71,42%) eram do sexo feminino e 2 (28,57%) do sexo masculino, com
idade 58,85 ± 7,21 anos. Quanto à forma clínica, 2 (28,57%) eram PET-MAH
provável, 2 (28,57%) PET-MAH definitivo e 3 (42,85%), sem PET-MAH (Tabela I).
Tabela
I - Perfil dos sete
portadores do HTLV-1 inseridos no estudo Belém, Pará, 2019
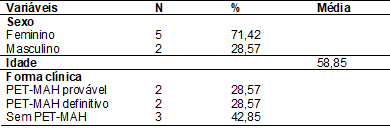
Fonte: Protocolo de pesquisa, 2019
A Tabela II aponta os valores obtidos na EMGs realizada na avaliação inicial (T0); segunda semana
(T2) e quarta semana (T4). Observa-se redução na média do potencial eletromiográfico para os músculos avaliados. Destacando
expressividade para o músculo esternocleidomastóideo
(p = 0,004), referindo um menor recrutamento de fibras musculares esqueléticas
após duas semanas de treinamento, frente ao músculo diafragma (p = 0,08).
Diante da carga acima 40% da Pimáx,
ou seja, de T2 a T4, verificou-se o aumento no potencial eletromiográfico,
principalmente do músculo esternocleidomastóideo (p =
0,06). Referente a avaliação inicial (T0) e a final (T4) ocorreu um aumento
maior do recrutamento das unidades motoras, sendo mais evidente para o músculo esternocleidomastóideo (p = 0,12) em comparação ao músculo
diafragma (p = 0,6).
Tabela
II - Análise da
eletromiografia dos músculos esternocleidomastóideo e
diafragma em sete portadores de HTLV-1 participes do estudo. Belém, Pará, 2019
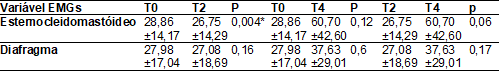
Protocolo de pesquisa, 2019; Dados são expressos como média
± desvio padrão; ANOVA (p < 0,05*); T0 = Avaliação inicial; T2 = Segunda semana
de avaliação; T4 = Avaliação final
Na Tabela III, observa-se a evolução das variáveis
estudadas após o TMR com aumento significativo entre os três momentos avaliados
da PImáx do T0 ao T2 (p = 0,005), T2 ao T4
(p = 0,01) e T0 ao T4, com a média de 66,05 (± 11,65) e 99.87 (± 26,31),
respectivamente, sugerindo que o treinamento muscular inspiratório foi capaz de
incrementar a força muscular respiratória dos sujeitos estudados (p = 0,007).
Tabela
III - Valores de PImáx, nos T0, T2 e T4, de sete portadores de HTLV-1
participantes do estudo. Belém, Pará, 2019

Fonte: Protocolo de pesquisa, 2019; Dados expressos como
média ± desvio padrão; Test t de Student pareado (p
< 0.05*); ANOVA (p < 0.05#); PImáx = Pressão
inspiratória máxima; T0 Avaliação inicial; T2 = Segunda semana de avaliação; T4
= Avaliação final
Discussão
O estudo teve como referência a análise da EMGs de dois músculos respiratórios (Figura 2), sendo um
músculo respiratório principal (diafragma) e o outro acessório (esternocleidomastóideo). O diafragma exerce uma função
essencial no processo respiratório e os músculos respiratórios acessórios
aumentam a ventilação quando há uma maior solicitação durante o exercício e
cooperam com a manutenção da ventilação quando o diafragma é comprometido após
doença ou lesão. O músculo diafragma e os músculos esternocleidomastóideos
colaboram com graus variados para o processo inspiratório e mostram diferentes
funções e características. A coleta do potencial elétrico do diafragma,
comparado com os músculos acessórios, não define a gravidade doença [17].
O predomínio do sexo feminino no presente estudo (Tabela I)
confirma dados de prevalência já apontados na literatura. Esse alto índice é
justificado no estudo de Sequeira et al. [18], devido ao início precoce de
relações sexuais, múltiplos parceiros sexuais e/ou não uso de preservativos
durante a relação sexual, quando esses fatores estão interligados o risco de
contaminação é potencializado.
As infecções podem estar relacionadas com a resposta
imunológica celular da vagina, na qual essa resposta sujeita-se a ação hormonal
modificando, assim, o epitélio e o aumento de linfócitos na região, dessa
maneira o agente agressor obtém um ambiente favorável à sua sobrevivência
[19,20].
O número de pessoas com a idade maior de 50 anos foi
expressivo (Tabela I), sendo este resultado identificado na literatura devido a
soroconversão tardia, a soropositividade do vírus
aumenta ao longo dos anos [20].
Os pacientes com PET-MAH apresentam várias semelhanças com
as lesões evidenciadas na doença Esclerose Múltipla (EM) e como em ambas ocorre
desmielinização crônica do sistema nervoso central, pode-se sugerir que
portadores sintomáticos com a evolução da doença apresentem comprometimento da
musculatura respiratória. Diante desse contexto, destaca-se a diminuição da capacidade
de gerar força ou endurance, podendo ocasionar
inadequada ventilação pulmonar, especialmente durante o exercício ou na
realização de atividades de vida diária (AVD) [7,21].
Verificou-se no estudo durante a primeira avaliação dos
sujeitos que os valores de PImáx estavam
abaixo do previsto. Sendo assim, Levy et al. [22] relatam que os
indivíduos com uma doença neurológica crônica, no decorrer do avanço da
enfermidade podem apresentar fraqueza dos músculos respiratórios.
O estudo elegeu o treinamento muscular inspiratório (TMI)
para esses indivíduos, uma vez que apresentavam os valores de Pimáx abaixo do previsto. O treinamento visou a
melhora da função muscular inspiratória, da dispnéia,
da força e resistência muscular inspiratória, sendo reconhecidos os benefícios
nos resultados pela progressão da Pimáx
no decurso do TMI [23,24].
Observou-se que no treinamento implementado aos
participantes houve uma progressão da força muscular significativa nas três
avaliações analisadas (Figura 3). Corroborando Ferreira et al. [25], que
constatou efeitos positivos do TMR com pacientes Esclerose Lateral Amiotrófica
(ELA) e Esclerose Múltipla, com aumento da Pimáx,
além da melhora da função ventilatória com aumento do volume expiratório
forçado em um segundo (VEF1) no grupo de intervenção em comparação com o
controle. Dessa forma, TMR vem sendo indicado com êxito, para pacientes com
doenças neurodegenerativas.
Diante desse contexto, necessita de uma ferramenta para
avaliar o desempenho do músculo durante o TMI. Uma das formas de avaliar o
comportamento dos músculos respiratórios, suas alterações de amplitude e do
espectro de potência da atividade elétrica é através da EMGs,
a qual, apresenta-se como um dos poucos métodos de avaliação direta, não invasiva.
O EMGs analisa o grau e a duração da atividade
muscular e se altera com o treinamento específico para o musculoesquelético. A
raiz quadrada da média dos quadrados (RMS) tem sido utilizado para quantificar
o sinal eletromiográfico [26].
Analisando a EMGs dos músculos
respiratórios, foi verificado um aumento da amplitude de sinal na atividade
elétrica muscular em relação a musculatura principal e acessória (Tabela II).
Segundo estudo [27] sobre EMGs de músculos
respiratórios realizado com candidatos ao transplante de fígado com
modificações da força muscular respiratória consequentes ao decréscimo da
capacidade oxidativa mitocondrial no tecido muscular, o aumento da atividade
muscular advém da exigência de maior força de contração e do aumento da atividade
muscular pelo déficit causado pela patologia, desta forma concebendo um aumento
da RMS.
O potencial de ação de unidades motoras se caracteriza por
vários parâmetros, dentre estes a quantidade de unidades motoras recrutadas, o
que reflete enquanto maior um potencial de ação ocorrerá maior recrutamento de
fibras musculares esqueléticas para realização do movimento. Verificou-se neste
estudo que ocorreu decréscimo do potencial de ação dos dois músculos na
primeira metade do treinamento (T0 a T2) (Tabela II), sugerindo que a carga
imposta pelo treinamento nas primeiras semanas contribuiu para um melhor
desempenho muscular exigindo menos fibras musculares esqueléticas para vencer a
resistência imposta [28].
Entretanto, com o decurso do TMI, observou-se o incremento
da força muscular e do potencial de ação dos músculos analisados, podendo
inferir que com a progressão da carga do treinamento semanal exigia que a
musculatura tivesse maior recrutamento de fibras musculares esqueléticas para
poder realizar a força estimada (Tabelas II e III). Dessa forma, a literatura
constata que o sinal mioelétrico engloba dados sobre
a forma do potencial de ação de unidades motoras e assim pode viabilizar uma
informação aproximada sobre a eletroneurofisiologia
do músculo esquelético ativo e detalhes particulares da atividade muscular a
ser estudada [9].
Sendo assim, a força muscular respiratória está fortemente
associada ao nível de ativação dos músculos. Constatou-se que a EMGs da musculatura respiratória pode ser utilizada como
uma ferramenta para investigar estratégias de recrutamento de unidade motora e
como índices indiretos da função muscular, incluindo produção de força muscular
e fatigabilidade [29].
Além do mais, verificou-se que o músculo esternocleidomastóideo possuiu maior aumento do seu
potencial mioelétrico apesar de não ter significância
estatística. Isso pode ter ocorrido por diversos fatores dentre eles o tempo de
treinamento com a carga estipulada a cada semana ter sido curto e consequentemente
não permitiu uma adaptação muscular ou devido ao músculo não estar habituado ao
trabalho constante, uma vez que sua contração é exigida quando necessita de uma
inspiração forçada. Lembrando que essa musculatura é acessória no processo de
respiração, visto que não está ativa durante a respiração basal. Essa
musculatura é recrutada e sua contração é ativa em atividades de altas demandas
e volumes pulmonares [30].
Costa [31] apontam em seus estudos sobre a relação
da eletromiografia quantitativa e o nível de força muscular em pacientes
neurológicos, nos quais níveis mais altos de força voluntária produziam maiores
potenciais de unidades motoras, os quais foram detectados por agulha e por
eletrodo de superfície. Sendo assim, o sinal eletromiográfico
constatado com eletrodos de superfície está fortemente relacionado à
intensidade contrátil.
A mensuração da força e perda de massa muscular de uma
forma não invasiva da musculatura respiratória é uma das limitações da
fisioterapia. Como não há trabalhos científicos com a investigação da EMGs em músculos respiratórios diante do HTLV-1, foi
necessário recorrer a estudos com pacientes hepatopatas,
com doença pulmonar crônica (DPOC) e esclerose múltipla.
A pesquisa trouxe consigo a identificação e um melhor
entendimento das alterações nos músculos respiratórios. A EMGs
mostrou que pode ser facilmente utilizada no contexto ambulatorial e traz
consigo informações significativas da qualidade muscular. As limitações fizeram
parte do estudo, tais como a alteração dos sinais pela anatomia do músculo e
suas propriedades fisiológicas, por não haver consenso para o posicionamento
ideal dos eletrodos de EMGs durante a avaliação não
invasiva da ativação do diafragma e a colaboração do paciente com a realização
do exame.
Por conseguinte, esta pesquisa abre novas portas para
estudos na área, para o melhor atendimento e acompanhamento desses pacientes a
fim de que seja otimizada a reabilitação deles, levando uma diminuição nas
complicações respiratórias.
Conclusão
No decurso da proposta ao treinamento muscular ocorreu
incremento da força muscular inspiratória com maior recrutamento de unidades
motoras dos músculos analisados pela EMGs em
voluntários com vírus linfotrópico de célula T humana do tipo 1.
Referências
- Schierhout G,
McGregor S, Gessain A, Einsiedel
L, Martinello M, Kaldor J. Association between HTLV-1
infection and adverse health outcomes: a systematic review and meta-analysis of
epidemiological studies. The
Lancet Infectious Diseases
2020;20(1):133-43. doi: 10.1016/s1473-3099(19)30402-5 [Crossref]
- Silva IC, Pinheiro BT, Nobre AFS, Coelho JL, Pereira CCC, Ferreira LSC, et al. Moderate endemicity of the human T-lymphotropic virus infection in the metropolitan region of Belém, Pará, Brazil. Rev Bras Epidemiol 2018;21. doi: 10.1590/1980-549720180018 [Crossref]
- Keikha M, Babaki MKZ, Fonseca LAM, Casseb J. The relevance of HTLV-1-associated myelopathy/tropical spastic paraparesis in Iran: a review study. Reviews in Clinical Medicine 2019;6(2):60-65. doi: 10.22038/RCM.2019.38759.1266 [Crossref]
- Normando
VMF, Dias ARN, da Silva ALSE, da Silva DP, de Souza MCS, et al. HTLV-I
induces lesions in the pulonary system: a systematic review. Life Sci
2020;256:11979. doi: 10.1016/j.lfs.2020.11979 [Crossref]
- Fukuoka J, Tominaga M, Ichikado K, Tanaka T, Ichiyasu H, Kohrogi H, et al. Lung military micro-nodules in human T-cell leukemia virus type I carriers. Pathol Int 2013;108-12. doi: 10.1111/pin.12030 [Crossref]
- Einsiedel L, Pham H, Wilson K, Walley R, Turpin J, Bangham C, Woodman RJ. Human T-Lymphotropic Virus type 1c subtype proviral loads, chronic lung disease and survival in a prospective cohort of Indigenous Australians. PloS Negl Trop Dis 2018;12(3). doi: 10.1371/journal.pntd.0006281 [Crossref]
- Falcão LFM. Alterações
no sistema pulmonar de pacientes com paraparesia espástica tropical ou
mielopatia associada ao HTLV-1 (PET/MAH [Tese]. Ananindeua: Instituto Evandro
Chagas; 2016 [Internet]. [cited 2021 mar 15]. Available from:
https://patua.iec.gov.br/handle/iec/3125
- Oliveira
AG, De Lima M, Proner J, Guarda GB, Kroth A. A efetividade do treinamento muscular respiratório
com Powerbreathe em atletas de basquete. Fisioterapia
em Ação 2017 [Internet];21-32. [cited 2021 mar 15]. Available from:
https://portalperiodicos.unoesc.edu.br/fisioterapiaemacao/article/view/13262
- De Luca CJ. The use of surface electromyography in biomechanics. J Appl Biomech 1997;13:135-163. doi: 10.1123/jab.13.2.135 [Crossref]
- Silva
AMO. Eletromiografia de superfície de músculos respiratórios: avaliação de hepatopatas em lista de espera de transplante de fígado e
de não hepatopatas [Tese]. São Paulo: Faculdade de
Ciências Médicas da Universidade Estadual de Campinas; 2014 [Internet]. [cited
2021 mar 15]. Available from: http://repositorio.unicamp.br/jspui/handle/REPOSIP/312442
- Walterspacher S, Pietsch F, Walker DJ, Rocker K, Kabitz HJ. Activation of respiratory muscles during respiratory muscle training. Respir Physiol Neurobiol 2018;247:126-32. doi: 10.1016/j.resp.2017.10.004 [Crossref]
- Neder JA, Andreoni S, Lerario MC, Nery LE.
Reference values for lung function tests. II. Maximal respiratory pressures and
voluntary ventilation. Braz J Med Biol Res
1999;32(6):719-27. doi: 10.1590/S0100-879X1999000600007 [Crossref]
- Merletti P,
Parker P. Electromyography: physiology, engineering
and noninvasive applications. New Jersey: John Wiley & Son; 2004.
- Hermens H, Freriks B, Disselhorst-Klug C, Rau G. Development of recommendations for SEMG sensors and sensor placement procedures. J Electromyogr Kinesiol 2000;10(5):361-74. doi: 10.1016/s1050-6411(00)00027-4 [Crossref]
- Wu W, Guan L, Li X, Lin L,Guo B, Yang Y, et al. Correlation and compatibility between surface respiratory electromyography and transesophageal diaphragmatic electromyography measurements during treadmill exercise in stable patients with COPD. Int J Chron Obstruct Pulmon Dis 2017;6(12):3273-80. doi: 10.2147/COPD.S148980 [Crossref]
- Ray AD, Udhoji S, Mashtare TL, Fisher NM. A combined inspiratory and
expiratory muscle training program improves respiratory muscle strength and
fatigue in multiple sclerosis. Arch Phys Med Rehabil
2013;94(10):1964-70. doi: 10.1016/j.apmr.2013.05.005 [Crossref]
- Zhang DD, Gan L, Zhu XF, ZhagLL, Gao J, Shi LC, et al. Neural respiratory drive measured using surface electromyography of diaphragm as a physiological biomarker to predict hospitalization of acute exacerbation of chronic obstructive pulmonary disease patients. Chin Med J 2018;131(23):2800-7. doi: 10.4103/0366-6999.246057 [Crossref]
- Sequeira
CG, Tamegão-Lopes BP, Santos EJ, Ventura AM,
Moraes-Pinto MI, Succi RC. Descriptive
study of HTLV infection in a population of pregnant women from the state of
Pará, Northern Brazil. Rev Soc Bras Med Trop 2012;45(4):453-6. doi: 10.1590/S0037-86822012005000007 [Crossref]
- Lucena AAS,
Michelin MA, Guimarães MVMB, Lodi CTC, Miranda MIL, Murta EFC, et al. Resposta
imune celular ao papilomavírus humano em mulheres infectadas e não infectadas
pelo vírus da imunodeficiência humana. Femina 2011 [Internet];39(3):150-5. [cited 2021 mar 15]. Available from:
http://files.bvs.br/upload/S/0100-7254/2011/v39n3/a2500.pdf
- Glória
LM, Damasceno SA, Rodrigues LR, Santos MSB, Medeiros R, Dias GAS, et al.. Perfil clínicoepidemiológico
de pacientes infectados pelo HTLV-1 em Belém/Pará. Cad
Saúde Coletiva 2015;23(2):157-62. doi: 10.1590/1414-462X201400050087 [Crossref]
- Morais MT, Caires SS. Perfil socioepidemiológico dos portadores do HTLV em um município do sudoeste baiano. Revista de Saúde Coletivada UEFS 2017;7(2):18-21. doi: 10.13102/rscdauefs.v0i0.1220 [Crossref]
- Levy J, Prigent H, Bensmail D. Respiratory rehabilitation in multiple
sclerosis: A narrative review of rehabilitation techniques. Ann Phys Rehabil Med 2018;61:38-45. doi: 10.1016/j.rehab.2017.06.002 [Crossref]
- Kock KS, Caiônico JC, Luiz AR, Arent YA, Fernandes I. Análise da pressão inspiratória com alto e baixo fluxos em resistor alinear. ASSOBRAFIR Ciência 2015;6(1):13-20. doi: 10.47066/2177-9333/ac.18983 [Crossref]
- Tzelepis
GE, McCool FD. Respiratory
dysfunction in multiple sclerosis. Respir Med 2015;09(6):671-79. doi: 10.1016/j.rmed.2015.01.018 [Crossref]
- Ferreira GD, Costa AC, Plentz
RD, Coronel CC, Sbruzzi G. Respiratory training
improved ventilatory function and respiratory muscle strength in patients with
multiple sclerosis and lateral amyotrophic sclerosis: systematic review and
meta-analysis. Physiotherapy 2016;102(3):221-28. doi: 10.1016/j.physio.2016.01.002 [Crossref]
- Reis IMM, Ohara DG, Januário LB, Basso-Vanelli RP, Oliveira AB, Jamami M. Surface electromyography in inspiratory muscles in adults and elderly individuals: A systematic review. J Electromyogr Kinesiol 2019;44:139-55. doi: 10.1016/j.jelekin.2019.01.002 [Crossref]
- Custódio SR,
Santos RB, Silva ÁMO, Ratti LDSR, Boin
IDFSF, Duarte RP, et al. Effects of respiratory endurance test detected by
surface electromyography (sEMG) in patients
candidates for liver transplantation. J
Bras Transpl
2016 [Internet];19(4):6-10. [cited 2021 may 14]. Available from: https://site.abto.org.br/wp-content/uploads/2020/06/4_2-1.pdf
- Duarte RP, Sentanin AC, Silva AMO, Tonella RM, Duarte GL, Ratti LSR, Boin IFSF. Diaphragm muscle surface electromyography in patients submitted to liver transplant and eligible for extubation. Transplantation Proceedings 2017;49(4),829-31. doi: 10.1016/j.transproceed.2017.01.059 [Crossref]
- Lozano-García M, Sarlabous
L, Moxham J, Rafferty GF, Torres A, Jané R, Jolley C.
Surface mechanomyography and electromyography provide noninvasive indices of
inspiratory muscle force and activation in healthy subjects. Sci Rep 2018;8:1-13. doi: 10.1038/s41598-018-35024-z [Crossref]
- Grosu HB, Ost DE, Lee YI, Song J, Li L, Eden, E, Rose K. Diaphragm muscle thinning in subjects receiving mechanical ventilation and its effect on extubation. Resp Care 2017;62(7):904-11. doi: 10.4187/respcare.05370 [Crossref]
- Costa HLLS. Análise da atividade dos músculos respiratórios por meio da eletromiografia de surface durante a mensuração do índice de esforço inspirat´orio cronometrado [Dissertação]. Niteroi/RJ;2019 [Internet]. [cited 202 dez 17]. Available from: https://app.uff.br/riuff/handle/1/13089