Fisioter Bras 2021;2295):649-66
ARTIGO
ORIGINAL
Efeitos
de um programa de condicionamento físico no equilíbrio e funcionalidade da
marcha em indivíduos pós acidente vascular cerebral
Effects of a physical conditioning
program on balance and gait function in stroke patients
Sabrina
Kyoko de Paula Asa, M.Sc.*,
Elaine Menezes de Oliveira**, Gabriela da Silva Matuti,
M.Sc.*, Clarissa Barros de Oliveira, D.Sc.*
*Fisioterapia
de Adultos da Associação de Assistência à Criança com Deficiência (AACD),
**Fisioterapia de Adultos da Associação de Assistência à Criança com
Deficiência (AACD), Mestranda em Neurologia/Neurociências da UNIFESP
Recebido
em 7 de abril de 2021; aceito em 7 de outubro de 2021.
Correspondência: Sabrina Kyoko
de Paula Asa, Rua Dom Mateus, 55/141-A, Vila Monumento 01548-030 São Paulo SP
Sabrina Kyoko de Paula Asa:
sabrinaasa@outlook.com
Gabriela da Silva Matuti:
gabrielamatuti@hotmail.com
Elaine Menezes de Oliveira:
elaine_m_oliveira@yahoo.com.br
Clarissa Barros de Oliveira: cboliveira@aacd.org.br
Resumo
O
Acidente Vascular Cerebral (AVC) pode gerar diminuição do nível de atividade
física, força muscular e capacidade aeróbica e com isso levar à redução da
velocidade e à qualidade da marcha. O presente estudo teve como objetivo investigar
os efeitos que exercícios aeróbios associados ao fortalecimento de membros
inferiores podem ter sobre o equilíbrio e a funcionalidade da marcha em
indivíduos que sofreram AVC. Foram avaliados indivíduos submetidos a um
protocolo de condicionamento físico na Associação de Assistência à Criança
Deficiente (AACD). Foram observadas mudanças em todas as variáveis analisadas
(Teste de caminhada de 6 minutos, Teste de caminhada de 10 metros, Timed Up and
Go e Mini BEST-test) após o término do protocolo e 3 meses
de follow-up. A melhora encontrada no mini BEST-test
foi estatisticamente significante. O protocolo de condicionamento físico
realizado promoveu melhora no desempenho da marcha e influência significativa
no equilíbrio dos indivíduos estudados.
Palavras-chave: acidente vascular cerebral; exercício;
Fisioterapia.
Abstract
Stroke can lead to decreased levels of physical
activity, muscle strength and aerobic capacity, leading to reduced gait
velocity and quality. The present study aimed to investigate the impact of
aerobic exercises associated with lower limb strengthening on balance and gait
functionality in stroke patients. We evaluated patients submitted to a physical
conditioning protocol at the Associação de Assitência à Criança Deficiente (AACD). There were improvements in all variables
analyzed (6-minute walk test and 10-meter walk test, Timed Up and Go and Mini
BEST-test) after the end of the protocol and after 3 months of follow-up. The
improvement found in mini BEST-test was statistically
significant. The exercise program generated a tendency to improve gait
performance and a significant improvement in balance in the group of patients
analyzed.
Keywords: stroke; exercise; Physical
therapy specialty.
Introdução
O Acidente Vascular Cerebral (AVC) é uma das doenças
crônicas mais comuns em adultos e a maioria dos sobreviventes deste evento
evolui com sequelas como alteração do tônus muscular, diminuição de força,
rigidez, alteração sensorial, obesidade e baixa tolerância ao exercício,
gerando muitas vezes um estilo de vida sedentário ou acentuando um estilo de
vida pouco ativo prévio ao AVC [1,2,3,4].
Esses fatores são intimamente associados
à redução da velocidade e à qualidade do
padrão de marcha e à menor participação
nas atividades de vida diária, instalando-se um ciclo vicioso de
diminuição de
atividade física, força muscular e capacidade
aeróbica [5].
Muitos dos indivíduos com AVC e cardiopatas compartilham
das mesmas comorbidades e apresentam a mesma predisposição a terem recorrência
de eventos isquêmicos cerebrais. As comorbidades prévias do AVC e da doença
arterial coronariana (DAC), como a hipertensão arterial sistêmica (HAS),
obesidade, diabetes, tabagismo, sedentarismo e dislipidemia podem se tornar
mais intensos e dificultar a reabilitação [5,6,7]. Já foi demonstrado que a
proposta de um treinamento visando à melhora do condicionamento físico e da
capacidade aeróbica é benéfica para esta população [8]. Esse tipo de abordagem
pode levar ao aumento do nível de atividade física e impactar positivamente na
habilidade de deambulação e realização de atividades de vida diária, com ganho
em qualidade vida [9].
As alterações no equilíbrio são consideradas como um dos
principais problemas em indivíduos com sequelas após o AVC por ser um fator de
risco relevante para quedas. Várias características fisiológicas alteradas por
um AVC, como déficits na força muscular dos membros inferiores e na capacidade
aeróbica estão relacionadas ao comprometimento do equilíbrio nessa população.
Visto que o equilíbrio é importante para atividades funcionais como o
posicionamento sentado, transferências (como a passagem do sentado para em pé)
e a marcha, alterações no equilíbrio afetam potencialmente as atividades de
vida diária [10].
Em relação aos diferentes tipos de treinamento propostos na
literatura para indivíduos com sequelas do AVC, já foi demonstrado que um
treinamento resistido progressivo pode levar ao aumento de velocidade da
marcha, prevenir osteopenia, diminuir o risco de quedas e promover o aumento da
massa muscular. O treinamento aeróbio está mais ligado ao aumento da capacidade
aeróbia, podendo influenciar na neuroplasticidade, diminuir o gasto energético
durante atividades em geral e diminuir o debito cardíaco
ao repouso [9,11,12,13]. A modificação de múltiplos fatores de risco através de
intervenções no estilo de vida e tratamento farmacológico adequado é
reconhecida como formas de prevenção de AVC recorrente e de eventos cardíacos
agudos em sobreviventes de AVC [14].
Objetivo
Na literatura recente ainda são muito discutidos os efeitos
e benefícios dos treinamentos aeróbicos e resistidos em indivíduos com sequelas
decorrentes do AVC e como os possíveis ganhos podem ser redirecionados para a
melhora da qualidade de vida, equilíbrio e funcionalidade na marcha. Dessa
forma, o presente estudo tem o intuito de investigar os efeitos que um programa
de condicionamento físico no equilíbrio e na funcionalidade da marcha em um
grupo de indivíduos que sofreram AVC.
Métodos
Foi realizado um estudo retrospectivo baseado na análise
dos dados presente nos prontuários dos indivíduos com diagnóstico de
hemiparesia após AVC que participaram de um protocolo de condicionamento físico
durante 4 meses, entre os meses outubro de 2014 e de março de 2018 na unidade
Ibirapuera da Associação de Assistência à Criança com Deficiência (AACD) em São
Paulo. Esses indivíduos não realizavam outras terapias motoras durante o
período em que participaram do programa de condicionamento físico.
Esse trabalho foi submetido à análise do Comitê de Ética e
Pesquisa da AACD e aprovado sob parecer número 2.617.843 (CAAE:
87450318.3.0000.0085).
Critérios
de inclusão
-
Indivíduos com diagnóstico de hemiparesia após AVC;
-
Tempo de lesão mínimo de 6 meses no início da intervenção;
-
Apresentarem capacidade de marcha com ou sem uso de aditamentos, sem a
necessidade de auxílio de terceiros;
-
Apresentarem liberação médica para realização de exercícios físicos;
-
Terem completado o protocolo do condicionamento físico;
-
Apresentarem dados completos das avaliações registradas em prontuário.
Critérios
de exclusão
-
Apresentarem sequelas decorrentes de outras lesões neurológicas;
-
Possuírem déficits cognitivos, visuais e auditivos que impedisse a realização
dos testes de avaliação e dos exercícios propostos no treinamento.
Coleta
dos dados
Foram coletados os seguintes dados para caracterização da
amostra: idade, gênero, tempo de lesão, hemicorpo acometido pelo AVC,
realização e frequência de atividade física prévia ao AVC, presença de
comorbidades (HAS, cardiopatia, diabetes mellitus, hipercolesterolemia),
tabagismo e etilismo prévio ao AVC.
As avaliações foram realizadas em três momentos, 1) Pré-intervenção (uma semana antes do início do protocolo);
2) No término do protocolo (máximo de 15 dias após o último dia de terapia); e
3) Follow-up de 3 meses após o término do protocolo. O protocolo de avaliações
incluiu: teste de caminhada de 6 minutos (TC 6min), teste de caminhada de 10
metros (TC 10m), Timed Up and Go (TUG) e o Mini-BESTest (Mini-Balance Evaluation System
Test) que foram realizados por um avaliador independente.
O TC 6min é uma avaliação do consumo máximo de oxigênio e
parametrização da distância percorrida. Inicialmente foi idealizado para
indivíduos com condições cardiorrespiratórias e ao longo dos anos utilizado
como referência sobre a funcionalidade da marcha de indivíduos após AVC [15].
Antes do teste o indivíduo fez um repouso de 10 minutos e depois foram coletadas
pressão arterial, frequência cardíaca, frequência respiratória, oximetria de
pulso, nível de dispneia e cansaço de membros inferiores pela Escala de
percepção de fadiga de Borg. O teste consistiu em o indivíduo caminhar em um
corredor de 21 metros (demarcados por cones nas extremidades) por 6 minutos sem
parar na máxima velocidade possível e segura escolhida pelo indivíduo, podendo
interromper o teste a qualquer momento, mas sem pausa do cronômetro. O teste
foi realizado 2 vezes com intervalo de 15 minutos e/ou com a volta dos sinais
vitais aos parâmetros basais (do início do teste) ao final de cada tentativa
foram coletados os sinais vitais novamente [15].
O TC 10m é um instrumento amplamente usado para vários
grupos de indivíduos e foi demonstrada sua confiabilidade para indivíduos com
AVC [10]. Para o teste foi demarcada uma distância de 12 metros por 2 cones de
sinalização (o primeiro e último 1 metro foram utilizados para aceleração e
desaceleração, sendo descartados da coleta). O tempo realizado para percorrer a
distância entre os dez metros foi marcado. Foi instruído que cada indivíduo andasse
em velocidade normal, auto-selecionada.
Para o TUG, os indivíduos se sentaram em uma cadeira com
apoio de antebraço, sendo instruídos a levantar e andar o mais rápido possível
até uma distância marcada por um cone aos 3 metros, contornar e retornar sentando na cadeira novamente. O tempo foi cronometrado
iniciando com a palavra “vai” e terminado quando o indivíduo encostasse as
costas no encosto da cadeira [16].
Para análise do equilíbrio foi realizado o teste mini-BESTest, que é a versão resumida do Balance Evaluation Systems Test (BESTest),
que analisa 6 diferentes domínios ou sistemas que contribuem para o controle do
equilíbrio (características biomecânicas, limites de estabilidade, ajustes
posturais antecipatórios, respostas posturais automáticas, organização
sensorial e estabilidade na marcha). O Mini-BESTest
foi desenvolvido para reduzir o tempo de aplicação do BESTest
e possui 14 itens pontuados em uma escala ordinal de 0 (déficit importante do
equilíbrio) a 2 (sem comprometimento do equilíbrio). Este instrumento foi
traduzido e validado para o português e para a população com hemiparesia
crônica pós AVC [17,18,19].
O programa de condicionamento foi realizado 2 vezes por
semana em dias não consecutivos, com sessões de 1 hora
e 10 minutos de duração. As sessões foram supervisionadas por um fisioterapeuta
que ficava responsável por 1 ou 2 indivíduos. Em cada sessão, os indivíduos
realizaram exercícios aeróbicos de acordo com a capacidade motora individual.
Esses exercícios consistiram em pedalar em uma bicicleta ergométrica com
encosto e apoios dos pés adaptados e/ou deambular em uma esteira. Nessas
atividades, os indivíduos tinham a pressão arterial monitorada antes e após os
exercícios e a frequência cardíaca monitorada durante toda a atividade por um
medidor de frequência cardíaca da marca Polar®, modelo FT1. Ao longo do
programa, o objetivo foi a manutenção das atividades por 30 minutos sem
interrupção. Gradativamente, o fisioterapeuta responsável aumentava a
velocidade da esteira e/ou a carga na bicicleta ergométrica de acordo com os
parâmetros observados em cada indivíduo.
Os indivíduos também realizaram exercícios resistidos de
membros inferiores com objetivo de fortalecer e ganhar resistência
principalmente nos músculos flexores e extensores de quadris e joelhos e
abdutores de quadris. Os exercícios estipulados foram individualizados de
acordo com as características motoras de cada indivíduo. Ao longo do programa,
o número de repetições e/ou carga em cada exercício era aumentado de acordo com
a evolução do indivíduo.
Resultados
Participaram deste estudo 20 indivíduos. Para a análise
estatística, devido ao pequeno número da amostra, foram utilizadas as medidas
não paramétricas associadas às variáveis quantitativas: mediana e percentil
25-75. Todos os testes estatísticos e gráficos foram executados no IBM SPSS Statistics [20] ou R [21]. A mediana em relação à idade dos
indivíduos foi de 52,0 anos, (41-59,5), e do tempo de lesão foi 55,5 meses
(39,5-99).
Para análise dos dados, os indivíduos foram divididos em
dois grupos em relação à marcha: domiciliar/terapêutica (n = 13) e comunitária
(n = 7). Essa divisão foi realizada de acordo com o critério do estudo de Madhavan e Bishnoi [22] que
considera os indivíduos com velocidade acima de 0,8 m/s como deambuladores rápidos (comunitária) e velocidade inferior a
esse valor, como deambuladores lentos
(domiciliar/terapêutica).
Foram considerados significantes todos os resultados com
nível descritivo menor que 5% (valor de p < 0,05). As variáveis foram
descritas por suas frequências e intervalos de confiança ou medidas de
tendência central e dispersão. Todos os intervalos de confiança apresentados
são de 95% (alfa de 0,05). Os intervalos de confiança de frequência foram
calculados utilizando-se o método de bootstrapping,
com 1000 interações. A associação entre o tempo da avaliação (inicial, final ou
follow-up) e as variáveis distância percorrida no TC6 min, pontuações no TUG e Mini-BESTest foi avaliada através de teste estatístico
ANOVA não paramétrica, implementada no pacote nparLD
[23].
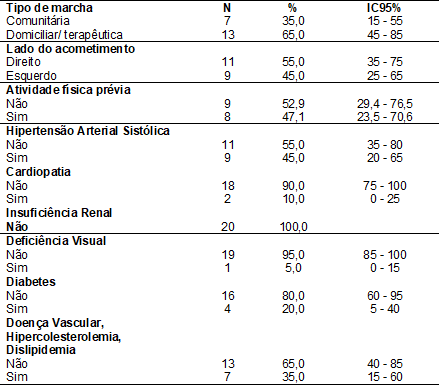
A tabela I apresenta a análise descritiva dos dados
demográficos. Quando o total da variável não corresponde ao N total da amostra
(20 indivíduos), isso se deve ao número de dados faltantes, não encontrados em
prontuário. Os intervalos de confiança ausentes também são consequência desta
limitação.
Tabela
I - Estatística
descritiva das variáveis qualitativas por suas medidas de tendência central
(frequência) e de dispersão (Intervalo de confiança)
Os indivíduos realizaram 3 meses de sessões de fisioterapia
(2x/semana). Foi observado que ao longo do programa conseguiram aumentar o
tempo de execução das atividades aeróbicas, mantendo em média 65% da frequência
cardíaca máxima predita para a idade, calculada por meio da fórmula de Karvonen [24]. Cinco indivíduos realizaram um intervalo
durante a atividade aeróbica (realizada na bicicleta ergométrica) no início do
protocolo. Ao término do programa, todos os indivíduos realizavam 30 minutos de
atividade aeróbica sem interrupção. Entre os indivíduos analisados, a maior
parte (n = 12) utilizou apenas a bicicleta ergométrica e os demais (n = 8)
utilizaram tanto a bicicleta quanto a esteira, sendo 15 minutos em cada aparelho.
A opção entre realizar a atividade aeróbica na esteira ou na bicicleta foi de
acordo com a capacidade motora de cada indivíduo.
Em relação aos exercícios resistidos, foi observado que
todos os indivíduos conseguiram aumentar o número de repetições e a carga
durante os exercícios de fortalecimento de membros inferiores.
Sobre as variáveis analisadas, houve uma melhora dos
resultados encontrados nas avaliações inicial, final e no follow-up, em relação
à distância percorrida no TC 6min, aos tempos de execução do TC10m e TUG,
quando analisada a amostra total do estudo e ao avaliar os grupos de marcha
domiciliar/terapêutica e comunitária separadamente. No entanto, essa diferença
não foi estatisticamente significante.
No TC 6min, não houve uma melhora significativa na
distância percorrida em seis minutos, para o total de indivíduos avaliados (p =
0,405) (Figura 1).
Quando analisados os grupos marcha comunitária e
domiciliar/terapêutica pelo teste ANOVA não paramétrico, o comportamento dos
grupos é semelhante, como podemos observar no gráfico abaixo (Figura 2),
evidenciado pela interação grupo*tempo não significativa neste mesmo teste (p =
0,622).
Ao analisar o grupo de sujeitos como um todo, apesar de se
observar no gráfico uma tendência de queda do tempo obtido no TUG, esta
tendência se acentua no período de alta do indivíduo. Ainda assim, a tendência
não alcançou significância estatística para o efeito do tempo (p = 0,079)
(Figura 3).
Assim como para a distância percorrida no TC 6min, há uma
diferença esperada entre os grupos (p < 0,001), mas estes não evoluíram de
forma diferenciada no tempo (interação grupo*tempo, p = 0,920), o que significa
que não foi detectado efeito do tratamento (Figura 4).
Em relação à pontuação no mini-BESTest,
houve evolução significativa ao longo do tempo (p < 0,001). Isso significa
que o tratamento mostrou melhora deste parâmetro para todos os indivíduos ao
longo do tempo (Figura 5).
Não houve diferença significativa entre os grupos no tempo
(interação grupo*tempo, p = 0,674), mas a diferença devido ao desenho dos
grupos se mantém (p < 0,001). Mesmo considerando os grupos em separado,
houve efeito do tempo (p < 0,001), o que significa que ambos os grupos sofrem
efeito do tratamento na mesma medida, não tendo um grupo com maior ou menor
benefício observado (Figura 6).
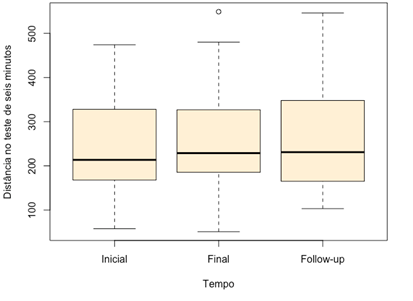
Figura
1 - Boxplot
da distância percorrida no teste de seis minutos nos tempos avaliados, para
todos os sujeitos da pesquisa
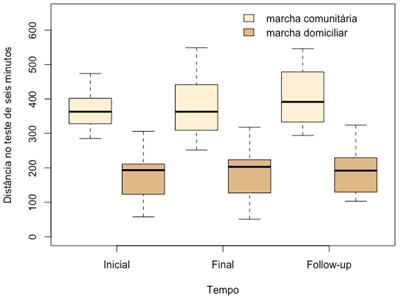
Figura
2 - Boxplot
da distância percorrida no TC6 min nos tempos avaliados, para os grupos de
marcha comunitária e domiciliar
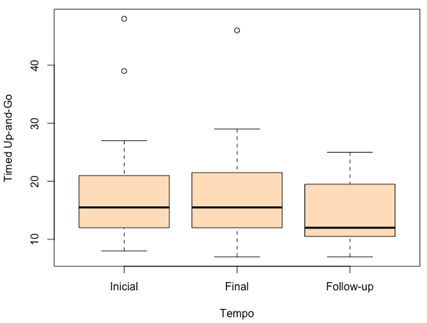
Figura
3 - Boxplot
dos dados obtidos no TUG nos tempos avaliados, para todos os sujeitos da
pesquisa
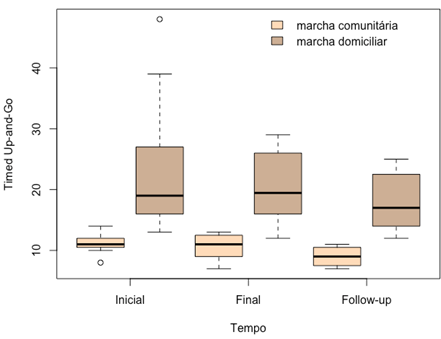
Figura
4 - Boxplot
dos dados obtidos no TUG nos tempos avaliados, para os grupos de marcha
comunitária e domiciliar
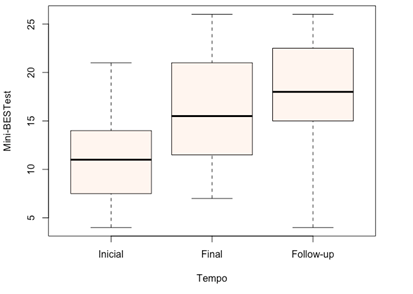
Figura
5 - Boxplot
da pontuação no Mini BESTest nos tempos avaliados,
para todos os sujeitos da pesquisa
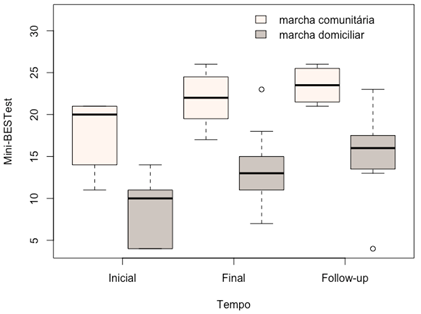
Figura
6 - Boxplot
da pontuação no mini BESTest nos tempos avaliados,
para os grupos de marcha comunitária e domiciliar
Discussão
No atual estudo, foram avaliados poucos indivíduos, com uma
faixa etária heterogênea, sem grupo controle, encontrando-se todos na fase
crônica de recuperação pós AVC. Apesar dessas limitações, os resultados sugerem
benefícios do protocolo de condicionamento físico e possibilidades para a
realização de novos estudos. Foram observadas melhoras nos valores encontrados
em todas as variáveis analisadas (TC 6min, TC10m, TUG e mini-BESTest)
após o término do protocolo e 3 meses de follow-up, no entanto apenas no mini-BESTest foi estatisticamente significante.
Indivíduos com sequelas decorrentes de um AVC são
frequentemente descondicionados e predispostos ao estilo de vida sedentário, o
que impacta negativamente no desempenho das atividades de vida diária, aumenta
o risco de quedas e de um novo AVC ou doenças cerebrovasculares recorrentes
[5].
Após um AVC, os objetivos da atividade física e da
prescrição de exercícios devem ser adequados à tolerância dos indivíduos,
estágio da recuperação, condições do ambiente, suporte social disponível,
preferências para realização da atividade física, e as incapacidades,
limitações de atividade e participação específicas. Uma vez que o indivíduo
está clinicamente estável, o próximo objetivo é iniciar um regime de
treinamento elaborado para restabelecer (ou exceder) níveis de atividade
prévios ao AVC o mais rápido possível [5].
A maior parte dos programas de exercícios físicos em
indivíduos após AVC inclui predominantemente exercícios aeróbios com a
bicicleta ergométrica [25]. No presente estudo, devido ao comprometimento motor
dos indivíduos analisados e devido ao alto risco de quedas, a maior parte dos
sujeitos (n = 12) realizou a atividade aeróbia apenas na bicicleta ergométrica.
Os demais indivíduos foram capazes de realizar a marcha na esteira, mantendo 15
minutos de atividade contínua em cada modalidade, totalizando 30 minutos de
atividade aeróbica.
As formas de treinamento aeróbio após o AVC podem incluir cicloergômetro de membros superiores, bicicleta ergométrica,
esteira ou diferentes formas associadas. As atividades devem ser realizadas em
40 a 70% do pico de consumo de oxigênio ou da frequência cardíaca de reserva, e
a escala de esforço percebido pode ser usada como um adjunto [6]. Evidências
mostram que vários indivíduos após AVC não deambulam com velocidade e por tempo
suficiente para atingir uma melhora na função cardiovascular, o que limita o
uso de esteiras ergométricas nos estudos [25]. A frequência recomendada é de 3
a 7 dias/semana, com duração de 20 a 60 minutos/dia continuamente ou
intermitente (séries de 10 minutos), dependendo do nível de condicionamento do
indivíduo. O treinamento intermitente pode ser necessário durante as primeiras
semanas de reabilitação devido ao nível de falta de condicionamento extremo de
alguns indivíduos convalescentes [5,6].
Já foi demonstrado que o consumo máximo de oxigênio (VO2máx),
uma medida de condicionamento cardiovascular, está reduzido entre 10 e 17 mL/kg/min, no primeiro mês após o AVC, e permanece abaixo
de 20 mL/kg/min nos próximos 6 meses. Os mesmos
valores podem ser 45% menores do que comparados com indivíduos saudáveis da
mesma idade. Essa diminuição do valor de VO2máx se torna ainda mais
relevante ao se considerar que um valor mínimo de 20 mL/kg/min
é necessário para realizar as atividades diárias e para viver de forma
independente em idosos após AVC. Além do declínio relacionado ao
condicionamento cardiovascular, uma perda natural no VO2máx acontece
após os 50 anos, sendo aproximadamente entre 5 e 10% de perda (ou
aproximadamente 5mL/kg/min) por década. Assim, indivíduos idosos após AVC
enfrentam o prejuízo cardiorrespiratório relacionado ao AVC e ao processo de
envelhecimento [25]. Estudos demonstraram que indivíduos com AVC crônico irão
atingir a capacidade aeróbia máxima durante as AVDs.
Até mesmo atividades domésticas, como arrumar a cama e aspirar o pó, são
associadas a exigências energéticas maiores em mulheres que sofreram um AVC
[6]. Assim, um discreto aumento da capacidade aeróbia pode significar a
diferença entre a dependência e a independência durante todas as AVDs [26].
A diminuição de força muscular é considerada a principal
causa de incapacidade motora em indivíduos após um AVC. As alterações na marcha
acontecem em cerca de 80% dos indivíduos, e a fraqueza muscular no membro
inferior parético justifica aproximadamente 50% do comprometimento da marcha
entre os indivíduos com hemiparesia crônica leve a moderada. Como resultado, os
padrões de marcha se tornam assimétricos e a velocidade de marcha reduzida.
Além disso, a incapacidade para marcha é frequentemente observada nos primeiros
seis meses após o AVC [25]. Nesse período, 30% desses indivíduos ainda não pode
andar sem assistência [27,28] e um ano após o evento (com relativa boa recuperação),
metade dos indivíduos não conseguem completar o teste de caminhada de 6 minutos
tendo capacidade de andar somente 40% da distância predita [28]. Essa
incapacidade pode precipitar e exacerbar um estilo de vida sedentário e a falta
de condicionamento cardiovascular [25].
A fraqueza muscular após o AVC pode ser explicada pela
mudança das fibras musculares de contração lenta para fibras de contração
rápida que ocorre em músculos com pouca carga ou desuso. Essa alteração é
oposta às mudanças esperadas no envelhecimento natural, pois fibras de
contração rápida são preferencialmente perdidas devido à desnervação
e a densidade das fibras de contração lenta aumenta. Essas alterações nos
músculos paréticos, após o AVC, podem resultar em um músculo mais fatigável que
também pode ser mais resistente à insulina [7].
Ainda não há um consenso para a determinação de quando e
como iniciar o treino de fortalecimento após um AVC, seja ele isquêmico ou
hemorrágico. No presente estudo, os exercícios de fortalecimento muscular
envolveram principalmente os músculos flexores e extensores de quadris e
joelhos e abdutores de quadris, adequando-se às limitações motoras dos
indivíduos avaliados. Alguns autores relatam que a força de flexores de quadril
e extensores de joelho do lado parético são os fatores mais determinantes de
uma marcha confortável e com maior velocidade [29].
É prudente prescrever 10 a 15 repetições
para cada série de exercícios de fortalecimento para os indivíduos após AVC.
Esses programas de treinamento devem ser realizados 2 a 3 x/semana e incluir um
mínimo de 8 a 10 exercícios que envolvam os principais grupos musculares de
membros superiores e inferiores [6]. A frequência nos estudos envolvendo
exercícios de fortalecimento variou de 2 a 5 vezes por semana com duração de 4
a 12 semanas [25]. Alguns estudos sugerem que esses programas podem promover
ganhos na força e velocidade da marcha em que o treinamento excêntrico pode ser
mais adequado que o concêntrico [6].
A maior parte dos indivíduos que sobrevivem ao AVC recupera
a capacidade de andar sem auxílio físico e/ou de terceiros, mas menos de 10%
atingem velocidade e resistência adequadas para uma participação normal e
independente no ambiente comunitário. Esta capacidade limitada para marcha é
primariamente atribuída ao déficit de controle motor. Entretanto o
descondicionamento físico é muito comum entre os indivíduos que sofreram AVC e
contribui para as limitações da marcha, especialmente em relação à resistência
[30].
A velocidade da marcha é um preditor importante para a
recuperação funcional após AVC. O retorno da marcha é um dos principais
objetivos terapêuticos relatados pelos indivíduos. No entanto, apenas metade
dos indivíduos com AVC com maior funcionalidade é capaz de atingir uma
velocidade de marcha capaz de torná-los deambuladores
comunitários independentes. Já foi descrito que a velocidade de 0,8 m/s é um
indicador da capacidade de marcha comunitária. No estudo de Madhavan
e Bishnoi [22]. os deambuladores
com velocidade acima de 0,8 m/s foram considerados deambuladores
rápidos (com marcha comunitária) e os que tinham velocidade inferior a esse
valor foram considerados deambuladores lentos (marcha
terapêutica/domiciliar). No atual estudo, os indivíduos foram divididos de acordo
com esse critério e foi observado que todos os indivíduos apresentaram melhora
nos testes de caminhada (TC 10m e TC 6min), no entanto essa melhora não foi
estatisticamente significante. O estudo de Wist et
al. [30] também mostra que o treino de força muscular em membros inferiores
para indivíduos hemiparéticos crônicos gerou melhora sem significância
estatística nos testes de TC 6min e TC 10m. Apesar de não haver mudança
estatisticamente significante, pode-se notar que nossos resultados apresentam
melhora clinicamente relevante para os testes TUG e TC 10m, uma vez que a
literatura aponta para uma melhora significante ganhos de 3,6 segundos no TUG e
0,10m/s no TC 10m [29].
Um dos principais determinantes da velocidade da marcha é o
equilíbrio [22]. Entre os indivíduos avaliados no atual estudo, todos
apresentaram melhora significante nos valores dos testes relacionados ao
equilíbrio (TUG e mini-BESTest), no entanto no mini-BESTest a melhora foi estatisticamente significante
tanto no grupo de marcha comunitária (p = 0,00) quanto terapêutica/domiciliar
(p = 0,00). Uma pontuação acima de 19 pode ser utilizada para identificar
indivíduos com AVC que possuem a capacidade de deambular com velocidades acima
de 0,8 m/s, ou seja, indivíduos que apresentam pontuação acima de 19 no mini-BESTest, mas os que deambulam com velocidade menor que
0,8 m/s podem ser capazes de aumentar a velocidade da marcha com uma terapia
mais direcionada, considerando que nenhum outro fator como um déficit visual ou
cognitivo, esteja limitando essa capacidade [22].
Nossos resultados relacionados ao equilíbrio corroboram os
dados da meta-análise de Wist et al. [29] que mostram
que o treino de força muscular de membros inferiores pode gerar melhora do
equilíbrio quando avaliados pela Escala de Berg [31].
O exercício físico é um recurso muito valioso, com forte
embasamento científico, no entanto pouco utilizado após o AVC. Muitos
indivíduos após AVC possuem capacidade de realizar maiores níveis de atividade
física, mas optam por não realizar. As razões para a limitada participação em
programas de exercícios incluem a falta de 1) conhecimento de que o exercício é
possível e desejável; 2) acesso aos recursos para realização dos exercícios; e
3) sessões de exercícios estruturadas nas quais os exercícios possam ser
demonstrados por especialistas da reabilitação ou educadores físicos [5].
Com informação e encorajamento sobre os benefícios e
segurança dos exercícios após o AVC e o desenvolvimento de programas adequados
em ambientes hospitalares, centro de reabilitação e na comunidade, o
engajamento de indivíduos em programas de exercícios físicos deve aumentar.
Esses protocolos, desenvolvidos por profissionais especializados, devem ser
oferecidos logo após o AVC, quando é possível gerar maior impacto na recuperação
funcional e devem ser mantidos durante os estágios crônicos para ter efeito no
estilo de vida e melhorar a saúde em geral [5]. Estes dados corroboram os
nossos achados, uma vez que, mesmo não apresentado significância estatística,
os indivíduos tendem a manter um padrão de ganho após 3 meses do término do
protocolo.
Além dos benefícios dos exercícios físicos na melhora da
função física após o AVC, pesquisas recentes sugerem que os exercícios podem
melhorar sintomas de depressão, algumas funções executivas, memória, qualidade
de vida e fadiga após AVC [5].
Conclusão
Os resultados deste estudo demonstraram que um protocolo de
condicionamento físico, composto por atividades aeróbias (bicicleta ergométrica
e esteira) e exercícios de fortalecimento de membros inferiores, promoveu uma
mudança no desempenho da marcha e uma influência significativa no equilíbrio em
um grupo de indivíduos na fase crônica após o AVC. Importante ressaltar que
também não houve eventos adversos relatados durante o protocolo nestes
indivíduos.
Referências
- Pang MYC, Eng JJ, Dawson AS,
McKay HA, Harris JE. A community-based fitness and mobility exercise program
for older adults with chronic stroke: a randomized, controlled trial. J Am Geriatr Soc 2005;53(10):1667-74. doi: 10.1111/j.1532-5415.2005.53521.x [Crossref]
- Elsawy B,
Higgins KE. Physical activity guidelines for older adults. Am Fam Physician
[Internet]. 2010 [cited 2021 Oct 5];81(1):55-9. Available from:
https://pubmed.ncbi.nlm.nih.gov/20052963/
- Eng JJ.
Fitness and mobility exercise program for stroke. Top Geriatr Rehabil 2010;26(4):310-23. doi: 10.1097/tgr.0b013e3181fee736 [Crossref]
- Jørgensen HS, Nakayama H, Raaschou HO, Olsen TS. Recovery of walking function in stroke patients: The Copenhagen stroke study. Arch Phys Med Rehabil 1995;76(1):27-32. doi: 10.1016/s0003-9993(95)80038-7 [Crossref]
- Billinger SA, Arena R, Bernhardt J, Eng JJ, Franklin BA, Johnson CM, et al. Physical activity and exercise recommendations for stroke survivors. Stroke 2014;45(8):2532-53. doi: 10.1161/str.0000000000000022 [Crossref]
- Gordon NF, Gulanick M, Costa F, Fletcher G, Franklin BA, Roth EJ, et al. Physical activity and exercise recommendations for stroke survivors. Stroke 2004;35(5):1230-40. doi: 10.1161/01.str.0000127303.19261.19 [Crossref]
- Ivey FM, Macko RF, Ryan AS, Hafer-Macko CE. Cardiovascular health and fitness after
stroke. Top Stroke Rehabil 2005;12(1):1-16. doi: 10.1310/geeu-yruy-vj72-lear
- Ovando AC, Michaelsen SM, Carvalho T, Herber V. Avaliação da aptidão cardiopulmonar em indivíduos com hemiparesia após acidente vascular encefálico. Arq Bras Cardiol 2011;96(2):140-7. doi: 10.1590/s0066-782x2011005000001 [Crossref]
- Severinsen K, Jakobsen JK, Pedersen AR, Overgaard K, Andersen H. Effects of resistance training and aerobic training on ambulation in chronic stroke. Am J Phys Med Rehabil 2014;93(1):29-42. doi: 10.1097/phm.0b013e3182a518e1 [Crossref]
- Lund C, Dalgas U, Grønborg TK, Andersen H, Severinsen K, Riemenschneider M, et al. Balance and walking performance are improved after resistance and aerobic training in persons with chronic stroke. Disabil Rehabil 2017;40(20):2408-15. doi: 10.1080/09638288.2017.1336646 [Crossref]
- Borschmann K, Pang MYC, Bernhardt J, Iuliano-Burns S. Stepping towards prevention of bone loss after stroke: a systematic review of the skeletal effects of physical activity after stroke. Int J Stroke 2011;7(4):330-5. doi: 10.1111/j.1747-4949.2011.00645.x [Crossref]
- Dobkin BH, Dorsch A. New evidence for therapies in stroke rehabilitation. Curr Atheroscler Rep 2013;15(6). doi: 10.1007/s11883-013-0331-y [Crossref]
- Marsden DL, Dunn A, Callister R, Levi CR, Spratt NJ. Characteristics of exercise training interventions to improve cardiorespiratory fitness after stroke. Neurorehabil Neural Repair 2013;27(9):775-88. doi: 10.1177/1545968313496329 [Crossref]
- Saunders D, Greig C, Young A, Mead G. Physical fitness training for stroke patients. Cochrane Database of Syst Rev 2016;3(3):CD003316. doi: 10.1002/14651858.cd003316 [Crossref]
- ATS Statement. Guidelines for the Six-Minute Walk Test. Am J Respir Crit Care Med 2002;166(1):111-7. doi: 10.1164/ajrccm.166.1.at1102 [Crossref]
- Podsiadlo D, Richardson S. The timed “Up & Go”: A Test of basic functional mobility for frail elderly persons. J Am Geriatr Soc 1991;39(2):142-8. doi: 10.1111/j.1532-5415.1991.tb01616.x [Crossref]
- Bambirra C, Magalhães L de C, Paula FR. Confiabilidade e validade do BESTest e do MiniBESTest em hemiparéticos crônicos. Rev Neurociências 2015;23(1):30-40. doi: 10.34024/rnc.2015.v23.8044 [Crossref]
- Hinsongkram B, Chaikeeree N, Saengsirisuwan V, Viriyatharakij N, Horak FB, Boonsinsukh R. Reliability and validity of the balance evaluation systems test (BESTest) in people with subacute stroke. Phys Ther 2014;94(11):1632-43. doi: 10.2522/ptj.20130558 [Crossref]
- Maia AC, Rodrigues-de-Paula F, Magalhães LC, Teixeira RLL. Cross-cultural adaptation and analysis of the psychometric properties of the Balance Evaluation Systems Test and MiniBESTest in the elderly and individuals with Parkinson's disease: application of the Rasch model. Braz J Phys Ther 2013;17(3):195-217. doi: 10.1590/S1413-35552012005000085 [Crossref]
- IBM Corp. Released 2012. IBM SPSS Statistics for
Windows, Version 21.0. Armonk, NY: IBM Corp.
- R Core Team. R: A language and environment for
statistical computing. R Foundation for Statistical Computing, Vienna, Austria.
2018. [cited 2021 Oct 7]. Available from: https://www.R-project.org/
- Madhavan S, Bishnoi A. Comparison of the Mini-Balance Evaluations Systems Test with the Berg Balance Scale in relationship to walking speed and motor recovery post stroke. Top Stroke Rehabil 2017;24(8):579-84. doi: 10.1080/10749357.2017.1366097 [Crossref]
- Noguchi K, Gel YR, Brunner E, Konietschke F. nparLD: An R Software Package for the Nonparametric Analysis of Longitudinal Data in Factorial Experiments. Journal of Statistical Software 2012;50(12):1-23. doi: 10.18637/jss.v050.i12 [Crossref]
- Powers SK, Howley ET. Fisiologia do exercício: teoria e aplicação aplicada ao
condicionamento e ao desempenho. São Paulo: Manole; 2000.
- Tiozzo E, Youbi M, Dave K, Perez-Pinzon M, Rundek T, Sacco RL, et al. Aerobic, resistance, and cognitive exercise training poststroke: figure. Stroke 2015;46(7):2012–6. doi: 10.1161/strokeaha.114.006649 [Crossref]
- Stoller O, Bruin ED, Knols RH, Hunt KJ. Effects of cardiovascular exercise early after stroke: systematic review and meta-analysis. BMC Neurology;12(1). doi: 10.1186/1471-2377-12-45 [Crossref]
- Mayo NE, Wood-Dauphinee S, Côté R, Durcan L, Carlton J. Activity, participation, and quality of life 6 months poststroke. Arch Phys Med Rehabil 2002;83(8):1035-42. doi: 10.1053/apmr.2002.33984 [Crossref]
- Patel AT, Duncan PW, Lai S-M, Studenski S. The relation between impairments and functional outcomes poststroke. Arch Phys Med Rehabil 2000;81(10):1357-63. doi: 10.1053/apmr.2000.9397 [Crossref]
- Wist S, Clivaz J, Sattelmayer M. Muscle
strengthening for hemiparesis after stroke: A meta-analysis. Ann Phys Rehabil Med 2016;59(2):114–24. doi: 10.1016/j.rehab.2016.02.001 [Crossref]
- Boyne P, Welge J, Kissela B, Dunning K. Factors influencing the efficacy of aerobic exercise for improving fitness and walking capacity after stroke. Arch Phys Med Rehabil 2017;98(3):581-95. doi: 10.1016/j.apmr.2016.08.484 [Crossref]
- Miyamoto ST, Lombardi Junior I, Berg KO, Ramos LR, Natour J. Brazilian version of the Berg balance scale. Braz J Med Biol Res 2004;37(9):1411-21. doi: 10.1590/s0100-879x2004000900017 [Crossref]