ARTIGO
ORIGINAL
Imobilização
de músculos esqueléticos de ratos desnutridos
Skeletal muscle immobilization in malnourished rats
Marcos Fábio de
Abreu, M.Sc.*, Daiane Cristofoletti*, Bruno Ferreira
Gonçalves e Silva**, Carlos Alberto da Silva, D.Sc.***
*Programa
de Pós-Graduação em Fisioterapia (PPG Ft, UNIMEP) Piracicaba, **Graduando em
medicina veterinária (UNIP Campinas), ***Professor do Programa de Pós-graduação
em Fisioterapia UNIMEP, Piracicaba/SP
Recebido em 12 de
agosto de 2015; aceito em 20 de fevereiro de 2016.
Endereço
de correspondência:
Carlos Alberto da Silva, Universidade Metodista de Piracicaba, Faculdade de
Ciências da Saúde - PPG-FT, Rodovia do Açúcar, Km 156 Campus Taquaral,
13400-901 Piracicaba SP, E-mail: casilva@unimep.br
Resumo
Introdução: Muitos estudos são
realizados no intuito de aprimorar metodologias de tratamento fisioterapêutico,
no entanto não se considera o estado nutricional do paciente, mesmo sabendo que
a desnutrição, principalmente a proteico calórica, causa danos irreversíveis ao
organismo. A imobilização é uma prática terapêutica utilizada rotineiramente
por diversos profissionais frente a lesões músculo
esqueléticas. Objetivo:
Analisar o efeito da imobilização (7 dias) em ratos
normais (dieta normoproteica, 45 dias) e desnutridos (dieta hipoproteica, 45
dias). Material e métodos: Os animais
foram imobilizados com órtese de acrílico mantendo o tornozelo na posição de
90º. Para o período de remobilização, consideraram-se 7
dias após a retirada da órtese. Foi realizada a avaliação do conteúdo de
glicogênio e a razão proteína total/DNA segundo kit de aplicação laboratorial e
os dados foram comparados através de Anova Two Way e pós-teste de Tukey, p <
0,05. Resultados: Foram observadas
pequenas reservas glicogênicas tanto no grupo imobilizado quanto no grupo
desnutrido antes e após a imobilização. Cabe ressaltar que na remobilização do
grupo controle houve recuperação parcial das reservas, fato que não ocorreu no
grupo desnutrido. Conclusão: A
desnutrição causa um déficit no sistema músculo esquelético sendo acentuado na
imobilização, possivelmente por haver também comprometimento nos processos de
regeneração.
Palavras-chave: desnutrição,
imobilização, atrofia muscular, glicogênio, ratos.
Abstract
Introduction: Many studies are performed in order to improve methods of physical
therapy treatment, but do not consider the nutritional status of the patient,
knowing that malnutrition, especially protein caloric, causes irreversible
damage to the body. Immobilization is a therapeutic practice routinely used by
many professionals to treat musculoskeletal disorders. Objective: The aim of this study was to analyze the effect of
immobilization (7 days) in normal (normal diet, 45 days) and malnourished
(low-protein diet, 45 days) rats. Methods:
The animals were immobilized with acrylic splint maintaining the ankle at 90°.
As remobilization period was considered 7 days after removal of the stent. We
conducted the evaluation of glycogen content and the ratio total protein/DNA
according to laboratory kit and laboratory data were compared using Two Way Anova and Tukey post-test, p < 0.05. Results: Results showed small glycogen
reserves in both the fixed and in the malnourished group before and after
immobilization. In the remobilization in the control group, there was a partial
recovery of reserves, which did not occur in the malnourished group. Conclusion: Malnutrition causes a
deficit in the musculoskeletal system which is accentuated during
immobilization and may be compromised in the process of regeneration.
Key-words:
malnutrition, immobilization, muscle atrophy, glycogen, rats.
Introdução
Muitos estudos são
realizados na fisioterapia em busca de melhores resultados para cada
tratamento, porém não se considera o estado nutricional do paciente. Contudo
dever-se-ia levar em consideração o estado nutricional, haja vista que a
desnutrição, principalmente a proteico calórica, pode causar danos
irreversíveis ao organismo [1-4].
A desnutrição
proteica calórica, segundo a Organização Mundial da Saúde (OMS), é como uma
variedade de condições patológicas decorrente das deficiências de energia e
proteínas em proporções variadas, sendo ela uma das principais causas de
mortalidade infantil no Brasil. Isso se dá devido à nutrição proteica estar relacionada a funções importantes como formação de enzimas,
anticorpos, hormônios, equilíbrio ácido básico, transporte de oxigênio,
coagulação do sangue e atividade muscular [5-7].
Assim, a desnutrição
afeta o crescimento e desenvolvimento orgânico do sistema nervoso resultando em
menor tamanho cerebral, menor número de células, menor quantidade de lipídios,
redução da mielina e alterações na atividade de vários sistemas enzimáticos
[8-10].
Na imobilização
musculoesquelética, observam-se alterações representadas pela perda funcional
acompanhada de perda de massa muscular [11]. A atrofia do músculo esquelético
decorrente da imobilização ocorre pela diminuição da síntese e consequentemente
aumento na degradação proteica, associado ao aumento do tecido conectivo,
fatores associados que induzem o comprometimento funcional [12,13]. Os estudos
dos efeitos metabólicos locais e sistêmicos da imobilização se revestem de
grande importância por fornecer as informações necessárias para a compreensão e
intervenção terapêutica nas situações de privação da mobilidade de partes do
corpo merecendo destaque as entorses, fraturas ósseas, rupturas ligamentares,
tendíneas e de outros tecidos moles [14,15].
Objetivo
Avaliar o
comportamento metabólico do músculo esquelético remobilizado após 7 dias de imobilização em ratos controle e desnutridos.
Material
e métodos
Foram utilizados 36
ratos albinus, Wistar, com 21 dias de
idade, divididos em grupos experimentais e tratados com dieta normoproteica ou
hipoproteica durante 45 dias. Os animais foram alimentados com dieta especial e
água ad libitum e mantidos em ambiente
com temperatura constante ao redor de 23oC ± 2oC e
ciclo claro escuro controlado de 12 h, manejados de acordo com o guia de
tratamento de animais de laboratório do National Research Council, 1996 e
aprovado pelo CEUA – UNIMEP sob nº 09/2015.
Tabela I – Distribuição dos ratos em grupos
experimentais (n = 6).

Imobilização
A imobilização foi
realizada utilizando uma órtese de resina acrílica, a qual manteve a
articulação do tornozelo em posição de 90 o, permitindo que as articulações do
joelho e quadril permanecessem livres conforme modelo descrito por Silva et al. [12]. Consideramos os períodos experimentais como
sendo períodos agudos, pois Von Deutsch et al. [16]
relataram que até 7 dias de imobilização ainda é considerado dessa forma. Neste
sentido, como protocolo de remobilização, os animais tiveram a órtese retirada
locomovendo-se livremente pela caixa.
Protocolo
de desnutrição e recuperação nutricional
Durante o experimento
foram empregadas dietas normoproteica (AN 93M - 14%) e hipoproteica (AN - 6%)
comercializada pela PragSoluções Serviços e Comércio;
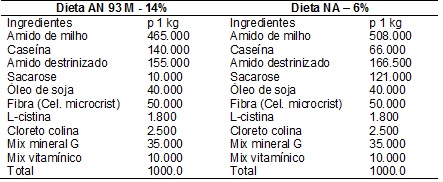
(composição descrita na tabela II).
Tabela
II -
Composição das dietas (g/kg) utilizadas
para desnutrição sendo AN93 M -14% normoproteica e AN-6% hipoproteica.
Para a determinação
do conteúdo muscular de glicogênio foi utilizado o método do fenol sulfúrico
segundo Siu et al.[17]. Os valores foram expressos em mg/100 mg de peso úmido. Para determinação do conteúdo de
proteínas totais, foi utilizado o método do biureto e os valores são expressos
em mg/mL, por sua vez, para a determinação da
concentração de DNA foi utilizado o método da difenilamina em que o homogenato
tecidual é submetido à presença de uma solução de difenilamina e posteriormente
a leitura realizada em espectrofotômetro no comprimento de onda de 595 nm
segundo o método proposto por Giles e Myers [18]. Na análise estatística foi
aplicado o teste de normalidade (Kolmogorov-Smirnov) seguido da análise
variância (Anova) e teste de Tukey, com nível de significância de 5%.
Figura
1 - Em (A) observa-se a órtese de resina
acrílica composta de uma bota de acrílico, rotadores e cinta abdominal
aplicados em rato controle (tratado 45 com dieta contendo 14% de proteína). Em
(B) pode-se observar a órtese adaptada ao corpo do rato desnutrido (tratado com
dieta contendo 6% de proteína por 45 dias). Cabe ressaltar que a órtese manteve
a articulação do tornozelo na posição de 90º.

Resultados
Apresenta-se
inicialmente uma fotografia dos animais controle e desnutridos imobilizados
pela órtese, para que sejam observadas as condições orgânicas diferenciais,
principalmente no que se refere ao animal desnutrido (figura 1).
Um consenso na
literatura científica é que a reserva muscular de glicogênio é imprescindível
para a manutenção de condições energéticas ideais determinando a eficiência da
contração muscular. Inicialmente foi avaliado o comportamento das reservas
glicogênicas no grupo controle no qual se destaca que o músculo sóleo (fibra
tipo I), apresentou diminuição significativa de 36% nas reservas em decorrência
da imobilização. Cabe ressaltar que após o período de remobilização de 7 dias, as reservas glicogênicas ainda apresentavam-se 21%
menores do que o controle, porém recuperadas em 22% se comparado ao grupo imobilizado
( figura 2).
Alterações nas
reservas glicogênicas também foram constatadas no músculo gastrocnêmio porção
branca e vermelha, além disso, foi observada diminuição das reservas em 49% e
42 %, respectivamente. Nestes músculos, também houve recuperação das reservas
no período de remobilização atingindo valores 26% e 30%, se comparado ao
imobilizado e da mesma forma que no sóleo ainda permaneceram 31% e 17% menores
que o controle (figura 2).
A seguir foi avaliado
o efeito da desnutrição sobre as reservas glicogênicas, e observou-se que as
reservas apresentaram-se 28,5% menores no sóleo, 56,4% no gastrocnêmio porção
branca e 58,3% no gastrocnêmio vermelho se comparado ao grupo tratado com dieta
normoproteica. Quando imobilizados, as reservas glicogenias tornaram-se ainda menores atingindo valores 35% menores no sóleo e no
gastrocnêmio porção branca e 53% no gastrocnêmio vermelho. Por outro
lado, o evento mais expressivo foi observado na remobilização, condição em que
não foi observada recuperação, não diferindo da condição imposta pelo desuso
(figura 3).
Figura
2 - Concentração muscular de glicogênio (mg/100mg) do músculo sóleo (S), gastrocnêmio porção branca
(GB) e gastrocnêmio porção vermelha (GV) nas condições controle (C),
imobilizado (I) e remobilizado (R). Os valores correspondem a
média ± epm, n = 10.
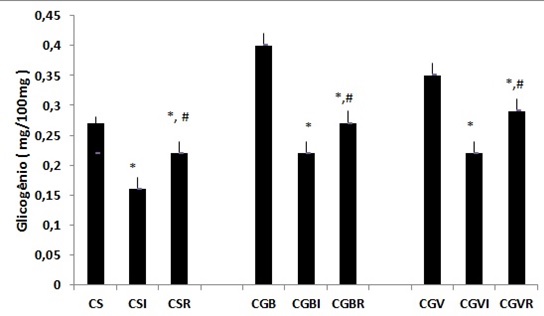
*p < 0,05 comparado ao controle e # p < 0,05 comparado ao
imobilizado.
Figura
3 - Concentração muscular de glicogênio (mg/100mg) do músculo sóleo (S), gastrocnêmio porção branca
(GB) e gastrocnêmio porção vermelha (GV) nas condições desnutrido (D),
imobilizado (I) e remobilizado (R). Os valores correspondem a
média ± epm, n = 10.
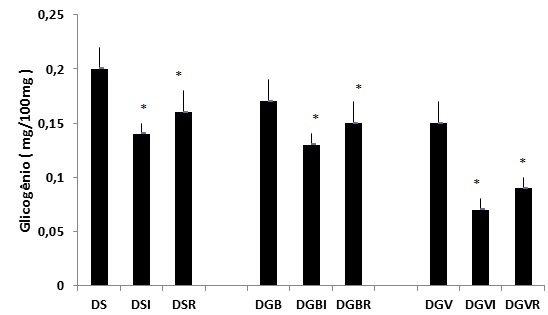
*p < 0,05 comparado ao controle.
Passou-se
à avaliação
do peso muscular, sendo escolhido o sóleo devido a melhor
delimitação
anatômica. Nesta condição, observou-se
redução de 36% em decorrência da
imobilização, havendo recuperação de 24% no
peso na fase da remobilização. O
peso foi alterado também na desnutrição,
apresentou-se 69% menor do que do
grupo tratado com dieta normoproteica. Na condição de
imobilização aplicada na
desnutrição foi observada redução de 27%
devido à imobilização e recuperação
de
11% na fase de remobilização (tabela III).
No intuito de
aprimorar a análise, optou-se por avaliar a relação proteína total/DNA
(PT/DNA), observando-se que a imobilização no grupo controle promoveu redução
de 25,2% com elevação de 10% no período de remobilização. Por sua vez, a
relação PT/DNA determinada no grupo desnutrido mostrou-se 52% menor se
comparado ao controle. Nesta condição a imobilização promoveu redução de 14% na
relação a condição não imobilizado e, ainda, houve
recuperação de 6% na fase de desmobilização (tabela III).
Tabela
III
- Peso (mg) e
relação Proteína Total/DNA (PT/DNA, mg/100mg) no sóleo de ratos controle e
desnutridos submetidos a imobilização e remobilização.

Os valores
correspondem à média ± DP, n = 6; *p < 0,05 comparado ao controle; #p <
0,05 comparado ao imobilizado, ?p < 0,05 comparado ao desnutrido.
Discussão
O músculo esquelético
é um dos principais tecidos ligados ao controle glicêmico por apresentar
mecanismos responsáveis pela captação, metabolização e reserva de glicose. Esta
capacidade decorre da expressão gênica de transportadores do tipo 1 (Glut1) envolvido na captação basal da glicose e
transportadores do tipo 4 (Glut4) cuja atividade mostra ser dependente da
insulina e do aumento na atividade contrátil [19,20]. Cerca de 70 a 85% da
glicose captada é direcionada a formação de reservatórios de glicogênio ou pode
ainda ser oxidada para geração de energia [21]. Neste contexto, destaca-se que
as reservas musculares de glicogênio são uma importante fonte de energia
durante a atividade contrátil. Desta forma, flutuações no conteúdo, podem
interferir no desempenho, ou seja, concomitante a elevação nas reservas
observa-se melhora na resistência durante atividade física, porém, em pequenas
quantidades participam dos processos associados à fadiga muscular [22].
Hirose et al. [23] estudaram a via sinalizadora
da insulina em ratos que tiveram a pata imobilizada por fixação do joelho e
tornozelo a 90o, durante sete dias, e verificaram redução na transdução do
sinal insulínico, sugerindo déficit na ativação do receptor e nas enzimas
ativadas a partir deste, incluindo a fosforilação do IRS-1 (substrato 1 do
receptor de insulina) e a ativação da PI3-K, demonstrando que o quadro de
resistência à insulina, também pode ser desencadeado na imobilização. Essa
alteração na dinâmica de sinalização da insulina pode explicar os resultados
deste estudo, no qual foi observado que, sob condição
aguda de imobilização, houve redução nas reservas musculares de glicogênio.
O presente estudo
mostra que, no músculo sóleo, houve redução significativa no conteúdo de
glicogênio somente a partir do segundo dia do desuso. Neste sentido, Ploug
[24], estudando o comportamento metabólico de músculos vermelhos submetidos a
um curto período de imobilização (48 horas) verificaram diminuição
significativa na população dos transportadores Glut1 e Glut4 além da redução na
atividade das vias glicogênicas e sugeriram o desenvolvimento do quadro de
resistência no desuso. Ainda com relação às reservas musculares de glicogênio,
demonstramos que no músculo gastrocnêmio porção branca (fibra tipo II), houve a
maior redução no conteúdo se comparado ao sóleo (fibras tipo I). Neste sentido,
há de se considerar que a órtese permitia a descarga de peso no membro
imobilizado e este fato pode ter contribuído para a diferenciação do efeito se
comparar ao músculo sóleo, uma vez que é um músculo postural. Assim, os dados
deste estudo corroboram a literatura referendando que a órtese aqui utilizada
como modelo de imobilização mostrou ser um modelo gerador de resistência à
insulina comprometendo a homeostasia das vias metabólicas das fibras
musculares.
Entre os anos 70 e
80, havia contradição quanto ao tipo de fibras mais susceptíveis à hipotrofia:
alguns autores sugeriam que as fibras brancas (tipo II) eram mais susceptíveis
[25], enquanto outros se referiram às fibras vermelhas (tipo I) como sendo as
mais susceptíveis [26]. No entanto, há trabalhos que não evidenciaram qualquer
diferença no comportamento dos diferentes tipos de fibras à hipotrofia [27,28].
Em 1986, Appell [29] verificou que o decréscimo mais pronunciado do diâmetro
das fibras ocorre durante a primeira semana de imobilização e em estudos
realizados com animais e com tempos de imobilização variáveis, foi demonstrado
que as fibras tipo I foram as que apresentaram sinais mais evidentes de
hipotrofia, sugerindo que tal fato ocorre devido à redução da atividade das
enzimas oxidativas como reiterado por [30]. Neste sentido, os diferentes
trabalhos se diferenciam quanto ao período de desuso avaliado e nossos
resultados mostram que já existem alterações significativas desencadeadas
precocemente, ou seja, nos primeiros dias do desuso. Cabe salientar que a
homeostasia energética do músculo gastrocnêmio branco já ficou comprometida nos
primeiros dias da imobilização
A escolha de
direcionar o estudo à posição do tornozelo a 90º se deve ao fato de ser a
posição anatômica mais utilizada na clínica ortopédica e também pela existência
de trabalhos que mantiveram o tornozelo imobilizado nessa posição. Nestes
trabalhos, as articulações do quadril e joelho também estavam imobilizadas,
diferenciando de nossa proposta na qual a articulação do joelho e quadril se
mantiveram livres [23,24,31]. Dentro destas
considerações, a órtese foi capaz de promover na musculatura, alterações
metabólicas e na taxa proteína total/DNA indicando o desenvolvimento de
proteólise, uma vez que esta relação serve como índices de tamanho celular.
Recentemente
Herrera et al. [32] estudaram a inatividade
muscular em membros posteriores de ratos e observaram que o músculo sóleo
sofreu hipotrofia mais evidente que o músculo extensor longo dos dedos,
apontando a provável relação com o tipo de fibra e função muscular durante a
condição normal de descarga de peso. Tanaka et al.
[33] também associaram o tipo de fibras ao grau de hipotrofia muscular, e como
o sóleo possui um maior número de fibras tipo I e o extensor longo dos dedos
mais fibras do tipo II, o primeiro músculo sofre mais durante a imobilização,
devido à menor solicitação das fibras posturais [24].
Dentro
desta linha de
raciocínio, observamos que o músculo gastrocnêmio
porção branca foi o mais
afetado pela imobilização e possivelmente deve-se ao fato
de ser bi-articular e
neste modelo de desuso, apresentar limitação na sua
condição fisiológica.
Assim, por haver descarga de peso, o músculo sóleo
recebia estímulo constante
enquanto o animal deambulava. Uma vez que tem sido descrito que frente
à
elevação da atividade contrátil há
elevação na captação de glicose decorrente
da translocação de transportadores Glut4, é
sugestivo o fato que o sóleo
adquire um status energético diferenciado dos outros
músculos, razão pela qual
os dados diferem do consenso presente na literatura.
Concomitante ao
comprometimento das reservas energéticas, a relação proteína total/DNA muscular
também foi comprometida pela imobilização do membro, sendo significativa a
partir do 2º dia e com especificidade no músculo gastrocnêmio porção branca,
reiterando que dentro da especificidade deste modelo de imobilização as fibras
brancas foram afetadas precocemente.
Conclusão
O
estudo mostra a
importância em se considerar o estado nutricional do paciente,
pois esse pode
influenciar na eficiência terapêutica. Conforme
demonstrado, a imobilização
promove dano estrutural e funcional em maior intensidade se houver o
quadro de
desnutrição, já que nesta condição
há comprometimento na recuperação do tecido
lesado.
Referências
- Crace CJ, Swenne
I, Khon PG, Strain J, Milner RDG. Protein energy
malnutrition induces changes in insulin sensitivity. Diabetes Metabolism 1995;16:484-91.
- Monte CMG. Desnutrição:
um desafio secular à nutrição
infantil Undernourishment: a century old challenge to
infant nutrition. J Pediatr 2000;76
(Supl3):S285-S97.
- Galdino R, Mello MAR,
Almeida RL, Almeida CCS. Desnutrição proteico-calórica. In: Dâmaso A, ed.
Nutrição e exercício na prevenção de doenças. Medsic 2001;1:225-75.
- Lima AM, Gamallo SMM,
Oliveira FLC. Protein-energy malnutrition during hospital stay:
physiopathology and treatment. Rev Paul Pediatr 2010;28(3):353-61.
- Neiva CM, Guerino MR,
Mello MAR. Análise dos efeitos da desnutrição
proteico-calórica sobre as respostas ao exercício agudo (single section)
parâmetros metabólicos. Motriz 1999;1(1):32-43.
- Levitasky DA, Strupp BJ. Malnutrition and the brain: changing concepts,
changing concerns. J Nutr Bethesda 1995;125: 2212-20.
- Fraga JAA, Varela SS. The relationship between malnutrition and child development.
Rev
Assoc Bras Nutr 2012;4(5):59-62.
- Moysés APA, Lima GZ.
Fracasso escolar, um fenômeno complexo: Desnutrição apenas mais um fator. Pediatr (São Paulo) 1983;5(4):263-9.
- Morgane PJ, Mokler DJ, Galler
JR. Effects of prenatal protein malnutrition on the hipocampal
formation. Neurosci
Biobehav Rev 2002;26:471-83.
- Lukoyanov NV, Andrade JP.
Behavioral effects of protein deprivation and rehabilitation in adult rats:
relevance to morphological alterations in the hippocampal formation. Behav Brain Res 2000;112(1-2):85-97.
- Brito VC, Oliveira BDR, Moraes SRA. Effects of
immobilization on rat skeletal muscle tissue. J
Morphol Sci 2011;28(4):217-21.
- Silva CA, Guirro RRJ,
Polacow MLO, Durigan JLQ. Proposal for rat hindlimb joint immobilization: orthosis with acrylic resin
model. Braz
J Med Biol Res 2006;39:979-85.
- Polizello JC,
Carvalho LC, Freitas FC, Padula N, Martinez EZ, Mattiello-Sverzut AC. Morphological effects of resumption of loading after immobilization of
skeletal muscles in lengthened position in female rats. Rev Bras Fisioter 2011;15(1):73-9.
- Durigan JLD, Polacow
MLO, Silva CA, Guirro RRJ. Modelos de desuso muscular e estimulação elétrica
neuromuscular: aspectos pertinentes à reabilitação. Fisioter Mov 2005;18(4):53-62.
- Oliveira PD, Gomes
CRG, Oliveira RF, Pires-Oliveira DAA, Bertolini SMMG. Histomorphometric alterations of muscle soleus provoked by drawn out immobilization:
experimental study with Wistar lineage rats. Fisioter Mov 2015;28(2):289-95.
- Von Deutsch DA, Abukhalaf IK, Wineski LE, Silvestrov NA, Bayorh MA, Potter DE. Changes in muscle proteins and
spermidine content in response to unloading and clenbuterol
treatment. Can J Physiol Pharmacol
2003;81(1):28-39.
- Siu LO, Russell JC, Taylor AW. Determination of glycogen in small tissue samples.
J Appl Physiol 1970;28(2):234-36.
- Giles KW, Myers K. An improved diphenylamine method
for the estimation of deoxyribonucleic acid. Nature 1965;206(4979):93-4.
- Kern MJ, Wells JA, Stephens JM, Elton CW, Friedman J, Tapscott EB et al. Insulin responsiveness in skeletal
muscle is determinate by glucose transporter (GLUT 4) protein level. Biochem J 1990;270:397-400.
- Machado UF, Beatriz
D, Schaan BD, Seraphim PM. Glucose transporters in the metabolic syndrome. Arq Bras Endocrinol
Metab 2006;50(2):177-89.
- Henriksen EJ, Holloszy JO. Effects of phenylarsine
oxide on stimulation of glucose transport in rat skeletal muscle. Am J Physiol 1990;258(4 Pt
1):C648-C653.
- Sesti G. Pathophysiology of insulin resistance. Best Pract Res Clin
Endocrinol Metab 2006;20(4):665-79.
- Hirose M, Kaneki M,
Sugita H, Yasuhara S, Martyn JA. Immobilization
depresses insulin signaling in skeletal muscle. Am J Physiol
Endocrinol Metab 2000;279(6):1235-41.
- Ploug T, Ohkuwa
T, Handberg A, Vissing J, Galbo H. Effect of immobilization on glucose transport and
glucose transporter expression in rat skeletal muscle. Am J Physiol
Endocrinol Metab 1995;268:E980-6.
- MacDougall JD, Elder GC, Sale DG, Moroz JR,
Sutton JR. Effects of strength training and immobilization on human muscle
fibers. Eur J Appl Physiol 1980;43:25-34.
- Booth FW, Seider MJ. Recovery
of skeletal muscle after 3 mo. of hindlimb
immobilization in rats. J Appl Physiol 1979;47(2):435-9.
- Williams PE, Goldspink G. Changes in sarcomere
length and physiological properties of immobilized muscle. J Anat (London) 1978;127:459-68.
- Williams PE, Goldspink G. Connective tissue
changes in immobilized muscle. J Anat 1984;138:343-504.
- Appell HJ. Muscular
atrophy following immobilization. Sports Med 1990;7:42-58.
- Alves AP, Dâmaso AR,
Pai VD. The effects of
prenatal and postnatal malnutrition on the morphology, differentiation, and
metabolism of skeletal striated muscle tissue in rats. J Pediatr 2008;84(3):264-71.
- Qin L, Appell HJ, Chan KM, Maffulli
N. Electrical stimulation prevents immobilization atrophy in skeletal muscle of
rabbits. Arch Phys Med Rehabil 1997;78:512-7.
- Herrera NM, Zimmerman AN, Dykstra DD, Thompson LV. Clenbuterol
in the prevention of muscle atrophy: a study of hindlimb-unweighted
rats. Arch Phys Med Rehabil 2001;82(7):930-34.
- Tanaka T, Kariya Y, Hoshino Y. Histochemical
study on the changes in muscle fibers in relation to the effects of aging on
recovery from muscular atrophy caused by disuse in rats. J
Orthop Sci 2004;9(1):76-85.