Fisioter Bras 2022;23(2):319-31
REVISÃO
Reabilitação em pacientes
onco-hematológicos pediátricos e sua relação com a cardiotoxicidade induzida pela quimioterapia
Rehabilitation in pediatric oncohematological
patients and its relationship to chemotherapy-induced cardiotoxicity
Thatyane Soares Souza de Oliveira, Ft.*, Tito
Lívio Cardoso Barreto**
*Hospital da Criança de
Brasília José Alencar, Brasília, DF, **Hospital de Base (SMHS), Brasília, DF
Recebido em 4 de agosto de
2021; Aceito em 17 de janeiro de 2022.
Correspondência: Thatyane
Soares Souza de Oliveira, Rua 37 Norte, Lote 02, Bloco B/1309, Residencial San
Lorenzo 71919360 Águas Claras, Brasília DF, E-mail: thatyssouza@gmail.com
Thatyane Soares Souza de
Oliveira: thatyssouza@gmail.com
Tito Lívio
Cardoso Barreto: titoliviocardoso@outlook.com
Resumo
Objetivo: Apresentar os efeitos da reabilitação
em pacientes onco-hematológicos pediátricos e
analisar se os protocolos de reabilitação interferem na cardiotoxicidade
induzida pela quimioterapia. Métodos: Foi realizada uma revisão de
literatura integrativa utilizando os descritores: “câncer”, “child”, “cardiotoxicity”, “rehabilitation” e “exercise
training”. As seguintes bases de dados foram utilizadas: Scientific
Eletronic Library (Scielo), National
Library of Medicine (Pubmed),
Biblioteca Virtual em Saúde (Medline) eSpringer
Nature (Springer Link). Foram definidos como
critério de inclusão, artigos publicados entre os anos de 2008 a 2020. Foram
excluídos os artigos de cânceres exclusivamente não hematológicos. Resultados:
Foram selecionados 10 artigos e verificou-se que o exercício físico aplicado em
cânceres hematológicos em crianças é benéfico no que tange aos efeitos
colaterais das doenças e do tratamento. Apresentou efeitos positivos na
capacidade funcional muscular e cardiorrespiratória; melhora da sensação de
fadiga e qualidade de vida; e ganhos na aptidão física, composição corporal e
saúde óssea. Conclusão: A implementação de programas de exercícios são
eficazes e fazem um diferencial na manutenção e melhora da qualidade de vida
dos pacientes oncológicos infantis. São necessários mais estudos na área de
reabilitação em onco-hematologia pediátrica,
sobretudo relacionada às complicações resultantes da cardiotoxicidade.
Palavras-chave: câncer; criança; cardiotoxicidade;
exercício físico.
Abstract
Objective: To present the effects of rehabilitation in
pediatric onco-hematological patients and analyze whether rehabilitation
protocols interfere with chemotherapy-induced cardiotoxicity. Methods:
An integrative literature review was carried out using the descriptors:
“cancer”, “child”,
“cardiotoxicity”, “rehabilitation” and
“exercise training”.
The following databases were used: Scientific Electronic Library (Scielo), National Library of Medicine (Pubmed),
Virtual Health Library (Medline) and Springer Nature (Springer Link). Articles
published between 2008 and 2020 were defined as inclusion criteria. Articles on
exclusively non-hematological cancers were excluded. Results: 10
articles were selected and it was found that physical exercise applied to
hematological cancers in children is beneficial with regard to the side effects
of diseases and treatment. Physical exercise had positive effects on functional
muscle and cardiorespiratory capacity; improvement in the feeling of fatigue
and quality of life; and gains in physical fitness, body composition, and bone
health. Conclusion: The implementation of exercise programs is effective
and make a difference in maintaining and improving the quality of life of
childhood cancer patients. More studies are needed in the area of rehabilitation
in pediatric onco-hematology, especially related to complications resulting
from cardiotoxicity.
Keywords: cancer; child; cardiotoxicity; exercise.
Introdução
O câncer
infantojuvenil (entre 0 e 19 anos) possui majoritariamente origem embrionária
e, comumente, afeta as células do sistema sanguíneo e os tecidos de
sustentação, com características específicas em relação à histopatologia
e ao comportamento clínico [1].
As
neoplasias hematológicas fazem parte de um grupo diverso de doenças que afetam
as células progenitoras hematopoiéticas da medula óssea, tais como: Leucemias,
Linfomas e Síndromes Mielodisplásicas (SMD) [2].
Aproximadamente
1/4 das crianças e adolescentes acometidos de câncer sobrevivem mais de 30 anos
após o diagnóstico e possuem altas taxas de cura chegando a aproximadamente 80%
em determinadas neoplasias hematológicas [3,4]. Esses tumores apresentam
elevada sensibilidade à quimioterapia (QT) e radioterapia. O Transplante de
Células-Tronco Hematopoiéticas (TCTH) associado a altas doses de QT é também
uma alternativa de tratamento, porém, os grandes resultados alcançados devem-se
também ao tratamento multidisciplinar adequado [4,5].
Contudo,
os medicamentos utilizados também apresentam efeitos maléficos aos sistemas
orgânicos [3], causando complicações tardias, ocorrendo meses ou anos após o
diagnóstico ou tratamento [6].
Os
efeitos tóxicos da QT estão ligados à destruição de células saudáveis do
organismo. Dentre eles, temos a cardiotoxicidade,
considerada uma das complicações mais graves em decorrência do tratamento. Esta
é a condição nas quais agentes externos (químicos ou físicos) influenciam, de
forma negativa no coração, ocasionando mudanças estruturais, elétricas e
funcionais no miocárdio [7]. Caracteriza-se pelo aumento gradativo da
frequência cardíaca, pressão arterial sistólica diminuída, edema periférico e
veia jugular ingurgitada [8], bem como a disfunção ventricular esquerda,
miocardite, arritmias, pericardite, insuficiência cardíaca, isquemia
miocárdica, dor torácica e outros [3].
A
detecção da cardiotoxicidade se dá através de
biomarcadores (peptídeo natriurético cerebral e as troponinas) e recursos
ecocardiográficos. Esses marcadores ajudam a identificar lesão miocárdica e
podem sinalizar o desenvolvimento de disfunção ventricular em pacientes que
receberam doses elevadas de quimioterápicos [9]. Além disso, existem alguns
testes capazes de avaliar o condicionamento cardiovascular, que podem auxiliar
na avaliação, dentre eles o teste ergométrico (esforço máximo) e teste de
caminhada de 6 minutos (esforço submáximo).
Considerando
um tratamento multidisciplinar, a fisioterapia executa um papel de grande
importância no auxílio ao paciente com doenças onco-hematológicas.
São realizadas técnicas e exercícios físicos específicos que objetivam a
estabilização e/ou melhora das capacidades funcionais, bem como a prevenção e
tratamento de comorbidades que afetam a capacidade de locomoção e outras
complicações do tratamento clínico, dentre essas, os efeitos da cardiotoxicidade [2].
Portanto,
o objetivo deste estudo é apresentar os efeitos da reabilitação em pacientes onco-hematológicos pediátricos e analisar se os protocolos
de reabilitação interferem na cardiotoxicidade
induzida pela quimioterapia.
Métodos
Este
estudo consiste de uma revisão da literatura integrativa a respeito da
reabilitação de pacientes onco-hematológicos
pediátricos e sua relação com a cardiotoxicidade
induzida pela QT. A coleta de dados foi realizada no período de 20 de junho a
21 de julho de 2020. Foram incluídos trabalhos publicados do tipo estudo de
coorte, ensaios clínicos e demais artigos com ênfase na população pediátrica,
excluindo os estudos de caso.
As
seguintes bases de dados foram utilizadas: Scientific
Eletronic Library (Scielo), National
Library of Medicine (Pubmed),
Biblioteca Virtual em Saúde (Medline) eSpringer
Nature (Springer Link). Foram definidos como
critério de inclusão, artigos publicados entre os anos de 2008 e 2020, com os
seguintes descritores: “câncer”, “child”,“cardiotoxicity”, “rehabilitation” e “exercise
training”. Não foram utilizados limitadores quanto ao idioma. Foram excluídos
os artigos de cânceres exclusivamente não hematológicos.
Foram
encontrados 65 artigos, dos quais foram selecionados apenas 10 estudos
específicos, que realizaram intervenção através de programas de exercícios
físicos em crianças.
Resultados
Abaixo
segue a Tabela I que relaciona os principais estudos encontrados que realizaram
intervenção com exercício físico no tratamento de pacientes onco-hematológicos
pediátricos.
Tabela I - Estudos relacionados a exercício fisico em pacientes onco-hematológicos
pediátricos
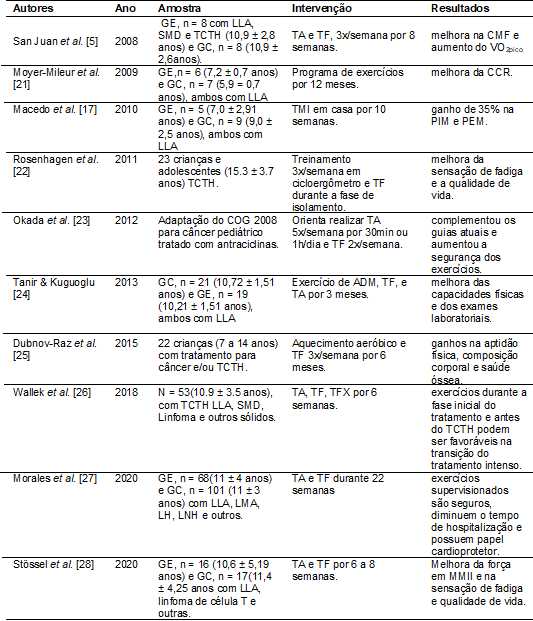
ADM =
Amplitude de movimento; CCR = Capacidade cardiorrespiratória; CMF = Capacidade
muscular funcional; COG = Children’s Oncology Group; FCmáx = Frequência cardíaca máxima; FCR = Frequência
cardíaca de reserva; MMII = Membros inferiores; GC = Grupo controle; GE = Grupo
experimental; LH = Linfoma Hodgkin; LLA = Leucemia linfoblástica
aguda; LMA = Leucemia mielóide
aguda; LNH = Linfoma
Não-Hodgkin; LV = Limiar ventilatório; MF = Mobilidade
funcional; PEM = Pressão
expiratória máxima; PIM = Pressão
inspiratória máxima; SMD = Síndromes
mielodisplásicas;
TA = Treinamento aeróbico; TCTH = Transplante de
células-tronco
hematopoiéticas; TF = Treinamento de força; TFX =
Treinamento de flexibilidade;
TMI = Treinamento muscular inspiratório
Discussão
O
tratamento de câncer com os quimioterápicos conhecidos como antraciclinas
(AC) faz parte de mais da metade dos protocolos de tratamento em neoplasias
pediátricas e estão continuamente relacionadas ao surgimento de cardiotoxicidade [10]. Dentre as AC, a doxorrubicina
(DOX) e daunorrubicina tornaram-se comuns na terapia
para diversas neoplasias pediátricas [11]. ADOX está entre os agentes
antineoplásicos mais eficazes utilizados em grande parte dos pacientes com
câncer infantil [12,13].
É
possível classificar a cardiotoxicidade em: aguda, subaguda
e tardia. Na aguda (menos de 3 meses após o tratamento), rara e muitas vezes
reversível, revela-se basicamente por arritmias supraventriculares após a
administração da medicação. A subaguda é caracterizada pela disfunção
ventricular desenvolvida no decorrer do tratamento e também pode ser
irreversível. E por última, a tardia (3 a 12 meses ou após 1 ano do
tratamento), a forma mais presente, por vezes, irreversível [9,14].
Estudos
mostram que a maioria dos pacientes pediátricos desenvolvem cardiotoxicidade
tardia e é supostamente causada pela diminuição do potencial de crescimento do
miocárdio, com lesão dos miócitos pelas AC [7,10]. As células do sistema
cardiovascular possuem baixa capacidade de regeneração e isso as torna
suscetíveis aos efeitos adversos da QT [12]. Relacionado a isso, a dose
cumulativa da AC tem demonstrado que é um forte preditor de função cardíaca
anormal [15]. Doses com alto fator de risco estão por volta de ≥ 550 mg/m2
em pacientes adultos e ≥ 300 mg/m2 em pacientes infantojuvenil
na época do tratamento e qualquer dose em bebês [16].
Ainda
considerando as consequências da cardiotoxicidade, a
fadiga e a fraqueza generalizada são muito comuns em pacientes oncológicos. A
QT pode ser prejudicial à medula óssea e interferir na produção de glóbulos
vermelhos, podendo acarretar em um quadro de anemia e redução na capacidade de
transporte de oxigênio no sangue. A fadiga é gerada por uma anormal perfusão
sanguínea que afeta os músculos respiratórios e periféricos, resultando na
diminuição da capacidade oxidativa. A imobilidade também influencia nesse
quadro de fadiga e fraqueza generalizada [9,17].
Um programa de reabilitação com exercícios
físicos tem sido considerado um importante componente no tratamento de
pacientes cardio-oncológicos, pois têm demonstrado
uma melhora na CCR e diminuição dos efeitos da cardiotoxicidade.
Os exercícios geralmente englobam TA e TF [18]. Os exercícios também demonstram
melhora da imunidade, força, flexibilidade muscular, humor e podem reduzir os
efeitos colaterais da medicação [19].
Chen et
al. [20] apresenta alguns estudos com ratos, que ajudam a compreender o
mecanismo dos efeitos da cardiotoxicidade e como o exercício físico pode
contribuir para a diminuição da toxicidade induzida. Muitos estudos
demonstraram que o TA antes do tratamento com AC promoveu uma cardio-proteção
devido à diminuição do estresse oxidativo induzido pela AC, que proporciona um
aumento da produção de antioxidantes nas mitocôndrias cardíacas. Além disso, o
TA pode inibir o acúmulo de AC e aumentar a taxa de eliminação de AC do tecido
cardíaco sem perder os efeitos terapêuticos.
O COG
[16] recomendam que o TA deve ser incentivado para a maioria dos pacientes.
Quanto ao TF, sugerem que os exercícios isométricos intensos devem ser evitados
e orienta que o exercício resistido com cargas leves tem maior probabilidade de
ser seguro e que o número de repetições deve ser limitado ao que o paciente
pode executar com facilidade.
Muitos
estudos têm analisado esses efeitos benéficos do exercício físico em pacientes
com neoplasias, porém, poucos estudos recentes realizaram intervenções em
crianças com neoplasia hematológica relacionada à cardiotoxicidade.
San Juan et
al. [5] avaliaram 8 crianças em ambiente hospitalar (4 LLA e 4 SMD) após
até 1 ano do TCTH. A amostra era composta por 2 grupos, GE (10,9 ± 2,8 anos), 4
meninos e 4 meninas com TCTH e GC, 10,9 ± 2,6 anos,4 meninos, 4 meninas
saudáveis. O GE realizou um programa de TA e TF de 3 vezes por semana com duração
de 90 minutos nas primeiras semanas e 120 minutos no final durante 8 semanas. O
programa consistia de aquecimento de 15 minutos e descanso de 15 minutos em cicloergômetro e alongamentos. O TF incluiu 11 exercícios
com 1 série de 8 a 15 repetições e descanso de 1 minuto entre os exercícios. O
TA consistiu de exercícios em cicloergômetro,
corrida, caminhada e jogos aeróbicos (10 minutos no início do programa a 50%Fcmáx
até 30 minutos de atividade constante a 70% Fcmáx
no final do programa). Houve melhora significativa na CMF e aumento do VO2pico
em relação ao GC.
Moyer-Mileur et al. [21] realizaram um
programa de dieta balanceada e exercícios em casa com crianças diagnosticadas
com LLA durante a fase de manutenção do tratamento durante 12 meses. A amostra
era composta por GE, n = 6, 3 meninos/3 meninas (7,2 ± 0,7 anos) e GC, n = 7, 4
meninos/3 meninas (5,9 ± 0,7 anos). Foram consideradas as atividades de
corrida, salto e natação. Eram prescritos exercícios com intensidade moderada
para vigorosa no mínimo três vezes por semana com duração de 15 a 20 minutos.
Observaram que o programa encorajou a prática de atividade física (AF) e
melhorou a CCR.
Macedo et
al. [17], em um estudo preliminar, analisaram o efeito do TMI em crianças
(meninos e meninas com LLA) divididas em dois grupos: GE, n = 5 (7,0 ± 2,91
anos) e GC, n = 9 (9,0 ± 2,5 anos). Os pacientes do GE realizaram TMI em casa
por 15 minutos, 2 vezes por dia, durante 10 semanas, através do aparelho Threeshold®, com carga de 30% da PIM reajustada após
reavaliações semanais. Foi observado um ganho significativo de 35% na PIM e na
PEM no GE.
Rosenhagen et al. [22] realizaram um estudo
com 23 crianças e adolescentes que realizaram o TCTH durante a fase de
isolamento. A amostra era composta pelo GE, n = 13, (15.3 ± 3.7 anos) e GC, n =
10 (13,6 ± 4,0 anos) sem intervenção. Os pacientes possuíam LLA, leucemia mielóide aguda (LMA), SMD, rabdomiossarcoma,
linfoma de Hodgkin e outras. O treinamento foi realizado três vezes por semana
em um cicloergômetro e realizaram também TF. No
ergômetro, os pacientes treinaram por cerca de 25 minutos, com a carga de 0,6
watt/kg. No TF foram utilizados equipamentos como halteres, bolas e barras de
ginástica, bem como o próprio peso corporal. Observou-se que o os sintomas de
fadiga e a qualidade de vida melhoraram. Uma análise via questionário mostrou
também uma aceitação geral da AF durante as fases do TCTH.
Okada et al. [23] realizaram uma
adaptação de protocolos e orientações do COG, American Heart Association (AHA), American College
of Sports Medicine (ACSM) e US Department of Health and Human Services (HHS) e
propôs certas recomendações ao público adulto e infantojuvenil (6-17 anos).
Considerando o grupo 1 (dose baixa ou moderada de AC, < 250 mg/m2)
ele orienta a realizar AF com pouca restrição, sendo TA 5 vezes por semana por
30 minutos ou 1 hora por dia e TF 2 vezes por semana, em torno de 10 repetições
sem prender a respiração. O grupo 2 (doses alta de AC, ≥ 250 mg/m2,
e/ou radiação perto do coração) ele orienta a TA e TF, mas evitando o estresse
elevado do coração, sendo o mesmo TA e TF do grupo 1, mas restringido alguns
exercícios como levantamento de peso acima da cabeça e supino. O grupo 3
(sinais de dano da musculatura cardíaca devido ao uso de AC e/ou radiação) é
orientado a realizar TA e TF com certa limitação, mas para esses recomendam
acompanhamento de um cardiologista durante a atividade.
Tanir & Kuguoglu
[24] analisaram os efeitos do exercício em 40 crianças com LLA por 3 meses. GC,
n = 21, (10,72 ± 1,51 anos) e GE,n
= 19 (10,21 ± 1,51 anos). Foram realizados exercícios de amplitude de movimento
(ADM), 5 vezes por semana, 3 vezes por dia, TF (3 dias por semana, 3 vezes no
dia), e TA (3 vezes na semana, 1 vez ao dia por 30 min). Ao final do programa,
observaram melhora das capacidades físicas e melhores resultados de exames
laboratoriais.
Dubnov-Raz et al. [25] examinaram os
efeitos do exercício físico na composição corporal, aptidão física e saúde
mental em 22 crianças (7 a 14 anos) que haviam recebido tratamento para o
câncer e/ou realizado TCTH. A amostra foi dividida em 2 grupos, GE, n = 10 e
GC, n = 12 durante 6 meses. O GE possuía pacientes com LLA (n = 5), LNH (n =
1), LMA (n = 1), Leucemia mielomonocítica juvenil
(LMJ), n = 1, leucemia promielocítica aguda (LPA), n
= 1 e neuroblastoma (n = 1). O programa incluiu 3
sessões por semana durante 6 meses. Incluindo aquecimento aeróbico de 15min e
TF e TA por 30min com intensidade moderada, seguido do relaxamento através de
caminhadas e alongamentos por 15min. Não encontraram diferenças significativas
na melhora da capacidade aeróbia, porém, observaram que o ganho na aptidão
física geral esteve relacionado às mudanças na composição corporal e saúde
óssea, pois um dos objetivos era analisar a densidade mineral óssea.
Wallek et al. [26] analisaram os
efeitos de uma terapia com exercícios em 53 crianças (10.9 ± 3.5 anos) durante
o TCTH (LLA, SMD, linfoma e outros sólidos). A amostra era composta por GE, n =
26 e GC, n = 27 dividido em dois grupos cada. O treinamento compreendia TA, TF
e TFX realizado 3x por semana por 6 semanas. O TA englobava exercícios no cicloergômetro, jogos esportivos e outras variações por 10
a 30 minutos a 60-80% FCmáx. O TF era
feito em diversos equipamentos com 1 a 3 séries de 5 a 8 repetições por 10 a 20
minutos. O TFX era feito com exercícios ativos e passivos de alongamento por 5
a 10 minutos com 1 a 3 séries de 10 a 15 segundos. Observaram que o exercício
durante TCTH contribui para prevenção do tratamento relacionado à perda das
funções físicas e que a combinação de terapia regular de exercícios durante a
fase inicial do tratamento e antes do TCTH pode ser favorável para preparar as
crianças para modalidade intensa do tratamento.
Morales et
al. [27] analisaram o efeito de um programa de exercícios realizados em ambiente
hospitalar durante 22 semanas em 169 crianças com câncer (LLA, LMA, LH, LNH e
outros). A amostra era composta por dois grupos GE, 37% LLA, n = 68 (11 ± 4
anos) e GC,27% LLA, n = 101(11 ± 3 anos). O programa incluiu TA e TF de 2-3
sessões por semana, por 60-70 minutos. O TA era de 30-40 minutos em um
cicloergômetro (10 minutos), corrida na esteira (10 minutos) ou ergômetro para
membros superiores (10 minutos) e jogos aeróbicos (10 minutos) com intensidade
em 65-80% frequência cardíaca de reserva. O TF durava 30 minutos e era composto
de 1 a 3 séries (6-15 repetições) por exercício com 1 minuto de descanso entre
as series e exercícios. Ao final do estudo concluíram que um programa de
exercícios supervisionado é seguro, diminui o tempo de hospitalização e possui
um papel cardioprotetor em pacientes oncológicos pediátricos.
Stössel et
al. [28] avaliaram os benefícios de um treinamento com exercícios em 33
crianças (LLA, linfoma de célula T e outras). Foram divididos em dois grupos,
GE, n = 16 (10,6 ± 5,19 anos) e GC, n = 17(11,4 ± 4,25 anos). O treinamento foi
realizado por 6 a 8 semanas, 3 vezes por semana com duração de 45-60 minutos
cada sessão com aquecimento (exercícios com bolas de leve intensidade), TA, TF
e relaxamento. O TA era realizado de 15 a 20min por sessão a 60–75%FCmáx.
O TF era focalizado nos MMII realizado de 6 a 10min com intensidade moderada
combinado com exercícios de equilíbrio e coordenação. Foram observados efeitos
positivos dos exercícios combinados nas crianças durante tratamento intensivo
de câncer com benefícios do TF em MMII e melhora na sensação de fadiga e
qualidade de vida.
Através
da análise dos artigos selecionados, é possível verificar que o exercício
orientado proporcionou efeitos agudos melhorando a sensação de fadiga, força,
flexibilidade e capacidade cardiorrespiratória. Mostrou-se também detentor de
um potencial efeito cardioprotetor, podendo agir diretamente nos efeitos das
antraciclinas no organismo, reduzindo os danos colaterais da medicação.
Por isso,
o papel do fisioterapeuta é fundamental, pois ele atuará em conjunto com uma
equipe multiprofissional, na prescrição de exercícios a fim de prevenir e
diminuir os efeitos maléficos do tratamento. A fisioterapia respiratória
também, como uma ferramenta auxiliar no tratamento, pode contribuir de forma a
prevenir problemas pulmonares resultantes das doenças hematológicas e da cardiotoxicidade, devido à diminuição da capacidade
oxidativa e peroxidação lipídica nos cardiomiócitos
[2,9].
A maior
parte dos estudos experimentais foi realizada com crianças diagnosticadas com LLA,
talvez por ser a neoplasia mais incidente nas crianças (41,37%), além de
possuírem alta taxa de mortalidade de 51,32% [29].
Conclusão
Os
estudos analisados nesta revisão demonstram que a implementação de programas de
exercícios são eficazes e fazem um diferencial na manutenção e melhora da
qualidade de vida dos pacientes oncológicos infantis. Os efeitos da
reabilitação neste público são benéficos no que tange aos efeitos colaterais
das doenças e do tratamento. Os pacientes apresentaram efeitos positivos na
capacidade funcional muscular e cardiorrespiratória; melhora da sensação de
fadiga e qualidade de vida; ganhos na aptidão física; composição corporal e
saúde óssea. Também foi comprovada a diminuição do tempo de hospitalização e o
papel cardioprotetor da reabilitação, interferindo positivamente na cardiotoxicidade induzida pela quimioterapia.
Observou-se
que há muitos trabalhos experimentais direcionados a adultos e poucos ao
público infantojuvenil, que pode ser explicado devido a cardiotoxicidade
tardia ser mais presente do que a forma aguda e subaguda, dentre os
sobreviventes do câncer diagnosticado ainda na infância. Portanto, são
necessários mais estudos na área de reabilitação em onco-hematologia
pediátrica, sobretudo relacionada às complicações resultantes da cardiotoxicidade.
Conflitos
de interesses
Os autores
declaram não haver conflitos de interesses.
Fonte
de financiamento
A pesquisa
não recebeu financiamento para a sua realização.
Contribuição
dos autores
Concepção
e desenvolvimento, Desenho metodológico, Coleta e tratamento dos dados, Redação
e interpretação dos dados: Oliveira TSSO; Supervisão, Revisão crítica,
Interpretação dos dados e redação: Barreto TLC
Referências
- Instituto Nacional de Câncer
(INCA). Estimativa 2020: incidência de câncer no Brasil. Instituto Nacional de
Câncer José Alencar Gomes da Silva. Rio de Janeiro: INCA; 2019.
- Tonini PC, Santos APO, Becker ACG, Rezende CR,
Skupien EC, Santos HGPM, et al. Manual de Condutas e
Práticas Fisioterapêuticas em Onco-Hematologia da
ABFO. 1a. ed. Rio de Janeiro: Thieme Revinter; 2019.
- Santos MVC, Gallafrio CC. Cardio-oncologia na
população pediátrica. Rev Soc
Cardiol Estado de Säo Paulo
[Internet] 2017 [cited 2022 Feb
17];27(4):282-89. Available from: https://pesquisa.bvsalud.org/portal/resource/pt/biblio-879462
- Bouzas LF, Calazans M. Tumores sólidos e
hematológicos na infância e na adolescência - Parte I. Adolec
Saude [Internet] 2007 [cited
2022 Feb 2];4(1):40-4. Available from:
https://cdn.publisher.gn1.link/adolescenciaesaude.com/pdf/v4n1a07.pdf
- San Juan AF, Chamorro-Viña C, Moral S, del
Valle MF, Madero L, Ramírez M, et al. Benefits of intrahospital exercise
training after pediatric bone marrow transplantation. Int J Sports Med.
2008;29(5):439-446. doi: 10.1055/s-2007-965571 [Crossref]
- Miller KD, Siegel RL, Lin CC, Mariotto AB, Kramer JL, Rowland, JH, et al. Cancer treatment and survivorship statistics. CA Cancer J Clin 2016;66(4):271-89. doi: 10.3322/caac.21565 [Crossref]
- Seber A, Miachon
AS, Tanaka ACS, Castro AMS, Carvalho AC, Petrilli AS, et al. I Diretriz
brasileira de cardio-oncologia pediátrica da
Sociedade Brasileira de Cardiologia. Arq Bras Cardiol
2013;100(5Suppl1):1-68. doi: 10.5935/abc.2013S005 [Crossref]
- Instituto Nacional de Câncer
(INCA). Ações de enfermagem para o controle do câncer: uma proposta de
integração ensino-serviço. Instituto Nacional de Câncer. 3 ed. Rio de Janeiro:
INCA; 2008.
- Borges JA, Quintão MMP, Chermont SSMC, Filho HTFM, Mesquita ET. Fadiga: um sintoma
complexo e seu impacto no câncer e na insuficiência cardíaca. Int J Cardiovasc Sci 2018;31(4):433-42. doi: 10.5935/2359-4802.20180027 [Crossref]
- Fernandes RRA, Vianna CMM,
Freitas PG, Guerra RL, Corrêa FM. Avaliação econômica do uso de dexrazoxano na profilaxia de cardiotoxicidade
em crianças em tratamento quimioterápico com antraciclinas. Cad Saúde Pública 2019;35(9):e00191518. doi: 10.1590/0102-311X00191518 [Crossref]
- Bryant J, Picot J, Levitt G, Sullivan I, Baxter L, Clegg A. Cardioprotection against the toxic effects of anthracyclines given to children with cancer: a systematic review. Health Technol Assess 2007;11(27):3-84. doi: 10.3310/hta11270 [Crossref]
- Lipshultz SE, Adams MJ, Colan SD, Constine, LS, Herman EH, Hsu DT, et al. Long-term cardiovascular toxicity in children, adolescents, and young adults who receive cancer therapy: pathophysiology, course, monitoring, management, prevention, and research directions: a scientific statement from the American Heart Association [published correction appears in Circulation 2013;128(19):e394]. Circulation 2013;128(17):1927-95. doi: 10.1161/CIR.0b013e3182a88099 [Crossref]
- Wang F, Iskra B, Kleinerman E, Alvarez-Florez C, Andrews T, Shaw A, et al. Aerobic exercise during early murine doxorubicin exposure mitigates cardiac toxicity. J Pediatr Hematol Oncol 2018;40(3):208-15. doi: 10.1097/MPH.0000000000001112 [Crossref]
- Silva CMPDC, Pinto GH, Santos MHH. Quimioterapia e cardiotoxicidade. Rev Soc Cardiol Estado de São Paulo 2017;27(4):266-73. doi: 10.29381/0103-8559/20172704266-73 [Crossref]
- Ville de Goyet M, Moniotte
S, Brichard B. Cardiotoxicity of childhood cancer
treatment: update and current knowledge on long-term follow-up. Pediatr Hematol Oncol
2012;29(5):395-414. doi: 10.3109/08880018.2012.694092 [Crossref]
- Children’s Oncology Group (COG). Long-term follow-up guidelines for
survivors of childhood, adolescent and young adult cancers, Version 4.0
[Internet]. Monrovia, CA: Children’s Oncology Group, October 2013. [cited 2022
Feb 17]. Available from: http://www.survivorshipguidelines.org.
- Macedo TMF, Oliveira KMC,
Melo JBC, Medeiros MG, Filho WCM, Ferreira GMH, et al. Treinamento muscular
inspiratório em crianças com leucemia aguda: resultados preliminares. Rev
Paul Pediatr 2010;28(4):352-8. doi: 10.1590/S0103-05822010000400011 [Crossref]
- Tong CKW, Lau B, Davis MK. Exercise training for cancer survivors. Curr Treat Options Oncol 2020;21(7):53. doi: 10.1007/s11864-020-00752-w [Crossref]
- Ryan TD, Nagarajan R, Godown J. Pediatric cardio-oncology: development of cancer treatment-related cardiotoxicity and the therapeutic approach to affected patients. Curr Treat Options Oncol 2019;20(7):56. doi: 10.1007/s11864-019-0658-x [Crossref]
- Chen JJ, Wu PT, Middlekauff HR, Nguyen KL. Aerobic exercise in anthracycline-induced cardiotoxicity: a systematic review of current evidence and future directions. Am J Physiol Heart Circ Physiol 2017;312(2): H213-H222. doi: 10.1152/ajpheart.00646.2016 [Crossref]
- Moyer-Mileur LJ, Ransdell L, Bruggers CS. Fitness of children with standard-risk acute lymphoblastic leukemia during maintenance therapy: response to a home-based exercise and nutrition program. J Pediatr Hematol Oncol 2009;31(4):259-66. doi: 10.1097/MPH.0b013e3181978fd4 [Crossref]
- Rosenhagen A, Bernhörster M, Vogt L, Weiss B, Senn A, Arndt S, et al. Implementation of structured physical activity in the pediatric stem cell transplantation. Klin Padiatr 2011;223(3):147-51. doi: 10.1055/s-0031-1271782 [Crossref]
- Okada M, Meeske KA, Menteer J, Freyer DR. Exercise recommendations for childhood cancer survivors exposed to cardiotoxic therapies: an institutional clinical practice initiative. J Pediatr Oncol Nurs 2012;29(5):246-52. doi: 10.1177/1043454212451525 [Crossref]
- Tanir MK, Kuguoglu S. Impact of exercise on lower activity levels in children with acute lymphoblastic leukemia: a randomized controlled trial from Turkey. Rehabil Nurs 2013;38(1):48-59. doi: 10.1002/rnj.58 [Crossref]
- Dubnov-Raz G, Azar M, Reuveny R, Katz U, Weintraub M, Constantini NW. Changes in fitness are associated with changes in body composition and bone health in children after cancer. Acta Paediatr 2015;104(10):1055-61. doi: 10.1111/apa.13052 [Crossref]
- Wallek S, Senn-Malashonak
A, Vogt L, Schmidt K, Bader P, Banzer W. Impact of
the initial fitness level on the effects of a structured exercise therapy
during pediatric stem cell transplantation. Pediatr Blood Cancer 2018;65(2). doi: 10.1002/pbc.26851 [Crossref]
- Morales JS, Santana-Sosa E, Santos-Lozano A, Baño-Rodrigo A, Valenzuela PL, Rincón-Castanedo C, et al. Inhospital exercise benefits in childhood cancer: A prospective cohort study. Scand J Med Sci Sports 2020;30(1):126-34. doi: 10.1111/sms.13545 [Crossref]
- Stössel S, Neu MA, Wingerter A, Bloch W, Zimmer P, Paret C, et al. Benefits of exercise training for children and adolescents undergoing cancer treatment: results from the Randomized Controlled MUCKI Trial. Front Pediatr 2020;8:243. doi: 10.3389/fped.2020.00243 [Crossref]
- World Health Organization (WHO). Estimated number of incident cases and deaths worldwide, both sexes, ages 0-19. Global Cancer Observatory, 2018 [Internet]. [cited 2022 Feb 17]. Available from: https://gco.iarc.fr/
