Fisioter
Bras 2021;22(6);791-808
ARTIGO
ORIGINAL
Caracterização
da força e da função muscular nas disferlinopatias em amostra brasileira
Characterization
of muscle strength and function in dysferlinopathy in a Brazilian sample
Isabela
Pessa Anequini, M.Sc.*, Jéssica Marim de Lima, M.Sc.*, Silvana Amanda do
Carmo**, Juliana
Aparecida Rhein Telles, M.Sc.**, Mariana Callil Voos, D.Sc.***, Fátima Aparecida
Caromano, D.Sc.****
*Universidade
de São Paulo (MRCUSP), LaFi.Com, São Paulo/SP, **Doutoranda em Ciências da
Reabilitação pela Faculdade de Medicina da Universidade de São Paulo, São
Paulo/SP, ***Pesquisadora do Curso de Fisioterapia da FMUSP, Professora da
Universidade Ibirapuera e PUC/SP, São Paulo/SP, ****Profa. do Curso de
Fisioterapia MRCUSP, Orientadora no Programa de Pós-Graduação em Ciências da
Reabilitação da Faculdade de Medicina da Universidade de São Paulo (FMUSP),
LaFi.Com, São Paulo/SP
Recebido
em 12 de setembro de 2021; aceito em 4 de dezembro de 2021.
Correspondência: Profª. Dra. Fátima
Aparecida Caromano, Rua Cipotânea, 51, Cidade Universitária da Universidade de
São Paulo (USP), Butantã 05360-000 São Paulo, SP, Brasil, E-mail:
caromano@usp.br
Isabela
Pessa Anequini: isa.anequini@gmail.com
Jéssica
Marim de Lima: jessica.marim1@gmail.com
Silvana
Amanda do Carmo: carmo.amanda@gmail.com
Juliana
Aparecida Rhein Telles: juliana.rhein@usp.br
Mariana Callil
Voos: ftmarivoos@gmail.com
Fátima
Aparecida Caromano: caromano@usp.br
Estudo
de caracterização da força e da função muscular nas disferlinopatias para
estabelecer biomarcadores de habilidades motoras com amostra de 40 pacientes,
tendo sido avaliados força muscular (Medical Research Council - MRC),
percentual de MRC, tempo de execução para deambular e escores nas Escalas de
Vignos, Egen Klassifikation, Avaliação Funcional para Distrofia Muscular
de Duchenne (FES-DMD) e North Star Ambulatory Assessment adaptada.
Prevalência da disferlinopatia de 25,5% na amostra total de distrofias (1340),
idade média de 36,5 anos, 52,5% do sexo masculino e 75% deambuladores. Músculos
mais fracos: abdominal, glúteos, íliopsoas, isquiotibial, quadríceps femoral,
tibial anterior e deltoide médio. Correlação forte entre MRC e tempo para
deambular (r = 0,77) e, muito forte da MRC distal de membros inferiores com
aNSAA (r = 0,90). Interação da MRC dos membros superiores e inferiores nos segmentos
proximal e distal (p < 0,001), sendo mais evidente em membros superiores que
inferiores. Taxa variável de progressão da doença com 60% dos pacientes
moderadamente ou gravemente afetados, com mais de 12 anos de doença. Estudo
mostra que padrão de fraqueza muscular dos brasileiros com disferlinopatia é
proximal e distal dos MMII, com comprometimento associado da região proximal
dos MMSS, além de elucidar as habilidades motoras em relação ao processo de
locomoção e disfunções cardiorrespiratórias.
Palavras-chave: distrofia muscular do cíngulo dos
membros; doenças neuromusculares; disferlina; debilidade muscular; destreza
motora; avaliação da deficiência.
Abstract
The
study of the characterization of muscle strength and function in
dysferlinopathy to establish biomarkers of motor skills. Sample of 40 patients
with muscle strength with MRC (Medical Research Council), MRC percentage, timed
motor performances for walking, Vignos scales, Egen Klassifikation, Functional
Assessment for Duchenne muscular dystrophy (FES-DMD) and North Star Ambulatory
Assessment Adapted (aNSAA). Prevalence of dysferlinopathy of 25.5% in all
dysthophies studied (1340), mean age of 36.5 years, 52.5% of males and 75% of
walking. Weak muscles: abdominal, gluteus, iliopsoas, hamstrings, quadriceps
femoris, tibialis anterior and medial deltoid. Strong correlation between MRC
and time to walk (mean r = 0.77) and very strong MRC distal lower limbs with
aNSAA (r = 0.90). Interaction of MRC of upper limbs and lower limbs between the
proximal and distal segments (p < 0.001), being more evident in upper limbs
than in lower limbs. Variable rate of disease progression, with 60% of patients
moderately or severely affected with > 12 years of disease. The findings
characterize the pattern of muscular weakness of Brazilians with
dysferlinopathy as proximal and distal lower limbs, with associated involvement
of the proximal upper limbs, besides elucidating the motor abilities in
relation to the locomotion process and cardiorespiratory diseases.
Keywords: muscular dystrophies limb-girdle;
neuromuscular diseases; dysferlin; muscle weakness; motor skills; disability
evaluation.
Introdução
As
disferlinopatias formam grupo de doenças neuromusculares genéticas, de herança
autossômica recessiva [1,2], com alterações na produção da proteína disferlina,
presente na membrana das fibras musculares e, que é codificada a partir do gene
DYSF, localizado no cromossomo 2p12-14 [3,4]. Os principais fenótipos
encontrados são a miopatias de Miyoshi (MM) e a distrofia muscular de cinturas
(DMC) do tipo 2B (DMC2B) [2].
A
DMC2B é a segunda forma em frequência dentre as DMC em diferentes países [5], e
apresenta fraqueza acentuada nos músculos das cinturas escapular e pélvica
[3,4,6]. Enquanto que na MM a fraqueza é distal, principalmente nos músculos das
panturrilhas [7].
Diversos
estudos foram realizados direcionados para a caracterização do acometimento e
da evolução da doença, demonstrando alto grau de variabilidade no padrão de
fraqueza, no entanto há escassez de pesquisas sobre biomarcadores funcionais.
Este
trabalho com a exploração aprofundada do padrão de envolvimento muscular, da
fraqueza e das habilidades motoras possibilita a geração de ferramenta
confiável de acompanhamento evolutivo da doença para elaboração de pesquisas
longitudinal e ensaios clínicos para melhora da prática clínica.
O
objetivo deste estudo foi caracterizar a força e função muscular em observação
transversal de prontuário de amostra de pacientes com disferlinopatia. Como
objetivo secundário: investigar a correlação entre diferentes variáveis
clínicas, considerando dois grupos de pacientes, cadeirantes e não cadeirantes.
Métodos
Estudo
aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina da
Universidade de São Paulo (protocolo 64577316.5.0000.0065).
Pesquisa
transversal, descritiva, retrospectiva, com uso do banco de dados de doenças
neuromusculares genéticas do Centro de Estudo sobre o Genoma Humano e Células
Tronco (CEGH) do Departamento de Biologia - Instituto de Biociências da
Universidade de São Paulo. Todos os pacientes acompanhados no Centro assinam
termo de Consentimento Livre e Esclarecido.
Coleta
de dados e participantes
Grupo
de 1340 pacientes com diversas doenças neuromusculares são acompanhados no
setor de Fisioterapia Neurofuncional do CEGH. A amostra contou com 40 pacientes
com diagnóstico fechado de disferlinopatia. O diagnóstico foi concluído pelo
meio de exame de DNA pelo sequenciamento de nova geração (NGS) em 42,5% da
amostra e por biópsia muscular em 57,5% dos casos.
As
informações clínico-funcionais foram coletadas a partir do prontuário de
avaliação utilizado no Setor de Fisioterapia. Os dados coletados foram: sexo,
idade, início dos sintomas da doença, data do diagnóstico, idade da perda da
marcha, presença de sinais clínicos específicos, função cardiorrespiratória,
presença de comorbidades, força muscular, índice de força muscular, tempo de
execução para deambular.
A
MRC é mensurada por meio da escala Medical Research Council (MRC) [8].
Utiliza-se escala de 5 pontos, nos quais: grau zero (ausência de evidência de
contração muscular), grau 1 (contração impotente que é sentida na palpação do
músculo ou do tendão, porém sem movimento visível), grau 2 (o músculo é capaz
de completar a amplitude de movimento no plano horizontal, sem ação da
gravidade), grau 3 (o músculo pode manter a posição da prova contra a
resistência da gravidade), grau 4 (o músculo pode manter a parte na posição da
prova contra pressão moderada) e grau 5 (o músculo pode ser mantido na posição
da prova contra forte pressão). Os grupos musculares utilizados: flexores da
cervical, extensores da cervical, flexores do tronco, extensores do tronco,
deltoides (porções anterior, média e posterior), bíceps braquial, tríceps
braquial, flexores dos punhos, extensores dos punhos, iliopsoas, glúteo,
adutores do quadril, isquiotibial, quadríceps femoral, gastrocnêmio e tibial
anterior.
Coletou-se
o índice do MRC [9] das regiões proximal dos membros superiores (MMSS), distal
dos MMSS, proximal dos membros inferiores (MMII) e distal dos MMII, calculado
por meio da fórmula: Índice MRC (%) = soma da pontuação dos testes (bilateral)
x 100 / número de músculos testados x 5.
O
tempo de execução para deambular coletado do prontuário foi realizado em
corredor plano de 10 metros e utilizando-se cronômetro simples. A realização
desta atividade fornece dados para comparações do próprio paciente e deste com
indivíduos com outros diagnósticos como distrofia muscular de Duchenne (DMD)
[10].
Escalas
clínicas
Foram
coletados dos prontuários os escores das escalas clínicas de Vignos modificada
[11], que classifica o estadiamento da doença por meio do desempenho motor e a
escala Egen Klassifikation (EK), validada para português [12], que quantifica o
grau de limitação funcional nas atividades de vida diária em pacientes com DMD
em fase crônica.
Coletou-se
do prontuário informações da descrição qualitativa da realização de atividades
motoras como levantar do chão, sentar e levantar da cadeira, ficar na ponta dos
pés, ficar nos calcanhares, andar, subir e descer escadas, pular, correr,
agachar-se e levantar-se. Estes dados foram utilizados para inferir as escalas
de Escala de Avaliação Funcional para DMD/Functional Evaluation Scale (FES-DMD)
e North Star Ambulatory Assessment adaptada (aNSAA), ambas ainda não validadas.
A
FES-DMD é a escala brasileira, com boa concordância na repetibilidade e
reprodutibilidade, composta por quatro domínios, são eles: sentar e levantar da
cadeira, sentar e levantar do chão, subir e descer escadas e deambular. O
domínio utilizado foi o deambular [10], que é composto de três fases e 14
itens. A primeira fase, “Apoio” com cinco itens e variação de pontos de 0 a 23,
a segunda, “Balanço” com seis itens e pontuação entre 0 e 11 e a terceira,
“Movimentos Compensatórios Gerais” com seis itens e variação de pontos de 0 a
13.
A
North Star Ambulatory Assessment adaptada (aNSAA) foi elaborada para
pacientes com disferlinopatia [2], a partir da necessidade de avaliação de
aspectos específicos da doença como fraqueza proximal e fraqueza distal dos
MMII. Tem como base a NSAA, escala validada para avaliação funcional de
pacientes com DMD, com boa confiabilidade e boa a moderada responsividade. A
versão original contém 17 itens que abordam a capacidade de permanecer em pé,
deambular, levantar da cadeira, manter apoio unipodal, subir degraus, sentar,
levantar do chão, levantar a cabeça, pular em apoio unipodal, saltar, ficar nos
calcanhares e correr. As atividades são pontuadas entre 0 (necessidade de
assistência), 1 (execução de forma independente com compensações) e 2 (execução
normal) [13]. Para a aNSAA foram acrescidos 5 itens com pontuação máxima de 51.
Posteriormente os autores construiram a estratificação de gravidade do quadro
clínico, no qual o quadro é severo para pontuações ≤ 5 ou em cadeirantes, quadro moderado
para pontuação entre 6 e 39 e quadro leve para pontuação entre 40 a 51.
Análise
de dados
Análise
estatística descritiva com cálculo do valor de média e desvio-padrão utilizados
para descrever as características gerais da amostra. Testou-se a normalidade de
cada variável por meio do teste de aderência Kolmogorov-Smirnov.
Posteriormente, realizou-se o teste de correlação de Pearson com o objetivo de
investigar possíveis relações entre as variáveis. A análise de variância foi
utilizada para verificar a comparação entre a MRC nos seguimentos corporais. Em
seguida, a análise de Post-Hoc de Tukey. A análise estatística dos dados foi
realizada por meio da utilização do software Statistica v.13 e o nível de
significância adotado foi de 0,05.
Resultados
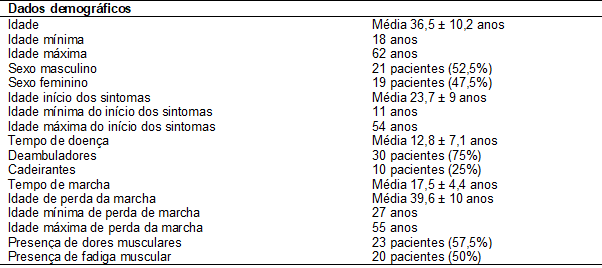
Dados
demográficos
Dos
1.340 prontuários de pacientes acompanhados no Setor de Fisioterapia do
CEGH-USP, a DMC é a quarta doença mais frequente entre os diagnósticos fechados
compreendendo 10,5% dos casos. Entre as DMC, a DMC2B é a segunda mais frequente
em prevalência com 25,5%, atrás apenas da calpainopatia com 34%.
Apenas
três pacientes apresentaram início dos sintomas antes dos 15 anos. Presença de
6 irmandades (Tabela I).
Tabela
I - Dados
demográficos da amostra
Características
clínicas gerais
Encontrou-se
presença de hipotonia muscular em 15% da amostra. A atrofia muscular esteve
presente em 82,5%, sendo as regiões mais acometidas: panturrilhas e coxas. A
pseudohipertrofia muscular foi observada em apenas três pacientes, dois
pacientes, nos músculos das panturrilhas e um paciente, nos músculos bíceps
braquiais e deltóides (Figura 1).
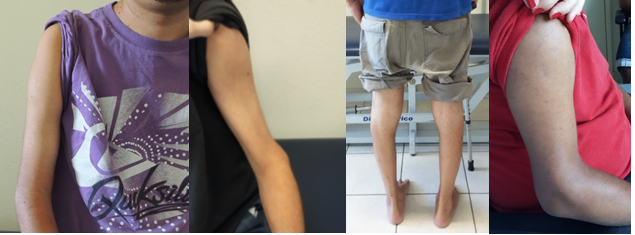
Figura
1 - Atrofia e
pseudohipertofia muscular em 4 pacientes. Da esquerda para direita: atrofia de
deltoide no sujeito 16; atrofia de bíceps braquial no sujeito 2; atrofia das
panturrilhas no sujeito 36; pseudohipertrofia do deltoide com atrofia do bíceps
braquial no sujeito 21
Força
muscular
A
MRC cervical estava preservada em 97,5% da amostra (MRC ≥ 3). A fraqueza
dos músculos abdominais e paravertebrais foi observada em 72,5% e 55%,
respectivamente.
A
fraqueza dos MMSS foi mais acentuada nos músculos proximais, sendo o músculo
deltoide anterior mais acometido com média de MRC 3,1 em 50% dos casos, seguido
do deltoide anterior (média de MRC 3,2) e do deltoide posterior (média de MRC
3,1). O bíceps e tríceps braquial tiveram média MRC de 3,7 e os flexores e
extensores dos punhos média de MRC 4,2 e 4,3, respectivamente. Não se observou
MRC 1 nos músculos dos MMSS. Nos MMII, a fraqueza esteve presente nos músculos
proximais e distais, sendo o iliopsoas e o glúteo os músculos mais acometidos
(média de MRC 2,5), seguido do isquiotibial (média de MRC 2,6), adutores do
quadril e tibial anterior (média de MRC 2,7). O gastrocnêmio e o quadríceps
femoral apresentaram média de MRC de 3,2 e 3, respectivamente. Observou-se MRC
1 em adutores do quadril, quadríceps, isquiotibial e tibial anterior.
Nos
MMII, em ambos os grupos (deambuladores e cadeirantes), verificou-se na
articulação do joelho a preservação da força do compartimento anterior, ou
seja, quadríceps femoral (p = 0,003); enquanto que na articulação do tornozelo,
o músculo do compartimento posterior (gastrocnêmio) esteve mais preservado (p =
0,02). Não houve diferença entre a MRC da articulação do quadril (iliopsoas e
glúteo).
Pelo
índice de MRC verificou-se que no grupo deambuladores a força dos MMSS, tanto
proximal quanto distal, está preservada, enquanto há fraqueza dos MMII de
predomínio proximal. No grupo cadeirantes, há fraqueza da região proximal dos
MMSS e intensa fraqueza dos MMII (proximal e distal, em semelhante proporção)
(Figura 2).
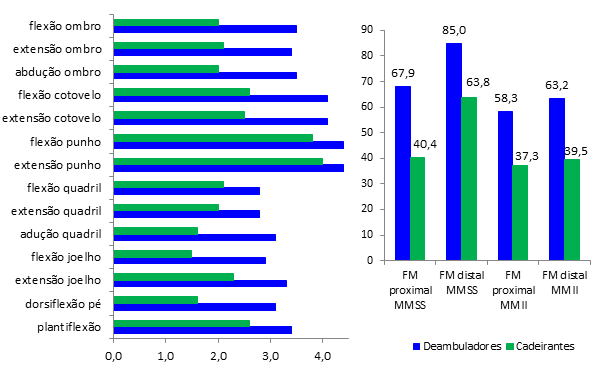
FM
= força muscular; MRC = Medical Research Council; MMSS = membros superiores;
MMII: membros inferiores
Figura
2 - Comparação da
força muscular manual. À esquerda: média FM nos membros; à direita: média do
índice de MRC nos membros
Função
cardiorrespiratória
Os
dados da função respiratória do teste de função pulmonar foram coletados do
prontuário e encontrou-se que 42,5% da amostra possuía padrão restritivo em
declínio, 35% não tinha alteração e, portanto, apresentavam teste normal e
22,5% possuíam padrão restritivo leve.
As
informações sobre as avaliações cardíacas foram retiradas das anotações do
prontuário dos laudos médicos dos exames de eletrocardiograma, ecocardiograma e
Holter. A ausência de alterações cardíacas foi encontrada em 27,5% da amostra,
enquanto que 22,5% possuíam alguma alteração cardíaca. Metade da amostra não
possuía exames cardíacos. As alterações cardíacas encontradas no prontuário
foram: alteração de relaxamento do miocárdio, arritmia cardíaca, cardiopatia
leve, cardiopatia moderada, disfunção diastólica do ventrículo esquerdo,
dilatação discreta do ventrículo esquerdo, distúrbio inespecífico de condução
intraventricular, hipertrofia concêntrica do ventrículo esquerdo, infarto agudo
do miocárdio, sobrecarga do ventrículo esquerdo e taquicardia sinusal.
A
presença de comorbidades foi citada em 20% da amostra, sendo elas:
dislipidemia, espodiloartrose, etilismo social, hipertensão arterial,
hiperuricemia, hipotireoidismo e tabagismo.
Correlações
entre variáveis funcionais
MRC e
dados demográficos
Houve
forte correlação entre idade e início dos sintomas (r = 0,73) e moderada
correlação entre idade e tempo da doença (r = 0,49). A correlação da idade com
a MRC foi fraca para todos os seguimentos corporais: proximal dos MMSS (r =-
0,34), distal dos MMSS (r =- 0,29), proximal dos MMII (r = -0,18) e distal dos
MMII (r =- 0,21).
MRC e
escalas clínicas
A
correlação da MRC e do escore da aNSAA foi forte com as regiões proximal dos
MMSS e MMII (r = 0,83, 0,80, respectivamente), moderada com distal dos MMSS (r
= 0,69) e muito forte com distal dos MMII (r = 0,90) (Figura 3).
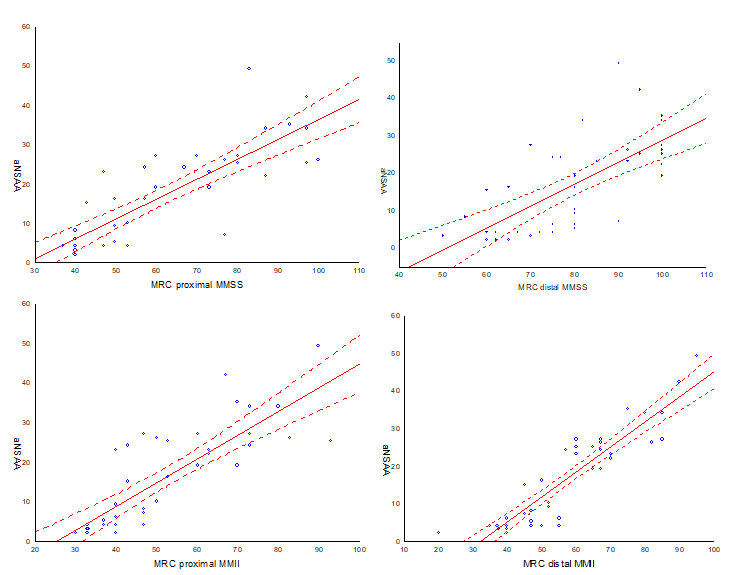
MRC =
Medical Research Council; MMSS = membros superiores; MMII = membros inferiores;
aNSAA = North Star Ambulatory Assessment adaptada
Figura
3 - Correlação entre
as variáveis MRC e aNSAA. À esquerda no alto: MRC proximal dos MMSS x aNSAA; À
direita no alto: MRC distal dos MMSS x aNSAA; À esquerda embaixo: MRC proximal
dos MMII x aNSAA; À direita embaixo: MRC distal dos MMII x aNSAA
A
correlação entre a MRC e o tempo de execução para deambular foi forte para as
regiões proximal dos MMSS, proximal dos MMII e distal dos MMII (r = -0,77, -0,74
e -0,80, respectivamente). A correlação foi moderada com a região distal dos
MMSS (r= -0,68).
Os
escores de Vignos da aNSAA tiveram forte correlação (r = -0,86). O tempo para
execução para deambular obteve correlação muito forte com escore da Vignos (r =
0,92) e forte com escore das escalas de FES-DMD e aNSAA (r = 0,87 e r = -0,84,
respectivamente).
A
estratificação de gravidade da doença por meio do escore da aNSAA verificou 2
pacientes na categoria leve, 26 pacientes na categoria moderada e 12 pacientes
na categoria grave.
A
análise demonstrou que a proporção de pacientes mais graves esteve nas
categorias com maior tempo de doença. A taxa de progressão da doença foi
variável, com 60% dos pacientes moderadamente ou gravemente afetados com >
12 anos de doença, enquanto que a proporção de indivíduos gravemente afetados
foi de 100% após 24 anos de tempo de doença (Figura 4).
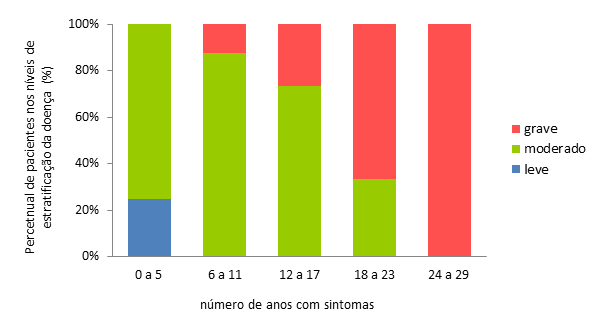
aNSAA
= North Star Ambulatory Assessment adaptada
Figura
4 - Porcentagem de
pacientes dentro de cada categoria de gravidade por meio da estratificação do
escore da escala de aNSAA
Padrão
de MRC nos segmentos corporais
A
análise de variância demonstrou que houve interação membro versus região versus
grupo (cadeira ou deambulador), apresentando F(1,38) = 3,79;ES = 0,090;p <
0,001 (Figura 5).
A
análise Post-Hoc de Tukey demonstrou que no grupo cadeirante, houve diferença
entre a MRC proximal e distal dos MMSS (p < 0,001), e entre a MRC distal dos
MMSS e a proximal e distal dos MMII (p < 0,001). Não houve diferença entre a
MRC proximal dos MMSS e proximal e distal dos MMII (p = 0,960 e p = 0,999,
respectivamente) e, entre a MRC proximal e distal dos MMII (p = 0,995).
No
grupo deambuladores, houve diferença significante entre a MRC proximal e distal
dos MMSS (p < 0,001), entre a MRC proximal dos MMSS e MMII (p < 0,001),
entre MRC distal dos MMSS e proximal e distal dos MMII (p < 0,001). Não
houve diferença entre as MRC proximal e distal dos MMII (p = 0,084).
A
análise de interação entre cadeirantes e deambuladores demonstrou que não houve
diferença significante entre MRC proximal dos MMSS dos grupos (p = 0,003), MRC
distal dos MMSS dos grupos (p = 0,0434), MRC proximal dos MMII dos grupos (p =
0,048) e MRC distal dos MMII dos grupos (p = 0,015).
Em suma, encontrou-se diferença entre as regiões
proximal e distal, sendo esta diferença mais evidente em MMSS do que em MMII;
ou seja, a MRC geral dos MMII é bastante diminuída; enquanto a MRC distal de
membros superiores é relativamente preservada.
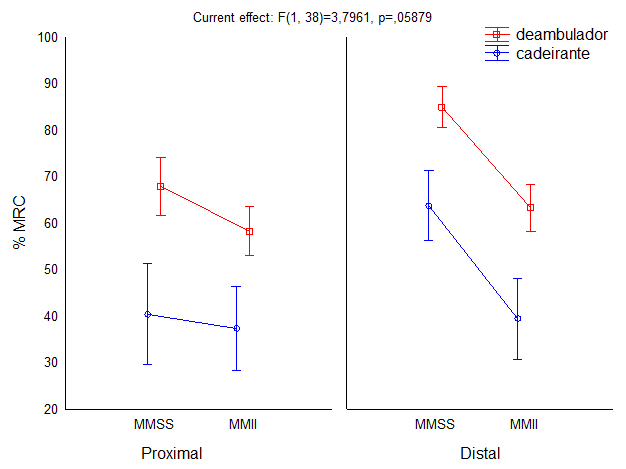
MRC
= Medical Research Council; MMSS = membros superiores; MMII = membros
inferiores
Figura
5 - Interação entre
o índice de MRC nos seguimentos corporais – MMSS, MMII, região proximal e
região distal nos grupos deambuladores e cadeirantes
Discussão
Esta
pesquisa apresentou o primeiro estudo clínico-funcional de amostra brasileira
de 40 pacientes com disferlinopatia, a quarta DMC mais frequente no CEGH/USP
com prevalência de 25,5%, condizente com a prevalência encontrada na literatura
[14]. Estudo brasileiro de 2001 [15] identificou prevalência mais baixa (14%),
entretanto, naquele período o diagnóstico não era realizado pelo NGS, exame
este que possibilitou a expansão dos diagnósticos de diversos tipos de
distrofias, especialmente as DMC.
Média
de idade da amostra de 36,5 anos (variação de 18 a 62), mais velha quando
comparada a outras pesquisas (média variando de 20 a 27,9 anos) [14,16].
Entretanto, mais jovem quando comparada a amostra japonesa (média 50,3 anos,
variação de 22 a 75) [1]. Ligeira prevalência do sexo masculino (52,5%) [6,17],
porém diferentemente da prevalência feminina em países orientais e na população
mexicana [18,19]. Início dos sintomas, variação de idade e presença de sintomas
semelhante à literatura [20,21,22].
O
tempo de doença não é homogêneo na literatura. Neste estudo foi encontrado
tempo médio de 12,8 anos (variação de um a 29 anos), menor que o encontrado
pela pesquisa japonesa (23,7 anos) [1], e maior que a indiana (6,4 anos) [14].
A discrepância pode estar relacionada a fatores como acesso ao diagnóstico
precoce, acesso à saude, conhecimento da doença por parte dos profissionais de
saúde, qualidade de vida e expectativa de vida. Shin et al. (2015) [19] relatam
média entre o início dos sintomas até o diagnóstico de 7,5 anos com intervalo
de um a 30 anos.
Presença
de grande maioria de deambuladores (75%) condizente com a literatura que
considera as disferlinopatias mais leve quando comparadas a calpainopatia e a
sarcoglicanopatia [16], porém menos leve quando comparada a DMC2L, distrofia
causada pela ausência de anoctamia 5 [21]. A média de idade da perda da marcha
(39,6 anos) também acompanha a literatura [23], e a ausência de alterações
cardíacas importantes e o padrão respiratório restritivo em declínio também
foram descritos [1].
A
atrofia muscular das panturrilhas encontrada nesta pesquisa também foi
largamente relatada nos pacientes com disferlinopatia [21,22]. Entretanto, há
pouco relato sobre a presença de atrofia do músculo bíceps braquial associada à
preservação do músculo deltoide, resultando em pseudohipertrofia [16].
Encontramos
nos MMSS predomínio de fraqueza proximal, em que a seletividade do envolvimento
muscular foi típica, tal como descrito nas DMC, primariamente afetado o músculo
deltoide, e secundariamente o bíceps e o tríceps braquial [1,14] e, com as mãos
relativamente preservadas [19,20]. Nos MMII, verificou-se fraqueza proximal e
distal [14,16,21,22,23], principalmente no grupo de cadeirantes. O escore MRC 1
foi observado nos músculos adutores do quadril, quadríceps, isquiotibial e
tibial anterior, compatível com casos mais avançados [1].
Quanto
ao padrão de acometimento, observou-se preservação de força do grupo muscular
anterior na articulação do joelho (quadríceps femoral), porém fraqueza de
tibial anterior quando comparado ao gastrocnêmio. A fraqueza de tibial anterior
também foi relatada na população alemã [21]. Não houve diferença entre a MRC de
iliopsoas e glúteo, diferentemente do relatado pela literatura com flexores do
quadril mais fortes que extensores [2].
O
índice de MRC demonstra que a fraqueza proximal dos MMSS está presente nos
cadeirantes e a fraqueza distal dos MMII é presente em ambos os grupos, porém
mais intensamente nos cadeirantes. A partir destes dados, pode ser sugerida a
proporção da perda da força, com queda mais acentuada em MMII e o aumento da
fraqueza proximal dos MMSS relacionado com doença mais grave ou quadro mais
avançado, assim como corte inglesa (N = 36), na qual, a força dos MMSS diminuiu
para 76%, enquanto a queda nos MMII foi para 49% [22] e, coorte multicêntrica
(N = 193) com perda de força muscular mais evidente na região distal dos MMII
(71% da amostra) [2].
Apesar
de descritas na literatura, as diferenças entre as doenças conhecidas como
disferlinopatias, no qual a DMC2B é caracterizada por fraqueza proximal e a MM
é descrita por fraqueza distal com envolvimento precoce dos músculos do
compartimento anterior da perna [24], verificam-se relatos com discrepâncias
nos grupos musculares mais acometidos dos MMII [2,22]. Neste estudo foi
observada equiparação das fraquezas proximais e distais dos MMII, o que tornou
difícil a distinção do envolvimento inicial. Este achado também encontrado na
literatura reflete a progressão da doença com sobreposição de fraqueza proximal
e distal, corroborando que, embora as disferlinopatias possam apresentar
inicialmente fenótipos distintos, elas se sobrepõem em estágios mais avançados
[2,22].
Este
estudo apresentou dados robustos relativos a habilidades motoras dos pacientes
com disferlinopatia, com correlação da MRC, principalmente dos MMII, com o
tempo de execução para deambular e as escalas clínicas de Vignos, EK, FES-DMD e
aNSAA, o que reforça a relevância destas variáveis como biomarcadores da
evolução das disferlinopatias. Em sua grande maioria, os estudos utilizam a
escala de Vignos modificada ou, a exemplificação da gravidade do quadro por
meio da descrição da incapacidade de levar as mãos à boca ou o confinamento no
leito [1,19,20].
A
estratificação da escala aNSAA demonstrou que 65% dos pacientes deste estudo
estão na categoria moderada, 30% na grave e, 5% na leve; enquanto que a coorte
multicêntrica [2] identificou 49%, 32% e 19%, respectivamente. Nossa pesquisa
apresentou idade média e tempo de doença ligeiramente mais baixos (36,5 anos
versus 40 anos e, 12,8 anos versus 17 anos, respectivamente). A coorte
apresentou casos mais brandos com indivíduos em categoria leve de gravidade em
todos as faixas de idade, enquanto que neste trabalho a categoria leve está
restrita a faixa de até 5 anos de doença.
Nos
pacientes com disferlinopatia a fraqueza de músculos proximais e distais dos
MMII pode comprometer seriamente a capacidade de deambulação, visto que, em
estudos com diferentes doenças neuromusculares, pacientes com fraqueza distal
dos MMII apresentam movimentos de tronco, joelhos e tornozelos instáveis e
aumentados durante os desequilíbrios direitos e para trás, em contraste,
aqueles com fraqueza proximal, com pior resposta de equilíbrio apenas nas
perturbações posteriores [25]. A fraqueza do compartimento posterior
(isquiotibial, gastrocnêmio e sóleo) pode ainda inferir padrão distinto de
alteração na marcha com perda do choque do calcâneo e da propulsão da marcha e
ausência de extensão do joelho durante as fases de apoio e balanço [20].
Os
estudos enfatizam o esforço e a necessidade do diagnóstico para classificar os
pacientes com disferlinopatias, considerando-se a combinação de dados clínicos,
imuno-histoquímica e dados moleculares genéticos. Chama a atenção o relato de
proporção significativa de pacientes classificados como DMC (27,9% a 41,3%)
[26] e evidencia-se variação das frequências de subtipos confirmados em
populações diferentes, que pode ser explicada por testes bioquímicos e
imunológicos menos abrangente nas biópsias musculares e/ou testes genéticos.
Paralelamente, reitera que a grande variabilidade do padrão de fraqueza e da
taxa de progressão corroborando a necessidade de estudos longitudinais [2] e da
determinação de biomarcadores [27,28] para melhor elucidar a trajetória dos
fenótipos e apontar para desenvolvimento de estudos clínicos de intervenções
mais eficazes e seguros [2].
Conclusão
Este
estudo identificou o padrão de fraqueza de amostra brasileira de pacientes com
disferlinopatia. A partir do conhecimento gerado por estes dados, pode-se fazer
interface com a pesquisa translacional, dando suporte para escolha do
biomarcador de acompanhamento da doença e gerando informações relevantes para
tomada de decisões clínicas. A intervenção fisioterapêutica deve ser
direcionada para o treinamento dos movimentos do joelho no auxílio as respostas
de equilíbrio, o treino das estratégias de equilíbrio compensatórias do
tornozelo e de adaptação de atividades de vida diária que dependam da elevação
dos MMSS acima da cabeça. Estudos futuros devem focar na determinação do efeito
dos exercícios na resistência muscular, no efeito do uso de órteses funcionais
na estabilidade e no equilíbrio corporal e na correlação do uso de órtese com o
prolongamento do tempo de deambulação.
As
limitações encontradas referem-se à escassez de informações sobre a evolução da
fraqueza muscular que permitisse categorizar os pacientes nos diferentes tipos
de disferlinopatias, à necessidade de validação da escala funcional específica
para disferlinopatia e à correlação com outra escala funcional validada e de
maior utilização nas miopatias e distrofias. A ampliação da avaliação com uso
de escalas validadas, bem como a ampliação da pesquisa com estudos
longitudinais, é interessante e necessária para auxiliar na elucidação do desenvolvimento
da doença e no desenvolvimento de estudos clínicos fisioterapêuticos.
Agradecimentos
Dra.
Mayana Zatz por ceder os dados para este estudo.
Equipe Centro
de Estudos do Genoma Humano e Células Tronco pela consultoria técnica.
A North
Star Ambulatory Assessment adaptada (aNSAA), pela cessão de avaliação para este
estudo.
Referências
- Takahashi
T, Aoki M, Suzuki N, Tateyama M, Yaginuma C, Sato H, et al. Clinical features
and a mutation with late onset of limb girdle muscular dystrophy 2B. J Neurol
Neurosur Ps 2013;84(4):433-40. doi: 10.1136/jnnp-2011-301339 [Crossref]
- Harris E, Bladen CL, Mayhew A, James M, Bettinson K, Moore U, et al. The clinical outcome study for dysferlinopathy: an international multicenter study. Neurol Genet 2016;2(4):e89. doi: 10.1212/NXG.0000000000000089 [Crossref]
- Manzur AY, Muntoni, F. Diagnosis and new treatments in muscular dystrophies. J NeurolNeurosur Ps 2009;80(7):706-14. doi: 10.1136/jnnp.2008.158329 [Crossref]
- Eulate FG, Querin G, Moore U, Behin A, Masingue M, Bassez G. Deep phenotyping of an international series of patients with late-onset dysferlinopathy. Eur J Neurol 2021;28(6):2092-102. doi: 10.1111/ene.14821 [Crossref]
- Nigro V,
Savarese M. Genetic basis of limb-girdle muscular dystrophies: the 2014. Acta
Myol [Internet]. 2014 [cited 2021 Dec 4];33(1):1-12. Available from:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4021627/
- Diniz G, Eryaşar G, Türe S, Akçay A, Ortaç R, Tekgül H, et al. A regional panorama of dysferlinopathies. Turk Patoloji Derg 2012,28:259-65. doi: 10.5146/tjpath.2012.01133 [Crossref]
- Wicklund MP, Kissel JT. The limb-girdle muscular dystrophies. Neurol Clin 2014;32(3):729-49. doi: 10.1016/j.ncl.2014.04.005 [Crossref]
- Medical
Research Council. Aids to the examination of the peripheral nervous system.
Memorandum No. 45 (superseding War Memorandum No. 7) [Internet]. London: Her
Majesty's Stationery Office. 63p.1976. [cited 2021 Dec 4]. Available from: https://www.mrc.ac.uk/research/facilities-and-resources-for-researchers/mrc-scales/mrc-muscle-scale
- Scott OM, Hyde SA, Goddard C, Dubowitz V. Quantitation of muscle function in children: a prospective study in Duchenne muscular dystrophy. Muscle Nerve 1982;5(4):291-301. doi: 10.1002/mus.880050405 [Crossref]
- Carvalho
EV, Caromano FA. Criação e análise de confiabilidade de escala de avaliação
funcional da marcha para crianças com distrofia muscular de Duchenne.
[Dissertation] [Internet]. São Paulo: Universidade de São Paulo; 2013.
Available from:
http://www.teses.usp.br/teses/disponiveis/5/5170/tde-10122013-121610/pt-br.php
- Gardner-Medwin
D, Walton JN. Disorders of voluntary muscle. Edinburg: Churchill Livingstone;
1974; p.517-60.
- Martinez JA, Brunherotti MA, de Assis MR, Sobreira CF. Validation of the EK functional motor scale in the Portuguese language. Rev Assoc Med Bras (1992) 2006;52(5):347-51. doi: 10.1590/S0104-42302006000500024 [Crossref]
- Scott E, Eagle M, Maythew A, Freeman J, Main M, Sheehan J, et al. North Star Clinical Network for Paediatric Neuromuscular Disease. Development of a functional assessment scale for ambulatory boys with Duchenne muscular dystrophy. Physiother Res Int 2012;17(2):101-9. doi: 10.1002/pri.520 [Crossref]
- Nalini A, Gayathri N. Dysferlinopathy: a clinical and histopathological study of 28 patients from India. Neurol India 2008;56(3):379-85; discussion 386-7. doi: 10.4103/0028-3886.40964 [Crossref]
- Vainzof
M, Anderson LV, McNally EM, Davis DB, Faulkner G, Valle G, et al. Dysferlin protein
analysis in limb-girdle muscular dystrophies. J Mol Neurosci 2001;17(1):71-80. doi: 10.1385/JMN:17:1:71 [Crossref]
- Rosales XQ, Gastier-Foster JM, Lewis S, Vinod M, Thrush DL, Astbury C, et al. Novel 21. doi: 10.1002/mus.21650 [Crossref]
- Zhao Z, Hu J, Sakiyama Y, Okamoto Y, Higuchi I, Li N, et al. DYSF mutation analysis in a group of Chinese patients with dysferlinopathy. Clin Neurol Neurosurg 2013;115(8):1234-7. doi: 10.1016/j.clineuro.2012.11.010 [Crossref]
- Gómez-Díaz B, Rosas-Vargas H, Roque-Ramírez B, Meza-Espinoza P, Ruano-Calderón LA, Fernández-Valverde F, et al. Immunodetection analysis of muscular dystrophies in Mexico. Muscle Nerve 2012;45:338-45. doi: 10.1002/mus.22314 [Crossref]
- Shin HY, Jang H, Han JH, Park HJ, Lee JH, Kim SW, et al. Targeted next-generation sequencing for the genetic diagnosis of Dysferlinopathy. Neuromuscular Disord 2015;25(6):502-10. doi: 10.1016/j.nmd.2015.03.006 [Crossref]
- Mahjneh I, Marconi G, Bushby K, Anderson LVB, Tolvanen-Mahjneh H, Somer H. Dysferlinopathy (LGMD2B): a 23-year follow-up study of 10 patients homozygous for the same frameshifting dysferlin mutations. Neuromuscular Disord 2001;11(1):20-6. doi: 10.1016/S0960-8966(00)00157-7 [Crossref]
- Linssen WH, Voogt WG, Krahn M, Bernard R, Levy N, Wokke JH, et al. Long-term follow-up study on patients with Miyoshi phenotype of distal muscular dystrophy. Eur J Neurol 2013;20(6):968-74. doi: 10.1111/ene.12129 [Crossref]
- Klinge L, Aboumousa A, Eagle M, Hudson J, Sarkozy A, Vita G, et al. New aspects on patients affected by dysferlin deficient muscular dystrophy. J Neurol Neurosur Ps 2010;81(9):946-53. doi: 10.1136/jnnp.2009.178038 [Crossref]
- Nguyen K, Bassez G, Krahn M, Bernard R, Laforêt P, Labelle V, et al. Phenotypic study in 40 patients with dysferlin gene mutations: high frequency of atypical phenotypes. Arch Neurol 2007;64(8):1176-82. doi: 10.1001/archneur.64.8.1176 [Crossref]
- Illa I,
Serrano-Munuera C, Gallardo E, Lasa A, Rojas-García R, Palmer J, et al. Distal
anterior compartment myopathy: a dysferlin mutation causing a new muscular
dystrophy phenotype. Ann Neurol 2001;49(1):130-4.
https://pubmed.ncbi.nlm.nih.gov/11198284/
- Horlings CGC, Küng UM, van Engelen BGM, Voermans NC, Hengstman GJ, van Der Kooi AJ, et al. Balance control in patients with distal versus proximal muscle weakness. Neuroscience 2009;164(4):1876–86. doi: 10.1016/j.neuroscience.2009.09.063 [Crossref]
- Guglieri M, Magri F, D’Angelo MG, Prelle A, Morandi L, Rodolico C, et al. Clinical, molecular, and protein correlations in a large sample of genetically diagnosed Italian limb girdle muscular dystrophy patients. Hum Mutat 2008;29:258-66. doi: 10.1002/humu.20642 [Crossref]
- Barthélémy F, Wein N, Krahn M, Lévy N, Bartoli M. Translational research and therapeutic perspectives in dysferlinopathies. Mol Med 2011;17(9-10):875-82. doi: 10.2119/molmed.2011.00084 [Crossref]
- Mahmood OA, Jiang XM. Limb-girdle muscular dystrophies: Where next after six decades from the first proposal (Review). Mol Med Rep 2014;9(5):1515-32. doi: 10.3892/mmr.2014.2048 [Crossref]
