ARTIGO
ORIGINAL
Estudo
comparativo da ação anti-inflamatória do óleo-resina da Copaifera reticulata em modelos farmacológicos experimentais em
camundongos
Comparative study of oleoresin of copaiba species Copaifera
reticulata as anti-inflammatory in experimental
models in mice
Denilson Henrique
Silva de Miranda, Ft., M.Sc.*, José Wagner Cavalcante
Muniz, Ft., D.Sc.*, Daniela Pinheiro da Silva, Ft., M.Sc.*
*Universidade
Federal do Amapá
Endereço
para correspondência:
Denilson Henrique Silva de Miranda, Rua Mercúrio, 976, Jardim Marco Zero
68903-383 Macapá AP, E-mail: denilsonmiranda@gmail.com.br, José Wagner
Cavalcante Muniz: jwcmuniz@gmail.com, Daniela Pinheiro da Silva: dani.spinheiro@yahoo.com.br
Resumo
Na Região Amazônica o
uso do óleo das árvores copaibeiras é tão extenso, que a copaíba se destaca
como a planta medicinal mais utilizada e conhecida pela população amazônica.
Existem diversas indicações para a utilização do óleo-resina de copaíba com
pouco respaldo científico. Avaliar a ação do óleo-resina de copaíba da espécie
Copaifera reticulata como anti-inflamatório em modelos experimentais de reação
inflamatória aguda foi o objetivo desta pesquisa. Para isso, foram utilizados 4 grupos de 7 camundongos da linhagem Swiss Webster, que receberam tratamento veiculado com o ultrassom,
e o óleo-resina extraído de árvore da espécie Copaífera reticulata. O modelo de inflamação aguda bolsa de ar (air pouch) induzida por carragenina foi
utilizado para avaliar o efeito anti-inflamatório do óleo-resina de copaíba (in natura). As análises ocorreram no
exsudato que foi avaliado quanto ao conteúdo total de proteínas, número total
de leucócitos e análise celular. Para análise estatística foi eleito o teste de
Kruskal-Wallis com nível de significância alfa = 0,05. As células totais e as
mononucleares não mostraram diferenças estatisticamente significantes entre si
nem em relação ao grupo copaíba. A comparação do nível de proteínas apresentou
diferença significativa (p-valor < 0,01) entre o grupo controle (0,2608 ±
0,1557) e o grupo tratado por carragenina (0,597 ± 0,152). Foi observada
diferença real (1,4 neutrófilos) entre os grupos carragenina (2,0079 ± 1,5231)
e o grupo copaíba (0,6063 ± 0,32). Conclui-se que a atividade anti-inflamatória
do óleo-resina é potencialmente importante como fonte de princípios ativos e
que o ultrassom proporcionou a facilitação e aceleração da penetração
transcutânea do óleo-resina de copaíba, favorecendo o seu uso tópico.
Palavras-chave: copaifera
reticulata, edema de pata, análise celular.
Abstract
In the Amazon region the use of oil of copaibeira
trees is so extensive that the copal stands out as the most known medicinal
plant used by Amazonian population. There are several indications for the use
oleoresin of copaiba with little scientific backing. The aim of this study was
to evaluate the effects of oleoresin of copaiba species Copaifera
reticulata as anti-inflammatory in experimental
models of acute inflammatory reaction. For this, we used 28 mice of Swiss
Webster strain, who received treatment with ultrasound aired, and oleoresin
extracted from Copaifera reticulata.
The model of acute inflammation air pouch induced by carrageenan was used to
evaluate the anti-inflammatory effect of oleoresin of copaiba (fresh). The
analysis occurred in the exudate analyzed for total protein content, total
number of leukocytes and cell analysis. For statistical analysis was elected
the Kruskal-Wallis test with significance level alpha
= 0.05. Total cells and mononuclear cells showed no statistically significant
differences among themselves or in relation to the group copal. The comparison
of protein level showed a significant difference (p-value < 0.01 *), saline
was lower (0.2608 ± 0.1557) than carrageenan (0.597 ± 0.152). Real difference
was observed (1.4 neutrophils) between groups
carrageenan (2.0079 ± 1.5231) and the group copaíba
(0.6063 ± 0:32). We concluded that the anti-inflammatory activity of the
oleoresin is potentially important as a source of active ingredients and
provided that ultrasound facilitation and acceleration of transcutaneous
penetration of the copaiba oil, favoring its topical use.
Key-words: copaifera
reticulata, paw edema, cellular analysis.
Introdução
Popularmente
conhecidas como copaibeiras ou pau d’óleo, as copaíbas são encontradas
facilmente nas Regiões Amazônica e Centro-Oeste do Brasil [1]. Existem várias
espécies abundantes, entre as quais podemos citar a Copaifera reticulata, que está presente apenas no Brasil, na
Amazônia brasileira. Estudos registram a sua ampla presença no estado do Pará,
mas também pode ser encontrada no sudoeste do Amapá, sudeste
de Roraima e norte do Mato Grosso [2].
A composição química
do óleo de copaíba é rica em sesquiterpenos e diterpenos de diferentes
concentrações [3] e o ácido copálico a única substância encontrada em todos os
óleos analisados, razão pela qual se sugere que seja um marcador biológico de
óleos de copaíba [1].
Devido à ampla
utilização do óleo de copaíba, muitos estudos foram realizados sobre este
gênero, com mais de 200 publicações em diversas áreas. Contudo muitos dados
sobre a composição química e a atividade farmacológica do óleo de copaíba são
contraditórios [1,4].
Muitos produtos
derivados de metabólitos secundários de plantas são conhecidos por interferir
direta ou indiretamente em moléculas ou mecanismos envolvidos no processo
inflamatório.
Dentre os grupos
químicos mais comuns de origem natural com possível efeito anti-inflamatório
podemos citar: compostos fenólicos, lignanas, terpenos (sesquiterpenos,
diterpenos, triterpenos, clerodanos e saponinas), alguns fitoesteróides e
alcaloides [5,6].
Apesar do crescente
interesse na fitoquímica, poucos compostos derivados de plantas têm sido
submetidos a triagens clínicas para confirmar seu potencial efeito
anti-inflamatório. Estes estudos são necessários para confirmação da eficácia
destes produtos bem como sua aplicação com segurança em processos inflamatórios
[6].
Existem diversas
indicações para a utilização do óleo-resina de copaíba com pouco respaldo
científico, muitas delas citadas em diversos trabalhos científicos. As
propriedades já comprovadas por meio de modelos experimentais são:
anti-inflamatória, cicatrizante, analgésica e gastroprotetora [7].
Diante das variadas aplicações
terapêuticas dos óleos de copaíba, são muito reduzidos os estudos
farmacológicos descritos até o momento, para estes óleos. A grande maioria
destes estudos não indica a espécie de onde proveio o óleo, nem informam a
época e o local de coleta. A ausência destas informações abre uma grande lacuna
de incertezas em relação à autenticidade destes óleos, uma vez que estudos
sobre a autenticidade de 16 diferentes tipos de óleos de copaíba comerciais,
por cromatografia gasosa de alta resolução, mostraram que em grande parte,
óleos de copaíba diferentes são misturados. Além disso, foi comprovada também
adulteração, possivelmente com óleo de soja. Estudos etnobotânicos relacionados
aos óleos de copaíba relatam que nem todas as árvores exudam óleos apropriados
para o uso medicinal [8].
A
Fisioterapia: o ultrassom terapêutico como recurso físico anti-inflamatório
A Fisioterapia atua
como tratamento coadjuvante na recuperação dos tecidos orgânicos lesados se
utilizando de vários métodos e técnicas que visam de um modo geral melhora do
bem-estar físico e psíquico do indivíduo [9]. O mais comum é o emprego da
terapia por ultrassom nas lesões de partes moles, objetivando os efeitos
antiálgico, antiedema, anti-inflamatório e de aceleração na recuperação do tecido
lesionado [10].
No entanto, a
utilização do ultrassom como sonoforese não é utilizado no cotidiano dos
serviços de fisioterapia [11]. A sonoforese ou fonoforese é a energia
ultrassônica utilizada para introduzir componentes ativos de fármacos de forma
transdérmica; é uma forma ou sistema especial de acoplamento direto, que
realiza o transporte transdérmico através das ondas ultrassônicas para
facilitar a introdução dos fármacos aplicados topicamente [12-15].
Trata-se de um método
vantajoso, pois a droga não é introduzida de forma invasiva, penetrando no
tecido de forma tópica, evitando a eliminação metabólica da droga, pois esta
não passa pelo fígado [16]. Em contrapartida a desvantagem é que há baixa
permeabilidade através da pele [12,13,17]. A indução à
absorção transcutânea de drogas pela sonoforese se baseia na perturbação
tecidual, ou seja, na mudança da estrutura das camadas cutâneas [10]. O
ultrassom aumenta a penetração transcutânea por pressão somática, podendo
chegar a média a atingir entre 4-5 cm de profundidade [12]. Pode ser aplicado
com um gel ou óleo medicamentoso como meio de acoplamento do transdutor
ultrassônico.
Verificou-se a
necessidade de estudar o mecanismo anti-inflamatório de ação do óleo-resina de
capaíba da espécie Copaifera reticulata,
a espécie mais comum na região amazônica, particularmente no Estado do Pará.
Quanto as suas vias de aplicações em concentrações não tóxica aliada a vantagem
da fonoforese por ser uma técnica não invasiva. Em fase da eficácia das
diversas vias de aplicação ainda não possuírem um modelo comparativo
experimental que seja totalmente comprovada existindo, portanto, controvérsias,
o que remota a este motivo da realização do presente estudo. Portanto, o
presente trabalho visou a comprovação científica da
utilização do óleo-resina de Copaíba da espécie Copaifera Reticulata como moduladora da resposta inflamatória aguda
(air pouch) em diferentes modelos
farmacológicos inflamatórios experimentais em camundongos.
Material
e métodos
O trabalho foi
aprovado pelo Comitê de Ética em Pesquisa de Animais da Universidade do Estado
do Pará - UEPA, através do protocolo nº 44/08. Tendo anuência do Comitê de
Ética em Pesquisa com Animais da Fundação Instituto Oswaldo Cruz – Fiocruz/RJ.
A pesquisa desenvolvida no Laboratório de Neuroquímica e Biologia Celular da
Universidade Federal do Pará (UFPA) e no Laboratório de Imunofarmacologia –
Pavilhão Ozório de Almeida - Fundação Instituto Oswaldo Cruz – Fiocruz/RJ.
Animais
experimentais
Foram utilizados 28
camundongos da linhagem Swiss Webster
(SW) machos; com idade entre 6 e 8 semanas; peso
variando entre 20 e 35 g, procedentes do Centro de Criação de Animais de
Laboratório (CECAL) da Fundação Instituto Oswaldo Cruz – Fiocruz/RJ.
Equipamento
de ultrassom
Os grupos receberam tratamento
veiculado com o ultrassom terapêutico, modelo Sonacel expert da marca Bioset -
Indústria de Tecnologia Eletrônica Ltda. Os parâmetros físicos utilizados
foram: frequência de 3 MHz, área de irradiação efetiva
(ERA) 3,6 cm²; modo de corrente pulsado (frequência do pulso = 100 Hz – 1/2);
intensidade média de 0,4 W/cm²; durante 5 minutos, em movimento circular
horário do cabeçote em toda a extensão da região da pata direita na
conformidade da descrição de Durigan et
al. [18] e no modelo de bolsa de ar (air
pouch) descrito previamente por Selye [19] e adaptado por Ghosh et al. [20].
Obtenção
do óleo de copaíba
O óleo-resina de
copaíba utilizado neste experimento foi extraído de árvore copaibeira da
espécie Copaífera reticulata, família
das Leguminosae (divisão Caesalpinioideae), aplicado na sua forma
pura a quantidade de 20 ml.
A coleta do óleo
ocorreu na Estação Científica Ferreira Penna (ECFPn),
Floresta Nacional de Caxiuanã, localizada no Município de Melgaço no Estado do
Pará, Estação Científica administrada pelo Museu Paraense Emílio Goeldi (MPEG)
em Belém/PA, autorizado através do Ofício MPEG/Caxiuanã nº 018/2008.
Preparo
do óleo-resina para tratamento tópico
Foi administrado de
forma tópica o óleo-resina de copaíba puro (in natura), utilizando 100 µl na bolsa
de ar (modelo inflamatório air pouch)
como forma padronizada da dose de óleo-resina de copaíba para esta pesquisa.
Fármaco
utilizado
Foi utilizado o
diclofenaco dietilamônio (DCB 0398.02-0) produzido pela Cristália Produtos químicos
Farmacêuticos Ltda., na forma farmacêutica de gel na dose de 11,6 mg/g, equivalente a diclofenaco de potássio 10 mg. O
excipiente utilizado era composto por dietilamina, carbopol 940, cetomacrogol
1000, álcool isopropílico, cera de ésteres do álcool cetílico, propilenoglicol,
metilparabeno, vaselina líquida, fragrância splash e água purificada. O
medicamento tem prazo de validade de 36 meses e deve ser armazenado sob temperatura entre 15 e 30º
Modelo
inflamatório de bolsa de ar (air pouch)
O modelo de bolsa de
ar (air pouch) foi utilizado para
avaliar o efeito anti-inflamatório do óleo-resina de copaíba da espécie Copaifera reticulata (in natura). Os camundongos SW machos (n
= 7/grupo) foram anestesiados com inalação de isoflurano e seus dorsos foram
desinfetados com álcool iodado. Um volume de 5 ml de
ar estéril (obtido através de captação dentro do fluxo laminar) foi injetado
via subcutânea no dorso dos animais formando uma cavidade (bolha). Três dias
depois, foi reinjetado 3 ml de ar estéril para a
manutenção da bolha. No sexto dia, a inflamação foi induzida pela injeção de 1 ml de carragenina 1% (em salina fisiológica estéril)
dentro da bolha para os grupos de inflamação; para o grupo controle,
utilizou-se solução salina. Uma hora antes da indução da inflamação, os animais
foram tratados, conforme a distribuição dos grupos de tratamento descritos a
seguir:
- Grupo experimental 1 (n = 7) – Carragenina + Óleo-resina de copaíba +
Ultrassom: animais tratados com o óleo-resina de Copaifera reticulata (in natura) veiculada de forma tópica através
do ultrassom (frequência de 03 MHz; área de irradiação efetiva (ERA) 3,6 cm²;
modo de corrente pulsado (frequência do pulso = 100 Hz – 1/2); intensidade
média de 0,4 W/cm², durante 5 min, em movimento circular horário do cabeçote)
na região epilada da bolsa de ar;
- Grupo experimental 2 (n = 7) – Carragenina + Diclofenaco dietilamônio +
Ultrassom: animais tratados com o diclofenaco dietilamônio na dose de 11,6 mg/g
de forma tópica através de ultrassom (frequência de 3 MHz; área de irradiação
efetiva (ERA) 3,6 cm²; modo de corrente pulsado (frequência do pulso = 100 Hz –
1/2); intensidade média de 0,4 W/cm², durante 5 min, em movimento circular
horário do cabeçote), na região epilada da bolsa de ar;
- Grupo experimental 3 (n= 7) – Carragenina + óleo mineral + Ultrassom: O grupo
de animais recebeu somente injeção de carragenina dentro da bolsa de ar e
recebeu aplicação de óleo mineral forma tópica através de ultrassom (frequência
de 03 MHz; área de irradiação efetiva (ERA) 3,6 cm²; modo de corrente pulsado
(frequência do pulso = 100 Hz – 1/2); intensidade média de 0,4 W/cm², durante 5
min, em movimento circular horário do cabeçote), na região epilada da bolsa de
ar;
- Grupo experimental 4 (n = 7) – Solução salina + óleo mineral + Ultrassom: O
grupo recebeu somente solução salina fisiológica estéril (1 mL) injetada dentro
da bolsa de ar e recebeu aplicação de óleo mineral forma tópica através de
ultrassom (frequência de 3 MHz; área de irradiação efetiva (ERA) 3,6 cm²; modo
de corrente pulsado (frequência do pulso = 100 Hz – 1/2); intensidade média de
0,4 W/cm², durante 5 min, em movimento circular horário do cabeçote), na região
epilada da bolsa de ar.
Ao término da
administração das condutas terapêuticas nos grupos tratados, os camundongos
foram sacrificados por inalação de CO2. As cavidades subcutâneas foram
cuidadosamente abertas e lavadas com 1 mL de salina
fisiológica com EDTA 2mM. Os exsudatos foram coletados e imediatamente
acondicionados em gelo. O exsudato foi analisado quanto ao volume (descontado o
volume de solução fisiológica injetada), conteúdo total de proteínas, número
total de leucócitos e análise celular.
Contagem
total de leucócitos
A contagem de
leucócitos totais foi realizada diluindo-se (1:20) uma
alíquota do exsudato em solução de violeta de genciana a 1% em salina
fisiológica. A contagem das células foi realizada em câmara de Neubauer, por microscopia de luz. A
concentração de células presentes na cavidade foi obtida multiplicando-se o
número de células contadas na câmara de Neubauer
pelo fator de correção da câmara e pelo fator de diluição das amostras,
expressa em número de leucócitos totais x 106 /mL de exsudato.
Estudo
estatístico
Para avaliar as
hipóteses referentes à atividade antiedematogênica nas concentrações do óleo-resina
de copaíba da espécie Copaifera
reticulata foi aplicada a análise de variância (ANOVA), com múltiplas
comparações pelo pós-teste de Tukey, com nível de significância
? = 0,05 para rejeição da hipótese nula. O processamento dos dados foi
suportado pelos softwares BioEstat versão 5.0 e Graph
Pad PRISM versão 4.
Resultados
Modelo
inflamatório de bolsa de ar (air pouch)
Na avaliação
transversal, após 5 min de intervenção, a expressão das variáveis: células totais
e células mononucleares não mostraram diferenças estatisticamente significantes
entre si nem em relação ao grupo copaíba.
A comparação do nível
de proteínas apresentou diferença significativa (p-valor < 0,01) somente
entre Salina (0,2608 ± 0,1557) e Carragenina (0,597 ± 0,152), ou seja, foi
evidente apenas que a inflamação na bolsa de ar (air pouch) foi menor na Salina quando comparada com a Carragenina.
Foi observada
diferença real (1,4 neutrófilos) entre os grupos Carragenina (2,0079 ± 1,5231)
e o grupo Copaíba (0,6063 ± 0,32) o p-valor = 0,049 indica que esta diferença é
estatisticamente significante, conforme é mostrado na tabela I e evidenciado na
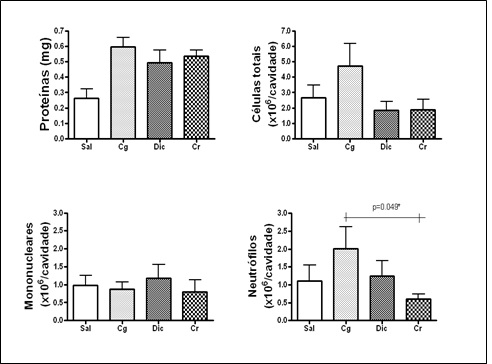
figura 1.
A figura 1 evidencia
a redução significativamente estatística na quantidade de células neutrófilos
(p < 0,05) no grupo Copaíba em relação ao grupo Carragenina, o que leva a
constatação evidente da ação anti-inflamatória do óleo-resina de copaíba.
Tabela
I – Avaliação do efeito da fonoforese de Copaíba
in natura sobre o Air pouch em relação a 3 grupos
controle: salina, carragenina e diclofenaco, realizada através da contagem do
número de células.
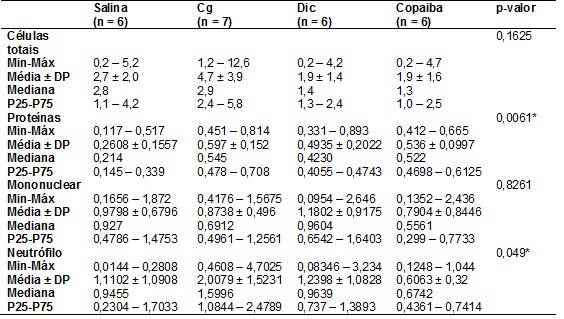
*Teste ANOVA 1 criterio post-hoc de Tukey
Figura
1 – Efeito do tratamento com as doses de
Copaifera reticulata na contagem total do número de células, no número de
proteínas, na migração de monócitos e neutrófilos induzida por carragenina no
modelo de air pouch.
Discussão
O modelo de air pouch, primeiramente descrito por
Selye [19] e adaptado por Ghosh et al. [20], tem sido
utilizado para estudar os mecanismos envolvidos na resposta inflamatória. Neste
modelo o exsudato inflamatório é coletado, podendo ser utilizado para diversas
análises. Em uma segunda abordagem, este modelo permite a pesquisa de drogas
antirreumáticas, uma vez que a cavidade não inflamada é limitada por uma fina
camada de fibroblastos e macrófagos, semelhante à cavidade sinovial [21]. A
injeção de um irritante no interior da cavidade induz uma resposta inflamatória
que se assemelha à observada na articulação reumatoide [22]. Estudos realizados
por García-Ramallo et al. [23] mostraram o papel das células
residentes na inflamação que, quando estimuladas, liberam TNF-?, responsável pela síntese de quimiocinas e, como
consequência, pela migração de leucócitos. Outras citocinas como IL-1 e IL-6
também participam deste processo.
Neste estudo foram
analisados os seguintes parâmetros no modelo air pouch: número de células na cavidade (exsudato) onde a inflamação
foi induzida e o volume de exsudato formado. O tratamento com o óleo-resina de
copaíba da espécie Copaifera Reticulata
in natura com aplicação tópica na região da bolsa de ar veiculada pelo
ultrassom inibiu a migração de células para o exsudato (Figura 1) com
significância estatística (p < 0,05), no entanto, não ocorreu uma inibição
na formação do exsudato (Figura 1) estatisticamente significante (p > 0,05).
A injeção de carragenina
na bolha, como supracitado, produz uma resposta inflamatória aguda
caracterizada pela infiltração de células, aumento da exsudação e produção de
mediadores inflamatórios, tais como prostaglandinas, leucotrienos e citocinas
[24]. A diminuição da exsudação sugere que parte do efeito anti-inflamatório do
óleo-resina de copaíba da espécie Copaifera
reticulata in natura pode ser atribuído à redução da permeabilidade
vascular. Pode ser sugerido, então, que um dos possíveis mecanismos envolvidos
na redução do processo inflamatório pelo óleo-resina de copaíba da espécie
Copaifera Reticulata in natura seja a inibição da migração de células para o
sítio inflamatório, o que poderia estar relacionado a
liberação de leucotrieno B4 (sintetizado pelo via da LOX), que é um potente
quimioatraente para neutrófilos. Quanto à redução do número de neutrófilos
ocorrida nos grupos copaíba (0,6063 ± 0,32) e diclofenaco (1,2398 ± 1,0828)
merece consideração a ação do óleo-resina de copaíba
da espécie Copaifera reticulata in natura, pois o decréscimo acentuado
no número de neutrófilos foi indicativo de uma ocorrência de inibição da
liberação de histamina, serotonina e/ou bradicinina (devido a inibição
observada na primeira hora) bem como a atividade da COX, LOX e/ou citocinas,
porém outros dados são necessários para comprovar estes efeitos.
Conclusão
O ultrassom facilitou
a aceleração da penetração transcutânea do óleo-resina de copaíba, favorecendo
o seu uso tópico, proporcionando um menor tempo de alcance do pico de ação
farmacológica, sendo, portanto, indicada a associação da fonoforese com
óleo-resina de copaíba como recurso a fazer parte do arsenal terapêutico da
fisioterapia.
Apesar da extensa
literatura que trata dos óleos de copaíba, poucos são os trabalhos que aprofundam
o conhecimento sobre uma determinada espécie, por isso o objetivo desta
pesquisa foi contribuir no estudo do potencial de ação biológica do óleo-resina
de copaíba da espécie Copaifera reticulata.
Tudo indica que o óleo-resina em estudo é potencialmente importante como fonte
de princípios ativos em farmacologia necessários a pesquisas científicas de
identificação de mecanismos de ação farmacológica isolada dos princípios ativos
contidos em seu composto.
Referências
- Veiga Júnior VF,
Pinto AC. O gênero Copaifera L. Química Nova 2002;25(2):273-86.
- Cascon V, Gilbert B. Characterization
of the chemical composition of oleoresins of Copaifera
guianensis Desf., Copaifera duckei
Dwyer and Copaifera multijuga
Hayne. Phytochemistry
2000;55:773-78.
- Martins-da-Silva RCV,
Pereira JF, Lima HC. O gênero copaifera (leguminosae – caesalpinioideae) na
Amazônia brasileira. Rodriguésia 2008;59(3):455-76.
- Oliveira FMM. Estudos
de Matéria Médica Vegetal. Escola Typographica Salesiana: São Paulo; 1905. p. 114.
- Calixto JB, Campos
MM, Otuki MF, Santos AR. Anti-inflammatory
compounds of plant origin. Part II. Modulation of
pro-inflammatory cytokines, chemokines and adhesion molecules. Planta Med 2004;70(2):93-103.
- Reis PA.
Fracionamento de Extratos de Baccharis trimera Less. DC. Biomonitorado pelo
Potencial Antiinflamatório [Tese]. Rio de Janeiro: UERJ; 2006. 147p.
- Souza-Júnior OG,
Damous SHB, Lamarão LG. Revisão crítica do uso do óleo de copaíba. Rev Par Med 2000;14(1):71-6.
- Maciel MAM, Pinto AC,
Veiga Junior VF. Plantas medicinais: a necessidade de estudos
multidisciplinares. Química Nova 2002;25(3):429-38.
- Lange F, Kroth A,
Steffani JA, Lorencetti N. Influência da laserterapia no processo cicatricial
de queimaduras de terceiro grau. Fisioter Bras 2003;4(5):335-40.
- Low J, Reed A.
Eletroterapia explicada. 3 ed. Barueri: Manole; 2001.
- Barreto JG, Matos AP.
Efeito da fonoforese de óleo de andiroba (Carapa guianensis) sobre o edema
inflamatório agudo [Dissertação]. Belém: Universidade do Estado do Pará; 1998.
- Agne JE.
Eletrotermoterapia Teoria e Prática. Santa
Maria/RS: Pallotti; 2004.
- Mitragotri S, Sundaram J, Mellein BR. An experimental and theoretical analysis of ultrasound-induced permeabilization of cell membranes. Biophysical
Journal 2003;84:3087-3101.
- Mitragotri S, Blankschtein D, Langer R. Ultrasound –
mediated transdermal protein delivery. Science
1995;269(5225):850-3.
- Brasileiro JS, Alves
TC, Escossia CC. Análise da transmissibilidade ultrassônica de medicamentos
utilizados na prática da fonoforese. Rev Bras Fisioter 2003;7(2):139-44.
- Starkey C. Recursos
terapêuticos em fisioterapia. 2 ed. São Paulo: Manole; 2001. 404p.
- Wu J, Chappelow J, Yang J, Weimann L. Defects
generated in human stratum corneum specimens by
ultrasound. Ultrasound Med Biol 1998;24(5):705-10.
- Durigan JLQ, Baretta IP, Costa CN, Borges HE. Efeitos do ultrassom
terapêutico pulsado associado à indometacina no edema de ratos artríticos. Fisioter Bras 2005;6(2):130-5.
- Selye H. Induction of topical resistance to acute tissue injury; an
experimental study with the granuloma pouch technique. Surg Clin North Am
1953;1417-46.
- Ghosh AK, Hirasawa N, Niki, H., OHUCHI, K.
Cyclooxygenase-2-mediated angiogenesis in carrageenan-induced granulation
tissue in rats. J Pharmacol Exp Ther
2000;295:802-9.
- Edwards JCW, Sedgwick AD, Willoughby DA. The formation of a structure with the features of synovial lining by
the subcutaneous injection of air: an in vivo tissue culture system. J Pathol 1981;134:147-56.
- Ellis L, Gilston V, Soo CC, Morris CJ, Ki
DDBL, Winyard PG. Activation of the transcription
factor NF-????B in the rat air pouch model of inflammation. Ann Rheum Dis 2000;59:303-7.
- Garcia-Ramallo E, Marques T, Prats N, Beleta J, Kunkel SL, Godessart N.
Resident cell chemokine expression serves as the major mechanism for leukocyte
recruitment during local inflammation. J Immunol 2002;169(11):6467-73.
- Yin LL, Zhang WY LI MH, Shen JK, Zhu XZ. CC05, a novel anti-inflammatory compound, exerts its effect by
inhibition of cyclooxygenase-2 activity. Eur J Pharmacol 2005;520(1-3):172-8.