Fisioter Bras 2022;23(4):551-62
ARTIGO
ORIGINAL
A
postura fletida está associada à independência funcional, mobilidade e
qualidade de vida em pessoas com doença de Parkinson?
The forward flexed posture is associated with
functional independence, mobility and quality of life in people with
Parkinson’s disease?
Hudson
Azevedo Pinheiro*, Tauana Calais Franco do
Nascimento**, Flávia Martins Gervásio***, Josevan
Cerqueira Leal**, Felipe Augusto dos Santos Mendes**
*Secretaria
de Saúde do Distrito Federal, Brasília, DF, **Programa de Pós-graduação em
Ciências de Reabilitação, Universidade de Brasília, Brasília, DF,
***Universidade Estadual de Goiás, Goiania, GO
Recebido
em 30 de abril de 2022; Aceito em 4 de julho de 2022.
Correspondência: Hudson Azevedo Pinheiro, Rua 36 Norte
lote 05 bloco A apto 401 Águas Claras 71919-180
Brasília DF
Hudson
Azevedo Pinheiro: hudsonap@gmail.com
Tauana Calais Franco do Nascimento:
tauanacalais@gmail.com
Flávia
Martins Gervásio: flavia.gervasio@hotmail.com
Josevan Cerqueira Leal: josevanleal@gmail.com
Felipe
Augusto dos Santos Mendes: felipemendes@unb.br
Resumo
Objetivo: Avaliar se a postura fletida (FFP)
está associada à independência funcional, mobilidade e qualidade de vida em
pacientes com doença de Parkinson (DP). Métodos: Estudo transversal e
comparativo em Brasília/DF. Para avaliar a FFP, foi utilizado o teste de
distância occipito-parede (DOP) e este foi comparado
com medidas de força muscular (preensão palmar, extensão dorsal e membros
inferiores), mobilidade funcional e qualidade de vida para verificar se há
associações entre eles. Também foi verificado se havia correlação entre o
estágio da doença, medido pela escala de Hoehn e Yahr (HY) e o tempo de diagnóstico. Resultados:
Foram observadas correlações fortes entre DOP e HY, tempo de diagnóstico e
qualidade de vida, e correlações moderadas entre marcadores de força muscular e
mobilidade em indivíduos com DP. Conclusão: O FFP medida pelo DOP está
fortemente associada com estágios de gravidade, tempo de diagnóstico e
qualidade de vida e moderado com força muscular e mobilidade reduzida em
pacientes com doença de Parkinson e representa uma medida simples e de baixo
custo para a prática clínica.
Palavras-chave: doença de Parkinson; postura fletida;
mobilidade; força muscular; qualidade de vida.
Abstract
Aim: To evaluate whether the forward
flexed posture (FFP) is associated with functional independence, mobility and
quality of life in patients with Parkinson’s Disease (PD). Methods: A
cross-sectional and comparative study in Brasilia/DF. To evaluate FFP, the
occiput-to-wall test (OWT) was used and this was compared with measures of
muscle strength (handgrip, dorsal extensors and lower limbs), mobility and
quality of life to verify associations between them. It was also verified if
the correlations between stage of the disease, measured by the Hoehn and Yahr (HY) scale and time of diagnosis. Results:
Strong correlations were observed between OWR and HY, time of diagnosis and
quality of life, and moderate correlations between markers of muscular strength
and mobility in individuals with PD. Conclusion: The FFP measured by OWT
is significantly correlated with severity stages, time of diagnosis and quality
of life and moderately correlated with muscle strength and reduced mobility in
patients with Parkinson's disease and represents a simple and low cost measure
for clinical practice.
Keywords: Parkinson`s disease; forward
flexed posture; mobility; muscle strength; quality of life.
Introdução
Alterações
na posição do centro de massa em relação à base de apoio são influenciadas por
mudanças na posição do tronco durante a realização das atividades da vida
diária (AVD) e estão associadas a ativação muscular para estabilização,
proporcionando uma postura adequada [1,2].
Uma
alteração comumente observada nos sujeito com DP é a forward
flexed posture (FFP) ou
postura fletida, que é definida como posição de anteriorização
da cabeça, flexão anterior do tronco e a flexão do joelho, que pode resultar no
deslocamento anterior do centro de gravidade e no alargamento da base de
suporte, manifestada clinicamente como dificuldade para andar e girar,
tendência a cair e dificuldade para girar ou incapacidade de girar na cama,
podendo ser acompanhada de fraqueza dos extensores das costas e rigidez da
coluna vertebral com ou sem dor associada [3,4,5].
Uma
revisão sistemática demonstrou que o DOP é um
método válido e confiável para
medir a FFP em sujeitos com DP demonstrando ser uma ferramenta
prática e de
fácil realização para a prática
clínica, e com correlações com o avanço da
doença [6].
A
FFP pode ocasionar fraqueza dos músculos extensores do tronco e comprometer o
equilíbrio e as reações de proteção; isso pode limitar a tarefas como
levantar-se de uma cadeira, manter a posição em pé e girar o tronco durante a
marcha, portanto, possíveis relações entre essas alterações posturais e outras
medidas que poderiam ser alteradas na DP devem ser estudadas, incluindo seus
impactos na qualidade de vida [7,8].
Portanto,
o objetivo do presente estudo foi investigar se a FFP está associada à
independência funcional, mobilidade e qualidade de vida em sujeitos com DP.
Métodos
Trata-se
de um estudo transversal e comparativo, a amostra foi selecionada e recrutada
em um ambulatório de fisioterapia em Brasília (Distrito Federal, Brasil), no
período de julho a dezembro de 2019. O estudo foi aprovado pelo Comitê de Ética
em Pesquisa sob parecer 129.071/2012, e todos os participantes assinaram o
Termo de Consentimento Livre e Esclarecido.
Os
critérios de inclusão para os participantes com DP foram: diagnóstico
confirmado por um neurologista, estarem entre os estágios II-IV da escala Hoehn e Yahr modificada (HY), uma
vez que esses sujeitos precisariam ter algum envolvimento axial e possuir
marcha independente, mesmo que às custas de algum dispositivo auxiliar à
locomoção. Como critérios de exclusão utilizou-se parkinsonismo secundário,
outras doenças neurológicas, incapacidade cognitiva grave avaliada por mini exame do estado mental (MEEM) e fluência verbal (FV), história
de cirurgias anteriores em membros inferiores e coluna, deficiência visual autorreferida que comprometia o equilíbrio, além de recusa
em participar do estudo.
Para
formar o grupo controle (GC), foram selecionados indivíduos saudáveis, pareados
por sexo e idade, que apresentavam marcha independente. O critério de exclusão
adotado foi o mesmo do grupo com DP.
Os
participantes foram submetidos à avaliação clínica por um único pesquisador
experiente e treinado para tal finalidade.
A
FFP foi avaliada por meio do DOP, que avalia o posicionamento da coluna
cervical, é indicativo de cifose anterior da cabeça e torácica e apresenta alta
confiabilidade para a população com DP. Para a realização do teste, o paciente
ficou em pé, com os calcanhares encostado na parede e manteve o tronco reto,
sem flexionar os joelhos; uma fita métrica foi usada para determinar a
distância entre a parede e a protuberância occipital externa, sendo considerado
normal o teste quando a cabeça encostar na parede [6,9].
Para
avalia a independência funcional aplicou-se o Índice de Barthel
é uma escala que determina o nível de independência de um indivíduo em relação
ao desempenho das AVD básicas e fundamentais; os escores variaram de 0 a 100,
sendo que 0 significa maior dependência e 100 total independência para realizar
as tarefas do dia-a-dia e é válido e confiável para ser utilizado na população
com DP [10].

Figura
1 - Posição do
sujeito para realizar o OWT, em pé e tronco reto. Distância determinada em fita
métrica
O
teste Timed Up and Go (TUG) avalia a mobilidade funcional da população
idosa, sendo considerado válido para pessoas com DP (Kappa = 0,72); é
registrado o tempo que o participante leva para se levantar de uma cadeira,
caminhar três metros na maior velocidade possível, sem correr, voltar e
sentar-se na mesma cadeira com as costas apoiadas [11,12].
Para
a mensuração de força muscular utilizaram-se os testes: força de preensão
palmar medida com o dinamômetro Jamar® com
confiabilidade teste-reteste das medidas de força de
preensão (ICC = 0,97 para a mão dominante e ICC = 0,98 para a mão não
dominante) [13] e para avaliação da força dos músculos extensores do tronco,
foi utilizado o dinamômetro lombar CROWN®; os pacientes permaneceram em pé na
base do aparelho com o tronco fletido, joelhos estendidos, cotovelos
estendidos, mãos pronadas e segurando a barra do
aparelho e realizaram extensão de tronco [14].
Para
ambos os testes, foi permitida a tentativa de familiarização e o melhor
desempenho e foi registrado, entre as três tentativas realizadas por cada
paciente, com intervalo de um minuto entre elas.

Figura
2 - Contração
isométrica voluntária máxima dos músculos das costas
O
teste de sentar para levantar cinco vezes (SL) tem sido frequentemente
utilizado para medir a força dos membros inferiores, e na DP pode ser positivo
cair quando o indivíduo realizou menos de 16 segundos (sensibilidade 0,75 e
especificidade 0,68) [15].
A
avaliação da velocidade da marcha (VM) é um instrumento de rápida
aplicabilidade, que avalia o risco de desfechos como internação, fragilização,
além do desempenho funcional; para sujeitos com DP foi preconizado o tempo que
o sujeito levou para caminhar 10 metros em velocidade usual, excluindo a
aceleração e a desaceleração [16,17].
A
qualidade de vida foi mensurada por meio do questionário PDQ-8, que identifica
os impactos causados pela doença levando em consideração os domínios
mobilidade, AVD, bem-estar emocional, estigma, suporte social, cognição,
comunicação, além de desconforto corporal. Logo quanto maior a pontuação, pior
a qualidade de vida [18].
Todas
as análises foram realizadas no SPSS versão 25.0, a amostra foi caracterizada
por estatística descritiva e apresentada em média, desvio padrão e intervalo de
confiança. O tamanho da amostra foi determinado por meio do software G * Power
3.1.9.2 (Franz Faul, Universitat
Kiel, Alemanha), considerando os valores de OWT obtidos, a amostra necessária
foi de 22 obtendo tamanho de efeito 1,68, significância de 95% e poder de 0,95
para o DOP.
A
análise inferencial foi realizada comparando as médias dos dois grupos
avaliados pelo teste T de Student e Mann-Whitney.
As
análises das relações entre as variáveis, no GP, foram medidas pelo Coeficiente
de Correlação de Pearson para os dados paramétricos e Correlação de Spearman para os dados não paramétricos, com valores
variando de < 0,3 relação fraca, 0,3-0,6 relação moderada,> 0,6 relação
forte e 1,0 relação ótima. O nível de confiança estatística na análise adotada
foi p < 0,05.
Resultados
As
características clínicas e demográficas dos participantes estão apresentadas na
tabela I. A amostra entre os grupos foi homogênea, diferindo apenas quanto ao
diagnóstico clínico (DP).
Tabela
I - Dados de
caracterização e comparação da amostra do grupo Parkinson e do grupo controle
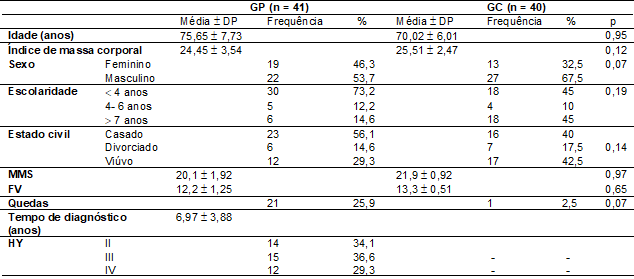
GP
= grupo Doença Parkinson; GC = grupo controle; MMS =
mine-exame do estado mental; FV = fluência verbal; HY = Escala de Hoehn e Yahr modificada; Teste de
t Student
A
tabela II mostra o desempenho do DOP e da força extensora de idosos com e sem
DP. Houve diferenças estatisticamente significativas entre os grupos
demonstrando que o FFP é um fator que pode limitar funcionalmente essas
pessoas.
Tabela
II - Comparação
entre as características da postura flexionada para frente nos grupos DP e
controle

Teste
de t Student; *p < 000,1
A
Tabela III mostra as relações entre as variáveis no GP. Observou-se forte
correlação entre o DOP e HY, tempo diagnóstico e qualidade de vida para DP e
moderada entre força muscular e velocidade da marcha.
Tabela
III - Correlações do
teste occipital-a-parede com os testes de capacidade funcional, força muscular
e mobilidade no GP

PDQ8
= Questionário de qualidade de vida na Doença de Parkinson; Correlação de
Pearson
Discussão
Este
estudo teve como objetivo avaliar a relação entre FFP e independência
funcional, mobilidade e desempenho da marcha em pacientes com DP. O aumento do
DOP foi associado com HY, tempo de diagnóstico e qualidade de vida.
A
FFP implica na falta de movimento do pescoço, o que gera um risco potencial de
mau equilíbrio e quedas durante tarefas dinâmicas, conforme identificado por
estudos prévios [8,19,20]. Essa característica, tão comum em pacientes com DP,
influencia negativamente as variáveis relacionadas à capacidade funcional.
Antonelli
et al. [21] observaram a relação entre o DOP e o desempenho físico em
pacientes com DP, com média de 75 anos. Concluíram que existe associação entre
o posicionamento da cabeça e sentar e levantar da cadeira e entre o
posicionamento da cabeça e o equilíbrio estático, que representam funções
necessárias para a realização das AVD.
Embora
o aumento do DOP seja influenciado pela gravidade da doença medida pela escala
de HY, neste estudo não houve associação robusta com o grau de independência
para AVD.
Uma
hipótese levantada pelos autores foi que a fraqueza dos músculos extensores do
tronco influenciaria o aumento do DOP e porque a capacidade de manter a postura
e o equilíbrio está relacionada à força de extensão do tronco e declínio da
independência funcional em pacientes com DP [22,23], porém o estudo atual
mostrou associação moderada.
A
literatura mostra que existem alterações axiais mesmo nos estágios iniciais da
doença e que essas alterações no tronco promovem adaptações posturais que podem
comprometer as estratégias de equilíbrio, mobilidade, o que pode comprometer a
independência para AVD, diminuir a mobilidade e aumentar o risco de quedas,
além de prejuízos à qualidade de vida [24,25].
Cano-de-la-Cuerda et al. [26] realizaram
revisão sistemática com o objetivo de avaliar se havia fraqueza muscular em
indivíduos com DP, condição geralmente atribuída nas fases em que ocorreria
comprometimento bilateral em decorrência da doença. Esses autores descobriram
que as medidas de força isocinética demonstraram ter
alta confiabilidade em pacientes com DP, especialmente em velocidades mais
rápidas e, em combinação com a avaliação clínica, podem ser usadas como um
suplemento na avaliação dos sintomas e terapia nesses pacientes, restrito ao
ambiente de pesquisa.
Corcos et al. [27] relataram que à
medida que a doença progride, os músculos extensores tornam-se mais fracos que
os músculos flexores, levando a uma tendência de adoção do FFP, mas esse fato
não foi observado no presente estudo, que observou correlação moderada entre a
força de extensão dorsal e o DOP.
Jones
et al. [28] investigaram as medidas clínicas que teriam o maior impacto
na capacidade funcional de pessoas com DP: medidas de marcha, equilíbrio e
força de preensão manual foram concluídas e a eletromiografia foi examinada no
bíceps braquial, tríceps braquial, vasto-lateral e bíceps femoral durante um
dia de 6,5 horas e modelos de regressão múltipla passo a passo foram usados
para determinar a proporção de variância nas características de explosão explicada
por medidas clínicas de função física em DP e a força de preensão manual
poderia servir como uma ferramenta de avaliação clínica eficaz para determinar
mudanças em atividade muscular, que é um precursor da perda funcional em
pessoas com DP. No presente estudo, observamos correlação moderada entre a
preensão manual e o DOP.
A
rigidez axial é uma possível causa para FFP. Em pessoas com DP afetará
adversamente o desempenho das atividades cotidianas e está associada com
redução do equilíbrio em pé, alteração da biomecânica da marcha e aumento do
risco de quedas: Forsyth et al. [29]
verificaram esta associação em seu estudo utilizando os testes TUG, velocidade
da marcha e SL, e o DOP, mostrando forte correlação entre essas variáveis.
Também
se verificou essa associação entre o FFP e os marcadores de força e mobilidade
muscular, inclusive utilizando os mesmos instrumentos, porém as correlações
neste caso foram moderadas, talvez devido a características diferentes entre as
amostras.
Aspectos
da qualidade de vida, principalmente aqueles relacionados às transferências e
deslocamentos necessários à realização das AVD, além dos sintomas álgicos,
podem estar associados à PFP em sujeitos com DP, porém, Mikami
et al. [30] observaram em seu estudo correlações leves a moderadas com a
progressão dos estágios da doença medida por HY. No presente estudo, foram
encontradas fortes correlações mostrando o impacto que o FFT traz para esses
sujeitos.
Van
Uem et al. [31] verificaram a associação entre
menor mobilidade em pacientes com DP mensurada pelo TUG e longos tempos para
realizar tarefas diárias, impactando na qualidade de vida desses sujeitos.
Uma
limitação do estudo é a correlação moderada entre a força da extensão dorsal e
o FFT, hipótese que poderia justificar a piora postural com o avanço da doença,
porém o uso do DOP, por ser simples e de baixo custo, pode contribuir para a
permanência em acompanhar a evolução desses pacientes, principalmente no
contexto clínico.
Conclusão
Os
resultados sugerem que a postura fletida medida pelo teste da distância occipito-parede está fortemente correlacionada com estágios
de gravidade, tempo de diagnóstico e qualidade de vida na doença de Parkinson e
moderada para força muscular e mobilidade, sendo que este teste representa uma medida
simples e de baixo custo para a prática clínica e serve como um bom indicador
para a capacidade funcional, força muscular, mobilidade e qualidade de vida
nesta população.
Conflitos
de interesse
Os
autores declaram não haver conflitos de interesse
Fontes de
financiamento
Financiamento
próprio.
Contribuição
dos autores
Concepção
e desenho da pesquisa:
Pinheiro HA, Lopes FAZ; Coleta de dados: Pinheiro HA, Nascimento TC; Análise
e interpretação dos dados: Pinheiro HA, Leal JC; Análise estatística:
Pinheiro HA, Leal JC; Redação do manuscrito: Pinheiro HA, Nascimento TC;
Revisão crítica do manuscrito quanto ao conteúdo intelectual importante:
Gervásio FM, Leal JC, Mendes FAS
Referências
- Decullier E, Couris CM,
Beauchet O, Zamora A, Annweiler
C, Molina DP, et al. Falls’ and fallers’ profiles. J Nutr
Heal Aging 2010;14:602-08. doi: 10.1007/s12603-010-0130-x [Crossref]
- Hubble RP, Silburn PA, Naughton GA, Cole MH. Assessing stability in mild and moderate Parkinson’s disease: Can clinical measures provide insight? Gait Posture 2016;49:7-13. doi: 10.1016/j.gaitpost.2016.06.002 [Crossref]
- Pang MYC, Mak MKY. Trunk muscle strength, but not trunk rigidity, is independently associated with bone mineral density of the lumbar spine in patients with Parkinson’s disease. Mov Disord 2009;24(8):1176-1182. doi: 10.1002/mds.22531 [Crossref]
- Kashihara K, Imamura T. Clinical correlates of anterior and lateral flexion of the thoracolumbar spine and dropped head in patients with Parkinson’s disease. Parkinsonism Relat Disord 2012;18(3):290-3. doi: 10.1016/j.parkreldis.2011.11.012 [Crossref]
- Guimarães
MPA, Severino VCB, Pinheiro HA. Correlação entre funcionalidade e gravidade da
doença de Parkinson em idosos. Revista Geriatria & Gerontologia
[Internet] 2013 [cited 2022 Jul 4];(61):1-5. Available
from: https://cdn.publisher.gn1.link/ggaging.com/pdf/v7n3a08.pdf
- Nair P, Bohannon RW, Devaney L, Maloney C, Romano A. Reliability and validity of nonradiologic measures of forward flexed posture in Parkinson disease. Arch Phys Med Rehabil 2017;98(3):508-16. doi: 10.1016/j.apmr.2016.06.008 [Crossref]
- Heuft-Dorenbosch L, Vosse D, Landewé R, Spoorenberg A, Dougados M, Mielants H, et al. Measurement of spinal mobility in ankylosing spondylitis: comparison of occiput-to-wall and tragus-to-wall distance. J Rheumatol [Internet] 2004 [cited 2022 Jul 4];31(9):1779-84. Available from: https://pubmed.ncbi.nlm.nih.gov/15338500/
- Cromwell R, Schurter J, Shelton S, Vora S. Head stabilization strategies in the sagittal plane during locomotor tasks. Physiother Res Int 2004;9:33-42. doi: 10.1002/pri.298 [Crossref]
- Nair P, W. Bohannon R, Devaney L, Livingston J. Measurement of anteriorly flexed trunk posture in Parkinson’s disease (PD): a systematic review. Phys Ther Rev 2015;20(4):225-32. doi: 10.1179/1743288X15Y.0000000022 [Crossref]
- Morley D, Selai C, Thompson A. The self-report Barthel Index: preliminary validation in people with Parkinson’s disease. Eur J Neurol 2012;19(6):927-29. doi: 10.1111/j.1468-1331.2011.03592.x [Crossref]
- Silva BA, Faria CDCM, Santos MP, Swarowsky A. Assessing Timed Up and Go in Parkinson’s disease: Reliability and validity of Timed Up and Go Assessment of biomechanical strategies. J Rehabil Med 2017;49(9):723-31. doi: 10.2340/16501977-2254 [Crossref]
- Zampieri C, Salarian A, Carlson-Kuhta P, Aminian K, Nutt JG, Horak FB. The instrumented timed up and go test: potential outcome measure for disease modifying therapies in Parkinson’s disease. J Neurol Neurosurg Psychiatry 2010;81(2):171-6. doi: 10.1136/jnnp.2009.173740 [Crossref]
- Villafañe JH, Valdes K, Buraschi R, Martinelli M, Bissolotti L, Negrini S. Reliability of the handgrip strength test in elderly subjects with Parkinson disease. Hand 2016;11(1):54-8. Available from: https:// doi.org/10.1177/1558944715614852 [Crossref]
- Eichinger FLF, Soares AV, Carvalho JM, Da Silva Gevaerd M, Domenech SC, Borges NG. Dinamometria lombar: Um teste funcional para o tronco. Rev Bras Med Trab 2016;14(2):120-6. doi: 10.5327/Z1679-443520162415 [Crossref]
- Duncan RP, Leddy AL, Earhart GM. Five times
sit-to-stand test performance in Parkinson’s disease. Arch Phys Med Rehabil [Internet]. 2011 [cited 2022 Jul 4];92(9):1431-6.
Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3250986/
- Tanji H, Gruber-Baldini AL, Anderson KE, et al. A comparative study of physical performance measures in Parkinson’s disease. Mov Disord 2008;23(13):1897-905. doi: 10.1002/mds.22266 [Crossref]
- Fritz S, Lusardi M. Walking speed: the sixth
vital sign. J Aging Phys Act [Internet] 2015 [cited 2022 Jul 4];32(1):3-6.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4254896/
- Tan LCS, Luo N, Nazri M, Li SC, Thumboo J. Validity and reliability of the PDQ-39 and the PDQ-8 in English-speaking Parkinson’s disease patients in Singapore. Parkinsonism Relat Disord 2004;10(8):493-99. doi: 10.1016/j.parkreldis.2004.05.007 [Crossref]
- Benatru I, Vaugoyeau M, Azulay J. Postural disorders in Parkinson’s disease. Neurophysiol Clin 2008;38:459-65. doi: 10.1016/j.neucli.2008.07.006 [Crossref]
- De Sèze M, Falgairolle M, Viel S, Assaiante C, Cazalets JR. Sequential activation of axial muscles during different forms of rhythmic behavior in man. Exp Brain Res 2008;185(2):237-47. doi: 10.1007/s00221-007-1146-2 [Crossref]
- Antonelli-Incalzi R, Pedone C, Cesari M, Di Iorio A, S B, Ferrucci L. Relationship between the occiput-wall distance and physical performance in the elderly: A cross sectional study. Aging Clin Exp Res 2007;19(3):207-12. doi: 10.1007/BF03324691 [Crossref]
- Grossman GE, Leigh RJ, Abel LA, Lanska DJ, Thurston SE. Frequency and velocity of rotational head perturbations during locomotion. Exp Brain Res 1988;70:470-6. doi: 10.1016/S0300-8932(09)70025-9 [Crossref]
- Prince F, Winter D, Stergiou P, Walt S. Anticipatory control of upper body balance during human locomotion. Gait Posture 1994;2(1):19-25. doi: 10.1016/0966-6362(94)90013-2 [Crossref]
- Almeida LRS, Paul SS, Valenca
GT. Recurrent falls in people with Parkinson’s disease. In: Diagnosis and
Management in Parkinson’s Disease. Elsevier; 2020. p.157-83. Available from:
https://www.elsevier.com/books/diagnosis-and-management-in-parkinsons-disease/martin/978-0-12-815946-0
- Capato TTC, Domingos JMM, Almeida LRS. Versão
em Português da Diretriz Europeia de Fisioterapia para a Doença de Parkinson. 2014.
[Internet]. [cited 2022 Jul 4]. Available from:
https://www.parkinsonnet.nl/app/uploads/sites/3/2019/11/diretriz_dp_brasil_versao_final_publicada.pdf
- Cano-de-la-Cuerda R, Pérez-de-Heredia M, Miangolarra-Page JC, Muñoz-Hellín E, Fernández-de-Las-Peñas C. Is there muscular weakness in Parkinson’s disease? Am J Phys Med Rehabil 2010;89(1):70-6. doi: 10.1097/PHM.0b013e3181a9ed9b [Crossref]
- Corcos DM, Chen C, Quinn NP, McAuley J, Rothwell JC. Strength in Parkinson’s disease: Relationship to rate of force generation and clinical status. Ann Neurol 1996;39(1):79-88. doi: 10.1002/ana.410390112 [Crossref]
- Jones GR, Roland KP, Neubauer NA, Jakobi JM. Handgrip strength related to long-term electromyography: application for assessing functional decline in Parkinson disease. Arch Phys Med Rehabil 2017;98(2):347-52. doi: 10.1016/j.apmr.2016.09.133 [Crossref]
- Forsyth AL, Paul SS, Allen NE, Sherrington C, Fung VSC, Canning CG. Flexed truncal posture in Parkinson disease: measurement reliability and relationship with physical and cognitive impairments, mobility, and balance. J Neurol Phys Ther 2017;41(2):107-13. doi: 10.1097/NPT.0000000000000171 [Crossref]
- Mikami K, Shiraishi M, Kamo T. Effect of abnormal posture on quality of life in patients with Parkinson’s disease. Adv Park Dis 2016;5(2):7-14. doi: 10.4236/apd.2016.52002 [Crossref]
- Van Uem JMT, Walgaard S, Ainsworth E, Hasmann SE, Heger T, Nussbaum S, et al. Quantitative timed-up-and-go parameters in relation to cognitive parameters and health-related quality of life in mild-to-moderate Parkinson’s disease. PLoS One 2016;11(4):e0151997. doi: 10.1371/journal.pone.0151997 [Crossref]
