Fisioter Bras 2022;23(6):910-27
REVISÃO
Efetividade e segurança
do treinamento muscular respiratório na apneia obstrutiva do sono: protocolo de
uma revisão sistemática
Effectiveness and safety of respiratory muscle training in obstructive
sleep apnea: systematic review protocol
André Silva de Sousa*, Aline
Pereira Rocha**, Daniela Regina Brandão Tavares**, Jane Érika Frazão Okasaki**, Márcia Valéria de Andrade Santana**, Ana
Carolina Pereira Nunes Pinto*
*Departamento de Ciências
Biológicas e da Saúde, Universidade Federal do Amapá, Macapá AP, **Departamento
de Medicina, Universidade Federal de São Paulo, São Paulo, SP
Recebido em 10 de outubro de
2022; Aceito em 2 de dezembro de 2022.
Correspondência: Ana Carolina Pereira Nunes Pinto,
Universidade Federal do Amapá, Departamento de Ciências Biológicas e da Saúde,
Rod. Juscelino Kubitschek, km 02 Jardim Marco Zero 68903-419 Macapá AP
André
Silva de Sousa: anndressousa@gmail.com
Aline Pereira
da Rocha: alineprocha1@gmail.com
Daniela
Regina Brandão Tavares: daniela74_tavares@hotmail.com
Jane Érika
Frazão Okasaki: erikafrazao@gmail.com
Márcia
Valéria de Andrade Santana: lella-andrade@hotmail.com
Ana
Carolina Pereira Nunes Pinto: anacarolinapnp@hotmail.com
Resumo
Introdução: A apneia obstrutiva do sono (AOS) é o
distúrbio respiratório do sono mais comum. O treino muscular respiratório tem
surgido como uma intervenção promissora para a melhora dos sintomas e com boa
adesão, porém muito ainda se tem discutido sobre sua efetividade e segurança. Objetivo:
Avaliar a efetividade e segurança do TMR no tratamento de pacientes com AOS. Métodos:
Para tanto, realizaremos uma revisão sistemática de ensaios clínicos
randomizados (ECR). O protocolo do estudo foi registrado na Plataforma Prospero
(CRD42018096980). Incluiremos indivíduos de idade superior ou igual a 18 anos,
com diagnóstico de AOS, em uso ou não de pressão positiva nas vias aéreas.
Excluiremos estudos com pacientes diagnosticados com lesão da medula espinhal
ou doenças neuromusculares. As buscas serão realizadas nas bases de dados: Medical
Literature Analysis and Retrieval System Online
(Medline) via Pubmed, Excerpta
Medica dataBASE (Embase) via Elsevier, Cochrane
Central Register of Controlled
Trials (Central) via Cochrane Library, Literatura
Latino-Americana e do Caribe em Ciências da Saúde (Lilacs)
via Portal da Biblioteca Virtual em Saúde e Physiotherapy
Evidence Database (PEDro), sem restrições de idioma ou ano de publicação.
Avaliaremos o rigor metodológico dos estudos incluídos e a certeza da evidência
dos principais desfechos da revisão sistemática utilizando a ferramenta Risco
de Viés 2.0 da Cochrane e a abordagem Grading
of Recommendations
Assessment, Development and
Evaluation (GRADE), respectivamente. A seleção
dos estudos, extração de dados, avaliação do viés dos estudos incluídos e
avaliação da certeza da evidência serão realizados por dois pesquisadores
independentes. Resultados esperados: Espera-se que os resultados desta
revisão forneçam informações úteis para a tomada de decisão clínica, exponham
lacunas de conhecimento, assim como forneçam um bom embasamento para futuros
ECR de alta qualidade sobre o assunto.
Palavras-chave: músculos respiratórios; exercícios
respiratórios; apneia obstrutiva do sono; pressão positiva contínua nas vias
aéreas.
Abstract
Introduction: Obstructive sleep apnea (OSA) is the most common
sleep-disordered breathing. Respiratory muscle training (RMT) has emerged as a
promising intervention for the improvement of symptoms and with good adherence,
however, much has been discussed about its effectiveness and safety. Objective:
To evaluate the effectiveness and safety of RMT in the treatment of patients
with OSA. Methods: Therefore, a systematic review of randomized
controlled trials (RCTs) will be conducted. The study protocol was registered
on the Prospero Platform (CRD42018096980). Individuals diagnosed with OSA, aged
18 years or older, using positive airway pressure or not, will be included. We
will exclude studies with patients diagnosed with spinal cord injury or
neuromuscular diseases. The searches will be performed in the databases:
Medical Literature Analysis and Retrieval System Online (Medline) via Pubmed, Excerpta Medica dataBASE
(Embase) via Elsevier, Cochrane Central Register of Controlled Trials (Central)
via Cochrane Library, Latin American and Caribbean Literature on Health
Sciences (Lilacs) via the Virtual Health Library Portal and Physiotherapy
Evidence Database (PEDro), with no restrictions on
language or year of publication. We will assess methodological rigor from the
included studies and the certainty of evidence for the main outcomes of the
systematic review using Cochrane's Risk of Bias 2.0 tool and the Grading of
Recommendations Assessment, Development and Evaluation (GRADE) approach,
respectively. The study selection, data extraction, assessment of bias of the
included studies, and assessment of the certainty of evidence will be performed
by two independent researchers. Expected results: The results of this
review are expected to provide useful information for clinical decision-making,
and expose knowledge gaps, as well as provide a good foundation for future
high-quality RCTs on the subject.
Keywords: respiratory muscles; breathing exercises; sleep
apnea, obstructive; continuous positive airway pressure.
Introdução
A apneia
obstrutiva do sono (AOS) é o tipo mais comum de distúrbio respiratório
relacionado ao sono [1,2], com prevalência estimada de 9-38% entre adultos,
variando de acordo com sexo e aumentando com a idade [3]. O distúrbio
caracteriza-se pela oclusão total ou parcial das vias respiratórias superiores
[4,5], que leva a eventos repetitivos de apneia ou hipopneia associados à dessaturação-ressaturação de oxigênio [6]. Estes episódios repetitivos
parecem desempenhar um papel importante no desenvolvimento de doenças
cardiovasculares [7].
Os
pacientes com AOS podem apresentar transtornos do humor com depressão e
ansiedade [8], além da redução das capacidades cognitivas, especialmente
atenção, o que pode aumentar o risco de acidentes e influenciando negativamente
na qualidade de vida [9,10]. A disfunção dos músculos respiratórios e sintomas
debilitantes, tais como, fadiga [4] e menor tolerância ao
exercício também podem ser encontrados em indivíduos com AOS [11,12].
Associados às alterações na função neuromuscular, estes sintomas podem
contribuir, também, para fraqueza e diminuição da endurance
dos músculos periféricos [13,14]. Estudos prévios evidenciam uma relação
dinâmica entre os músculos respiratórios e os músculos estriados periféricos,
já confirmado em indivíduos idosos, em pacientes com sarcopenia, insuficiência
cardíaca e doença pulmonar obstrutiva crônica [15].
A
etiologia da AOS é multifatorial e pode estar associada a alterações
anatômicas, condições neuromusculares e predisposição genética [11,16].
Obesidade, gravidez, fumo, ingestão de álcool e outras condições crônicas são
frequentemente associadas à AOS em análise transversal, mas sem relação clara
de causalidade [17]. Dentre estes fatores, destaca-se a obesidade, que atinge
cerca de 70% dos pacientes com AOS e é o fator de risco mais grave [18], com
incidência global e associação linear com AOS [1]. A obesidade em pacientes com
AOS está associada a mudanças estruturais nas vias aéreas e alterações da
mecânica respiratória [19]. Alguns autores sugerem que modificações anatômicas
e funcionais nos músculos dilatadores da faringe são provocadas em decorrência
do depósito elevado de gordura na região. Isto pode levar à diminuição do
diâmetro do lúmen e à consequente alteração do controle da ventilação e da
musculatura [20]. O aumento de tecido adiposo na região torácica e abdominal
também prejudica a função diafragmática e reduz a complacência da caixa
torácica e volumes pulmonares, o que pode influenciar na redução da capacidade
de contração dos músculos respiratórios [11,13].
Para que
estas limitações sejam adequadamente abordadas, é fundamental haver o
reconhecimento precoce da condição. O método padrão de referência para o
diagnóstico de AOS é a polissonografia, e o índice de apneia-hipopneia (IAH) é
o parâmetro mais utilizado para considerar a presença de AOS e para determinar
sua gravidade [21]. Apesar da alta prevalência e importante impacto na saúde
pública e dos pacientes, a AOS é frequentemente subdiagnosticada, subestimada e
subtratada [10,22]. Esta informação é especialmente
relevante para a saúde pública, uma vez que a AOS sem tratamento está associada
a taxas de mortalidade mais elevadas quando comparada aos pacientes que aderem
a tratamentos [2].
As opções
de tratamento da AOS incluem intervenções cirúrgicas, tal como a cirurgia de
avanço maxilomandibular e intervenções conservadoras
como o uso de dispositivo de pressão positiva nas vias aéreas [23]. A abordagem
terapêutica padrão é o uso da pressão positiva contínua nas vias aéreas (CPAP).
No entanto, a intolerância a esta intervenção representa uma importante
limitação à adesão [24,25]. Para estes casos, existem opções de tratamentos
alternativos, como dispositivos orais (dispositivo de avanço mandibular e
estabilizadores da língua) [26] e diferentes tipos de exercício físico [27,28,29].
Os exercícios aeróbicos são recomendados para todas as pessoas com AOS como
terapia adjuvante e para o manejo das comorbidades [2,29,30]. Exercícios
específicos de fortalecimento dos músculos respiratórios também são geralmente
bem tolerados por indivíduos que apresentam AOS [13].
Dados
sugerem que o treino muscular inspiratório (TMI) e expiratório (TME) também
podem levar à diminuição do IAH [31,32,33]. Os mecanismos pelos quais o TMR pode
melhorar a gravidade da AOS precisam ser melhor estudados. Entretanto, o TMI
pode gerar um aumento do tônus muscular e a otimização da atividade motora dos
músculos das vias aéreas superiores podem atuar no aumento da força e
estabilidade das vias aéreas, o que pode reduzir a probabilidade de colapso das
vias aéreas [18,32]. Quanto ao TME, acredita-se que este possa atuar em
oposição à resistência das vias aéreas superiores. Isto porque, em condições
normais, a expiração é passiva. No entanto, quando há um aumento da resistência
das vias aéreas, a expiração ativa passa a ser executada na tentativa de
superar a resistência ao fluxo de ar [34,35] e, nesta situação, portanto, os
músculos expiratórios poderiam contribuir para a desobstrução das vias aéreas
superiores [13].
Vários
estudos têm evidenciado que o TMR é uma intervenção eficaz e segura em várias
populações [36,37,38,39]. Porém, em pacientes com AOS, o TMR tem apresentado
resultados incertos quanto à sua efetividade [13,40] e pouco se tem relatado
sobre sua segurança [4,13]. Assim, delineamos esta revisão sistemática para
avaliar a efetividade e segurança do TMR no tratamento de pacientes com AOS.
Métodos
Tipo de estudo
Este é um
protocolo de revisão sistemática prévia que foi relatado conforme as
recomendações do Preferred Reporting Items for Systematic Reviews and Meta-Analysis (PRISMA) para protocolo (PRISMA-P) [41]. A
Revisão será conduzida de acordo com as recomendações metodológicas do Cochrane
Handbook [42] e será relatada seguindo as recomendações do PRISMA [43].
Aspectos éticos e local
da pesquisa
O
protocolo da revisão foi registrado na Plataforma Prospero (CRD42018096980).
Este estudo será conduzido na Universidade Federal do Amapá (UNIFAP), no curso
de graduação em Fisioterapia, Departamento de Ciências Biológicas e da Saúde.
Critérios de
elegibilidade
Tipos de estudos
incluídos
Incluiremos
ensaios clínicos controlados randomizados (ECR) publicados em texto completo ou
apenas em resumo.
Tipos de participantes
Indivíduos
com idade maior ou igual a 18 anos, com AOS diagnosticados de acordo com o
teste de polissonografia ou por monitorização cardiorrespiratória portátil para
teste de apneia do sono em casa. Excluiremos estudos com participantes
diagnosticados com lesão da medula espinhal ou doença neuromuscular.
Tipos de intervenções
Estudos
que avaliaram os efeitos do TMR no tratamento de pacientes com AOS, sem
limitação de tempo de intervenção, no ambiente hospitalar e ambulatorial.
Tipos de comparações
Iremos considerar
como comparação ao grupo tratamento: grupo placebo, sham-training
(treinamento simulado), outras terapias ou outras comparações nas quais o
efeito do TMR possa ser avaliado exclusivamente, como por exemplo, TMR + CPAP
versus CPAP sozinha.
Conduziremos comparações separadas para cada
tipo de treinamento (TMI ou TME), conforme a seguir:
- TMI versus sham ou controle inativo
- TME versus sham ou controle inativo
- TMI versus outras
intervenções (com ou sem sham)
- TME versus outras
intervenções (com ou sem sham)
- TMI + outras intervenções
versus outras intervenções (com ou sem sham)
- TME + outras intervenções
versus outras intervenções (com ou sem sham)
Medidas de desfechos
Desfechos primários
- Índice de apneia-hipopneia
(IAH): definido como o número de episódios de apneia ou hipopneia por hora de
sono, coletado por meio do exame de polissonografia, ventilador noturno ou por
monitorização cardiorrespiratória portátil.
- Mortalidade cardiovascular
e cerebrovascular.
- Efeitos adversos graves:
qualquer ocorrência indesejável relacionada à intervenção que ameace a vida, ou
que requeira hospitalização ou resulte em incapacidade persistente ou
significativa.
Desfechos secundários
- Qualidade do sono: medido
por uma ferramenta validada, como por exemplo, índice de qualidade do sono de
Pittsburgh (PSQI) ou com qualquer instrumento validado e reconhecido que possa
ser replicado. Avaliaremos a qualidade geral do sono, assim como os seguintes
aspectos do sono separadamente:
* Eficiência do sono
* Sonolência e disfunção
diurnas
- Endurance
e força muscular respiratória: mensurado através da pressão inspiratória máxima
(PImáx) e pressão expiratória máxima (PEmáx) por meio de um medidor de pressão bucal
ou com qualquer instrumento validado e que possa ser replicado.
- Mortalidade geral:
definido como o número de mortes ocorridas por qualquer causa nos estudos
primários.
- Qualidade de vida: medido
por uma ferramenta validada como o questionário Short Form-36 (SF-36) ou com
qualquer instrumento validado e replicável.
- Hospitalizações: avaliada
pelo número de hospitalizações e tempo de hospitalização.
- Aderência ao treinamento:
definido como a quantidade de exercício concluído dividido pela quantidade de
exercício prescrito.
- Função pulmonar: volume
expiratório forçado em um segundo (VEF1) relatado como L ou% do previsto,
capacidade vital forçada (CVF) relatada como L ou% do previsto, índice de
depuração pulmonar (LCI), capacidade pulmonar total (CPT), capacidade residual
funcional (CRF), fluxo expiratório forçado entre 25% e 75% do volume
expiratório (FEF25-75), volume de reserva expiratória, avaliados por teste espirométrico ou qualquer outro instrumento validado,
reconhecido e que possa ser replicado.
- Capacidade funcional e
capacidade para o exercício: avaliados por meio de testes cardiopulmonares (por
exemplo, teste anaeróbico de Wingate (WaNT) e protocolos de teste máximo incremental), outros
testes de capacidade para o exercício (por exemplo, testes de caminhada de seis
e 12 minutos; teste sentar para levantar; teste do degrau de três minutos) ou
qualquer outro teste validado, reconhecido e replicável.
- Função cognitiva, medida
por escalas validadas como o Mini-Exame do Estado
Mental (MEEM)
- Parâmetros fisiológicos:
saturação de oxigênio, frequência cardíaca, pressão arterial sistólica e
pressão arterial diastólica avaliados com qualquer outro instrumento validado e
que possa ser replicado.
- Efeitos adversos não
graves: náusea, vômito, cefaleia, tontura, síncope ou qualquer evento relatado
no estudo primário.
Os
resultados serão avaliados em todos os pontos de tempo relatados em estudos
primários. Reuniremos dados em diferentes prazos: muito curto prazo (até um
mês) curto prazo (de um a três meses), médio prazo (de três meses a um ano) e
longo prazo (mais de um ano). Se um estudo reportar dados em múltiplos pontos
do tempo, utilizaremos o dado do último ponto do tempo mais próximo dos prazos
de interesse deste protocolo (ex: um estudo relata
dados de 4, 5 e 6 semanas, utilizaremos os dados de 6 semanas para considerá-lo
dado de curto prazo em nossa análise).
Procedimento de coleta
Estratégia de busca na
literatura
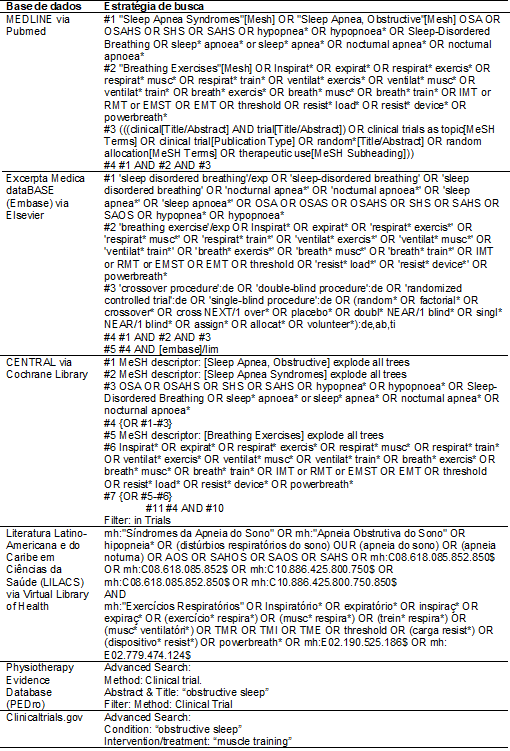
Realizaremos
buscas sensíveis (tabela I), com o uso de termos e descritores relevantes pré-especificados, sem limitação de ano de publicação ou
idioma, nas seguintes bases de dados:
* Medical Literature Analysis and Retrieval System Online (MEDLINE) via Pubmed;
* Excerpta
Medica dataBASE (Embase) via Elsevier;
* Cochrane Central Register of Controlled Trials (CENTRAL) via Cochrane
Library;
* Literatura
Latino-Americana e do Caribe em Ciências da Saúde (LILACS) via Portal da
Biblioteca Virtual em Saúde,e;
* Physiotherapy
Evidence Database (PEDro).
Também
serão analisadas as listas de referência de publicações relevantes. Além disso,
para identificar estudos publicados recentemente, em andamento e não
publicados, realizaremos buscas em plataformas de ensaios clínicos como a base
de dados da Organização Mundial da Saúde (OMS), a International
Clinical Trials Registry
Platform (ICTRP)
(https://www.who.int/clinical-trials-registry-platform/the-ictrp-search-portal)
que inclui o registro de diferentes websites como o ClinicalTrials.gov, base
amplamente utilizada no Brasil e também inclui o registro brasileiro (REBEC).
Contudo, optou-se também por uma busca direta no ClinicalTrials.gov para
identificar eventuais registros não incluídos no momento da busca no ICTRP, uma
vez que pode haver ligeira diferença no período de indexação de registros entre
essas duas plataformas. Também consultaremos resumos publicados em anais de
congresso, com o Congresso Brasileiro de Fisioterapia Respiratória nos
Distúrbios Respiratórios do Sono (SONOFIR), Congresso da Associação Brasileira
do Sono e o Simpósio Internacional de Fisioterapia Cardiorrespiratória e
Fisioterapia em Terapia Intensiva (SIFR). E por fim, entraremos em contato com
os autores dos estudos primários para identificar estudos adicionais
potencialmente importantes para esta revisão e solicitar informações adicionais
quando necessário.
Tabela I – Estratégias de buscas da revisão
sistemática
Seleção dos estudos
Dois
autores (A.S.S) e (A.C.P.N.P) totalmente independentes realizarão a seleção dos
estudos, com base nos critérios de elegibilidade pré-especificados.
Inicialmente, serão excluídos os estudos que foram indexados em mais de uma
base de dados (duplicados). No caso de haver relatos com os mesmos
participantes, mas com diferentes medidas de desfechos ou usando diferentes
tempos de acompanhamento, ambos os relatos serão incluídos, porém os dois
relatos serão considerados como partes de apenas um estudo. Após a análise de
potenciais duplicatas, será realizada a avaliação com base nos títulos e
resumos e, por fim, a leitura dos textos completos para análise mais aprofundada.
As discordâncias entre os autores quanto à inclusão dos estudos serão
resolvidas por um terceiro revisor (A.P.R.). Para otimizar o processo de
seleção, utilizaremos o aplicativo Rayyan
(https://www.rayyan.ai/) [44]. Os resultados relacionados ao processo de
seleção dos estudos serão apresentados em um fluxograma, conforme recomendação
PRISMA (Figura 1).
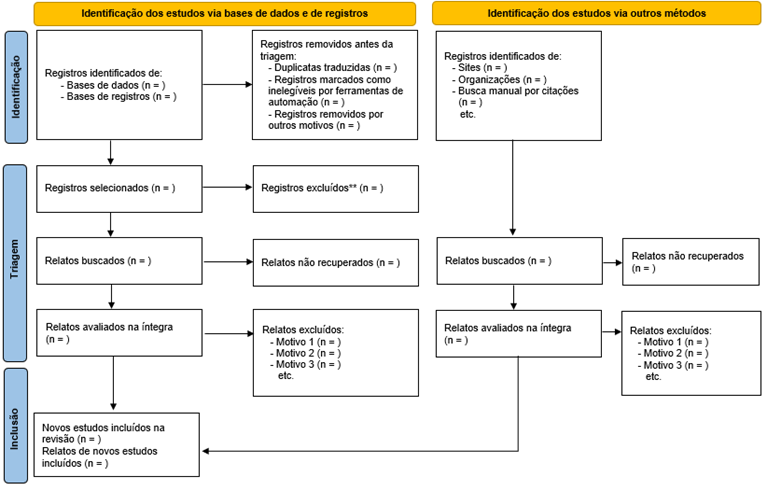
Figura 1 - Fluxograma da revisão sistemática
Extração e gerenciamento
dos dados
Para
extração dos dados dos estudos incluídos será utilizada uma planilha no
software Microsoft Excel 365. Dois autores (A.S.S.) e (A.C.P.N.P) de forma
independente farão a extração dos seguintes dados:1) Detalhes a respeito da
identificação (título, autores, local e data de realização do estudo) do
estudo; Métodos (desenho do estudo, duração total do estudo, cenário do estudo
(Ex: hospitalar, ambulatorial); 2) Participantes:
número de participantes que foram randomizados, idade, faixa etária, sexo,
gravidade da doença, comorbidades, critérios de diagnóstico, critérios de
inclusão e critérios de exclusão; 3) Intervenções: tipo de intervenção
(treinamento muscular inspiratório ou expiratório); detalhes do treinamento:
(equipamento, parâmetros, duração, intensidade e frequência); detalhes da
intervenção do grupo comparador e intervenções concomitantes; 4) Resultados:
desfechos primários e secundários especificados, coletados e efetivamente
relatados, pontos de tempo coletados e relatados, número de participantes
perdidos/não avaliados para cada desfecho, método para lidar com dados de
participantes faltantes (ex: análise por protocolo ou
por intenção de tratar) e número de participantes analisados 5) Notas:
ocorrência de financiamento para o estudo e conflitos de interesse potenciais
dos autores do estudo. Divergências ou desacordos serão resolvidos por um
terceiro autor (A.P.R.). Na ausência de informações ou informações incompletas,
os autores dos estudos serão contatados.
Considerando
a viabilidade de realizar uma metanálise, também
serão extraídos do grupo intervenção e grupo controle os seguintes dados: o
número de participantes randomizados, analisados e relatados. Para desfechos
contínuos pré-especificados neste protocolo (IAH,
qualidade do sono, força muscular respiratória, qualidade de vida, função
pulmonar, capacidade funcional, função cognitiva e parâmetros fisiológicos),
médias ou medianas, desvios-padrão, erro padrão, intervalos de confiança (IC),
ou qualquer outra medida de variabilidade disponível no estudo, avaliada pré e/ou pós intervenção. Para os desfechos dicotômicos
(mortalidade cardiovascular e cerebrovascular, efeitos adversos graves,
mortalidade geral, hospitalização, aderência ao treinamento e efeitos adversos
não graves) serão extraídos: número de participantes randomizados e avaliados
em cada grupo e número de eventos ocorridos em cada grupo.
Avaliação do rigor
metodológico e da certeza da evidência
A
avaliação do risco de viés dos estudos incluídos será realizada por dois
autores independentes (A.S.S.) e (A.C.P.N.P.) por meio da ferramenta elaborada
pela Cochrane, denominada de risco de viés 2.0 (Risk of
bias - ROB 2.0) [42]. As discordâncias serão resolvidas em consenso ou, se
necessário, por um terceiro revisor (A.P.R.). Os seguintes domínios serão
avaliados: viés decorrente do processo de randomização, viés devido a desvios
das intervenções pretendidas, viés devido à falta de dados de desfechos, viés
na mensuração do desfecho, viés na seleção do resultado relatado e viés geral
do estudo. Cada domínio será julgado como: baixo risco de viés, alto risco de
viés ou alguma preocupação quanto ao risco de viés. Entraremos em contato com
os autores dos estudos para esclarecer qualquer informação pouco clara ou
ausente a respeito dos domínios avaliados [45].
Usaremos
o Sistema de Grading of
Recommendations Assessment, Development
and Evaluation [45]
para classificar a certeza de evidência. Para alcançar esse objetivo, iremos
considerar fatores que podem diminuir a certeza na evidência: (i) o risco geral
de viés dos estudos incluídos; (ii) a indireção das evidências; (iii) a
inconsistência dos resultados; (iv) a precisão das
estimativas; e (v) o risco de viés de publicação. Também avaliaremos três
fatores que podem elevar a certeza da evidência, que são: (i) elevada magnitude
de efeito; (ii) fatores de confusão residuais; e (iii) gradiente dose-resposta. A avaliação do risco de viés
e da certeza da evidência serão realizadas por dois avaliadores de forma
independente (A.S.S e A.C.P.N.P) e as eventuais discordâncias serão resolvidas
mediante análise de um terceiro examinador (A.P.R.). O software GRADE profiler, disponível online (https://gdt.gradepro.org/app/),
será usado para resumir nossos julgamentos sobre a certeza das evidências para
cada desfecho principal. Conforme recomendação da Cochrane, o julgamento e
motivos para o julgamento serão apresentados em uma tabela contendo os principais
achados para 7 dos desfechos avaliados, no ponto do tempo mais prolongado
disponível:
1. Índice de Apneia e
Hipopneia
2. Mortalidade
cardiovascular e cerebrovascular
3. Efeitos adversos graves
4. Qualidade do sono
5. Força muscular
inspiratória
6. Capacidade Vital Forçada
7. Mortalidade geral
Análise estatística
Na
condição de no mínimo dois estudos apresentarem homogeneidade suficiente quanto
aos participantes, intervenções e desfechos avaliados, iremos agrupar os seus
resultados em metanálises. Se porventura os dados
forem insuficientes para serem inseridos em uma metanálise,
entraremos em contato com os autores dos estudos para solicitar o acesso aos
dados faltantes. Se os dados forem insuficientes mesmo após o contato com o
autor, os resultados do estudo serão resumidos apenas em síntese narrativa.
Quando
for possível a realização de metanálises, agruparemos
dados utilizando o método do inverso da variância e o modelo de efeitos
aleatórios no software Review Manager 5.4 [46]. Quando possível, as variáveis
contínuas serão resumidas através da diferença de médias (pós e pré-intervenção) com IC de 95%. Na ausência de resultados
relatados como diferenças de médias, ou na ausência de boa correlação entre as
medidas dos indivíduos, utilizaremos os dados relatados após a intervenção. Se
estudos utilizarem instrumentos de medidas diferentes para avaliar desfechos
contínuos, agruparemos os dados reportando-os como diferenças de médias
padronizadas. As variáveis dicotômicas serão sumarizadas usando risco relativo
(RR) com IC de 95%. Para os desfechos dicotômicos, usaremos participantes, em
vez de eventos, como unidade de análise (ou seja, número de participantes com
um ou mais eventos adversos, em vez de número de eventos adversos por
participante.
Se dados
ajustados estiverem disponíveis (ANCOVA ou ANOVA), priorizaremos o uso destes
dados. Sempre que disponível, também priorizaremos o uso de dados por intenção
de tratar em vez de dados de análises por protocolo.
Para
estimar a heterogeneidade entre os estudos em cada metanálise,
utilizaremos a estatística I2. Se a heterogeneidade for
significativa (I2 > 50%), exploraremos as fontes de hetoregeneidade em análises de subgrupos ou de
sensibilidade conforme recomendado pelo Manual Cochrane para Revisões
Sistemáticas de Intervenções [42]. Se houver ligeira heterogeneidade clínica ou
metodológica, também investigaremos as fontes de heterogeneidade por meio de
análises de subgrupos ou de sensibilidade. Para análise de subgrupos,
consideraremos: gravidade da AOS - AHI > 30/hora versus ≤ 30/hora
[47], idade > 60 anos versus ≤ 60 anos (LONGEVIDADE, 2019) e tipo de
TMR (força - alta intensidade e poucas repetições: carga/ajuste > 70%; endurance - baixa intensidade e muitas repetições:
carga/ajuste > 30%). Faremos análises de sensibilidade retirando das metanálises estudos com alto risco de viés geral. No caso
de no mínimo 10 estudos serem incluídos em uma metanálise,
será avaliado o risco de viés de publicação por meio da análise do gráfico de
funil e do teste de Egger no software R
(https://www.r-project.org/) [48].
Quando
houver um estudo com mais de dois grupos, incluiremos apenas os braços
relevantes. Se houver duas comparações de interesse em um estudo com mais de
dois grupos (por exemplo, TMI A (resistência) versus sham
e TMI B (força) versus sham), combinaremos os braços
ativos (ex: TMI A e TMI B) ou reduziremos pela metade
o grupo controle para evitar dupla contagem.
Resultados esperados
O
presente estudo propõe-se a realizar uma revisão sistemática investigando os
efeitos do TMR em pacientes com AOS e, se possível, reunir os dados em metanálises para reduzir a probabilidade de erro tipo 2 nas
comparações. Uma revisão sistemática foi conduzida previamente incluindo
estudos publicados até outubro de 2018 [41] e seus resultados parciais
indicaram que o TMR parece ser uma intervenção segura e promissora a ser
utilizada nesta população. No entanto, lacunas do conhecimento ainda existem.
Os resultados desta revisão ajudarão a esclarecer se novos ECRs
foram publicados sobre o assunto e se o TMR - um tratamento alternativo de
fácil implementação e baixo custo para pacientes com AOS que não desejam ou não
toleram o CPAP - é seguro e pode melhorar desfechos clínicos importantes nestes
pacientes.
Possíveis
limitações podem ser encontradas como a presença de estudos enviesados ou com
amostras pequenas que não possibilitam estimar de forma precisa os efeitos da
intervenção. Contudo, a transparência, o rigor metodológico, a avaliação da
certeza da evidência para cada desfecho e as extensivas e cuidadosas buscas
possibilitarão uma resposta clínica mais segura e confiável, visando esclarecer
o efeito do TMR em indivíduos com AOS, fornecendo informações úteis para a
tomada de decisão clínica, baseadas na melhor evidência disponível atualmente.
Além disso, acredita-se que os resultados desta revisão possam expor lacunas de
conhecimento e embasar futuros ensaios clínicos randomizados de alta qualidade
sobre o assunto.
Conflitos
de interesse
Não há
Fontes
de financiamento
Este
projeto recebeu o financiamento do Programa Institucional de Bolsas de
Iniciação Científica - PROBIC/UNIFAP
Contribuição
dos autores
Concepção
e desenho da pesquisa:
Sousa AS, Pinto ACPN; Redação do manuscrito: Sousa AS, Rocha AP, Tavares
DRB, Osaki JEF, Santana MVA, Pinto ACPN; Revisão
crítica do manuscrito quanto ao conteúdo intelectual importante: Sousa AS,
Rocha AP, Tavares DRB, Osaki JEF, Santana MVA, Pinto
ACPN.
Referências
- McArdle N, Ward S V., Bucks RS, Maddison K, Smith A, Huang R-C, et al.
The prevalence of common sleep disorders in young adults: a descriptive
population-based study. Sleep 2020;43(10):1-11. doi: 10.1093/sleep/zsaa072 [Crossref]
- Mendonca F, Mostafa SS, Ravelo-Garcia AG, Morgado-Dias F, Penzel T. A review of obstructive sleep apnea detection approaches. IEEE J Biomed Heal Informatics 2019;23(2):825-37. https://doi.10.1109/JBHI.2018.2823265 [Crossref]
- Senaratna CV, Perret JL, Lodge CJ, Lowe AJ, Campbell BE, Matheson MC, et al. Prevalence of obstructive sleep apnea in the general population: A systematic review. Sleep Med Rev 2017;34:70-81. doi: 10.1016/j.smrv.2016.07.002 [Crossref]
- Lin H-Y, Chang C-J, Chiang C-C, Su P-L, Lin C-Y, Hung C-H. Effects of a comprehensive physical therapy on moderate and severe obstructive sleep apnea- a preliminary randomized controlled trial. J Formos Med Assoc 2020;119(12):1781-90. doi: 10.1016/j.jfma.2020.01.011 [Crossref]
- Miller MA, Cappuccio FP. A systematic review of COVID-19 and obstructive sleep apnoea. Sleep Med Rev 2021;55:101382. doi: 10.1016/j.smrv.2020.101382 [Crossref]
- Rashid NHA, Zaghi S, Scapuccin M, Camacho M, Certal V, Capasso R. The Value of oxygen desaturation index for diagnosing obstructive sleep apnea: a systematic review. Laryngoscope 2021;131(2):440-7. doi: 10.1002/lary.28663 [Crossref]
- Collen J, Lettieri C, Wickwire E, Holley A. Obstructive sleep apnea and cardiovascular disease, a story of confounders! Sleep Breath 2020;24(4):1299-313. doi: 10.1007/s11325-019-01945-w [Crossref]
- Garbarino S, Bardwell WA, Guglielmi O, Chiorri C, Bonanni E, Magnavita N. Association of anxiety and depression in obstructive sleep apnea patients: a systematic review and meta-analysis. Behav Sleep Med 2020;18(1):35-57. doi: 10.1080/15402002.2018.1545649 [Crossref]
- Alomri RM, Kennedy GA, Wali SO, Ahejaili F, Robinson SR. Differential associations of hypoxia, sleep fragmentation, and depressive symptoms with cognitive dysfunction in obstructive sleep apnea. Sleep 2021;44(4):1-9. doi: 10.1093/sleep/zsaa213 [Crossref]
- Evans EC, Sulyman O, Froymovich O. The goals of treating obstructive sleep apnea. Otolaryngol Clin North Am 2020;53(3):319-28. doi: 10.1016/j.otc.2020.02.009 [Crossref]
- Carvalho TM da CS, Soares AF, Climaco DCS, Secundo IV, Lima AMJ de. Correlation of lung function and respiratory muscle strength with functional exercise capacity in obese individuals with obstructive sleep apnea syndrome. J Bras Pneumol 2018;44(4):279-84. doi: 10.1590/s1806-37562017000000031 [Crossref]
- Jen R, Orr JE, Gilbertson D, Fine J, Li Y, Wong D, et al. Impact of obstructive sleep apnea on cardiopulmonary performance, endothelial dysfunction, and pulmonary hypertension during exercise. Respir Physiol Neurobiol 2021;283:103557. doi: 10.1016/j.resp.2020.103557 [Crossref]
- Erturk N, Calik-Kutukcu E, Arikan H, Savci S, Inal-Ince D, Caliskan H, et al. The effectiveness of oropharyngeal exercises compared to inspiratory muscle training in obstructive sleep apnea: A randomized controlled trial. Hear Lung 2020;49(6):940-8. doi: 10.1016/j.hrtlng.2020.07.014 [Crossref]
- Marillier M, Gruet M, Baillieul S, LE Roux Mallouf T, Wuyam B, Tamisier R, et al. Neuromuscular dysfunction and cortical impairment in sleep apnea syndrome. Med Sci Sports Exerc 2018;50(8):1529-39. doi: 10.1249/mss.0000000000001625 [Crossref]
- Grigoriadis K, Efstathiou I, Dimitriadis Z, Konstantopoulou G, Grigoriadou A, Vasileiadis G, et al. Handgrip force and maximum inspiratory and expiratory pressures in critically ill patients with a tracheostomy. Am J Crit Care 2021;30(2):e48-53. doi: 10.4037/ajcc2021248 [Crossref]
- Andrade FMD, Pedrosa RP. The role of physical exercise in obstructive sleep apnea. J Bras Pneumol 2016;42(6):457-64. doi: 10.1590/S1806-37562016000000156 [Crossref]
- Taveira KVM, Kuntze MM, Berretta F, de Souza BDM, Godolfim LR, Demathe T, et al. Association between obstructive sleep apnea and alcohol, caffeine and tobacco: A meta-analysis. J Oral Rehabil 2018;45(11):890-902. doi: 10.1111/joor.12686 [Crossref]
- Torres-Castro R, Vasconcello-Castillo L, Puppo H, Cabrera-Aguilera I, Otto-Yáñez M, Rosales-Fuentes J, et al. Effects of exercise in patients with obstructive sleep apnoea. Clocks & Sleep 2021;3(1):227-35. doi: 10.3390/clockssleep3010013 [Crossref]
- Salman LA, Shulman R, Cohen JB. Obstructive Sleep apnea, hypertension, and cardiovascular risk: epidemiology, pathophysiology, and management. Curr Cardiol Rep 2020;22(2):6. doi: 10.1007/s11886-020-1257-y [Crossref]
- Deflandre E, Gerdom A, Lamarque C, Bertrand B. Understanding pathophysiological concepts leading to obstructive apnea. Obes Surg 2018;28(8):2560-71. doi: 10.1007/s11695-018-3325-6 [Crossref]
- Kapur VK, Auckley DH, Chowdhuri S, Kuhlmann DC, Mehra R, Ramar K, et al. Clinical Practice guideline for diagnostic testing for adult obstructive sleep apnea: An American Academy of Sleep Medicine Clinical Practice Guideline. J Clin Sleep Med 2017;13(03):479-504. doi: 10.5664/jcsm.6506 [Crossref]
- Li Y, Wang Y. Obstructive sleep apnea-hypopnea syndrome as a novel potential risk for aging. Aging Dis 2021;12(2):586. https://10.14336/AD.2020.0723 [Crossref]
- Mohamed AS, Sharshar RS, Elkolaly RM, Serageldin SM. Upper airway muscle exercises outcome in patients with obstructive sleep apnea syndrome. Egypt J Chest Dis Tuberc 2017;66(1):121-5. doi: 10.1016/j.ejcdt.2016.08.014 [Crossref]
- Chang H, Chen Y, Du J. Obstructive sleep apnea treatment in adults. Kaohsiung J Med Sci 2020;36(1):7-12. doi: 10.1002/kjm2.12130 [Crossref]
- Xia F, Sawan M. Clinical and research
solutions to manage obstructive sleep apnea: a review. Sensors (Basel)
2021;21(5):1784. doi: 10.3390/s21051784 [Crossref]
- Ng JH, Yow M. Oral appliances in the management of obstructive sleep apnea. Sleep Med Clin 2020;15(2):241-50. doi: 10.1016/j.jsmc.2020.02.010 [Crossref]
- Mendelson M, Bailly S, Marillier M, Flore P, Borel JC, Vivodtzev I, et al.
Obstructive sleep apnea syndrome, objectively measured physical activity and
exercise training interventions: a systematic review and meta-analysis. Front
Neurol 2018;9. doi: 10.3389/fneur.2018.00073 [Crossref]
- Wong A-M, Barnes HN, Joosten SA, Landry SA, Dabscheck E, Mansfield DR, et al. The effect of surgical weight loss on obstructive sleep apnoea: A systematic review and meta-analysis. Sleep Med Rev 2018;42:85-99. doi: 10.1016/j.smrv.2018.06.001 [Crossref]
- Gao Y-N, Wu Y-C, Lin S-Y, Chang JZ-C, Tu Y-K. Short-term efficacy of minimally invasive treatments for adult obstructive sleep apnea: A systematic review and network meta-analysis of randomized controlled trials. J Formos Med Assoc 2019;118(4):750-65. doi: 10.1016/j.jfma.2018.02.008 [Crossref]
- Hargens TA, Martin RA, Strosnider CL, Giersch GEW, Womack CJ. Obstructive sleep apnea negatively impacts objectively measured physical activity. Sleep Breath 2019;23(2):447-54. doi: 10.1007/s11325-018-1700-0 [Crossref]
- Lin H-C, Chiang L, Ong J, Tsai K, Hung C, Lin C. The effects of threshold inspiratory muscle training in patients with obstructive sleep apnea: a randomized experimental study. Sleep Breath. 2020 Mar 21;24(1):201-9. doi: 10.1007/s11325-019-01862-y [Crossref]
- Nóbrega-Júnior JCN, Andrade AD, Andrade EAM de, Andrade MDA, Ribeiro ASV, Pedrosa RP, et al. Inspiratory muscle training in the severity of obstructive sleep apnea, sleep quality and excessive daytime sleepiness: a placebo-controlled, randomized trial. Nat Sci Sleep 2020;12:1105-13. doi: 10.2147/nss.s269360 [Crossref]
- Kuo Y-C, Song T-T, Bernard JR, Liao Y-H. Short-term expiratory muscle strength training attenuates sleep apnea and improves sleep quality in patients with obstructive sleep apnea. Respir Physiol Neurobiol 2017;243:86-91. doi: 10.1016/j.resp.2017.05.007 [Crossref]
- Hanif U, Leary E, Schneider L, Paulsen R, Morse AM, Blackman A, et al.
Estimation of apnea-hypopnea index using deep learning on 3-d craniofacial
scans. IEEE J Biomed Heal Informatics 2021;25(11):4185-94. doi: 10.1109/JBHI.2021.3078127 [Crossref]
- Ulubay G. Solunum kas fizyolojisi ve kas gücü ölçümü. Toraks Cerrahisi Bul 20171;10(1):37-46. doi: 10.5578/tcb.2017.006 [Crossref]
- Azambuja ACM, Oliveira LZ, Sbruzzi G. Inspiratory muscle training in patients with heart failure: what is new? systematic review and meta-analysis. Phys Ther 2020;100(12):2099-109. doi: 10.1093/ptj/pzaa171 [Crossref]
- Seixas MB, Almeida LB, Trevizan PF, Martinez DG, Laterza MC, Vanderlei LCM, et al. Effects of inspiratory muscle training in older adults. Respir Care 2020;65(4):535-44. doi: 10.4187/respcare.06945 [Crossref]
- Shei R-J. Recent advancements in our understanding of the ergogenic
effect of respiratory muscle training in healthy humans: a systematic review. J
Strength Cond Res 2018;32(9):2665-76. doi: 10.1519/jsc.0000000000002730 [Crossref]
- Yun R, Bai Y, Lu Y, Wu X, Lee S-D. How breathing exercises influence on respiratory muscles and quality of life among patients with COPD? A systematic review and meta-analysis. Can Respir J 2021;2021:1-11. doi: 10.1155/2021/1904231 [Crossref]
- Vivodtzev I, Tamisier R, Croteau M, Borel J, Grangier A, Wuyam B, et al. Ventilatory support or respiratory muscle training as adjuncts to exercise in obese CPAP-treated patients with obstructive sleep apnoea: a randomised controlled trial. Thorax 2018;73(7):634-43. doi: 10.1136/thoraxjnl-2017-211152 [Crossref]
- Moher D, Shamseer L, Clarke M, Ghersi D, Liberati A, Petticrew M, et al. Preferred reporting items for
systematic review and meta-analysis protocols (PRISMA-P) 2015 statement. Syst
Rev 2015;4(1):1. doi: 10.1186/2046-4053-4-1 [Crossref]
- Higgins JPT. Cochrane Handbook for Systematic Reviews of Interventions
version 6.2 (atualizado em fevereiro de 2021) [Internet] 2021. [cited 2022 Dec 2].
Available from: http://www.training.cochrane.org/handbook
- Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ 2021;372:71. doi: 10.1136/bmj.n71 [Crossref]
- Ouzzani M, Hammady H, Fedorowicz Z, Elmagarmid A. Rayyan-a web and mobile app for systematic reviews. Syst Rev 2016;5(1):210. doi: 10.1186/s13643-016-0384-4 [Crossref]
- Atkins D, Best D, Briss PA, Eccles M, Falck-Ytter Y, Flottorp S, et al. Grading quality of evidence and strength of recommendations. BMJ 2004;328(7454):1490. doi: 10.1136/bmj.328.7454.1490 [Crossref]
- Review Manager (RevMan). Versão
5.3. Copenhagen: Nordic Cochrane Centre, Cochrane. 2020. [Programa
de computador]
- Fagondes SC, Lorenzi-Filho G, Guimarães GM, Magalhães F, Cabral MM et al. Programa saúde Respiratória - apneia do
sono. Soc Bras Pneumol e Tisiol [cited 2022 Dec 2]. Available
from: https://sbpt.org.br/portal/espaco-saude-respiratoria-apneia-do-sono/
- Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, et al. Cochrane Handbook for Systematic Reviews of Interventions. Cochrane Handbook for Systematic Reviews of Interventions. Wiley; 2019. 694p. doi: 10.1002/9781119536604 [Crossref]
