Fisioter Bras.
2023;24(3):304-14
ARTIGO
ORIGINAL
Existe
relação entre o lactato e a espondilite anquilosante?
Is there a relationship between lactate and ankilosing spondylitis?
Guido
Assis Cachuba de Sá Ribeiro1, Valderilio Feijó Azevedo1, Leonardo Krieger
Rafael1, Guilherme Kyuzaemon Osako Novakoski1,
Ricardo Rasmussen Petterle1, Faissal Nemer Hajar1
1Universidade Federal de Paraná (UFPR),
Curitiba, PR, Brasil
Recebido
em: 17de março de 2023; Aceito em: 30 de maio de 2023.
Correspondência: Guido Assis Cachuba
de Sá Ribeiro, guidofisiot@gmail.com
Como citar
Ribeiro GACS, Azevedo
VF, Rafael LK, Novakoski GKO, Petterle
RR, Hajar FN. Existe relação entre o lactato e a espondilite anquilosante? Fisioter Bras. 2023;24(3):304-14. doi; 10.33233/fb.v24i3.5428
Resumo
Objetivo: O objetivo deste estudo foi analisar
os níveis séricos do lactato em repouso em pacientes com espondilite
anquilosante, com e sem atividade clínica da doença. Métodos: Trata-se
de um estudo observacional quantitativo não controlado realizado com uma
amostra de 51 pacientes com e sem atividade clínica de doença de acordo com os
critérios do ASAS (Assessment of Spondylo Arthritis International Society). Os níveis de lactato no sangue
foram medidos in loco, em um único momento com o paciente em repouso. Resultados:
A amostra do estudo apresentou níveis elevados da lactacidemia
absoluta em 90,20% dos pacientes, os outros 1,96% se apresentaram normais e
7,84% abaixo dos valores de referência que ficam entre 1,0 e 1,8 mmoles/l. As análises não demonstraram uma forte relação
entre os níveis de lactato e a espondilite anquilosante com valor de p ≥
0.05, não apresentando significância estatística. Conclusão: Os
resultados de nosso estudo sugerem que embora os níveis de lactacidemia
se apresentassem elevados nos pacientes com espondilite anquilosante, não houve
significância estatística.
Palavras-chave: ácido lático; espondilite
anquilosante; líquido sinovial.
Abstract
Objective: The aim of this study was to
analyze resting serum lactate levels in patients with ankylosing spondylitis,
with and without clinical disease activity. Methods: This was a
quantitative observational uncontrolled study conducted with a sample of 51
patients with and without clinical disease activity according to the ASAS
(Assessment of Spondylo Arthritis International
Society) criteria. Blood lactate levels were measured on-site at a single time
point with the patient at rest. Results: The study sample showed
elevated absolute lactacidemia levels in 90.20% of
patients, the other 1.96% was normal and 7.84% below reference values were
between 1.0 and 1.8 mmoles/l. The analyses did not
show a strong relationship between lactate levels and ankylosing spondylitis
with p-value ≥ 0.05, not showing statistical significance. Conclusion:
The results of our study suggest that although lactacidemia
levels were elevated in patients with ankylosing spondylitis, there was no
statistical significance.
Keywords: lactic acid; ankylosing
spondylitis; synovial fluid.
Introdução
A
Espondilite Anquilosante (EA) é caracterizada como uma doença crônica
inflamatória do grupo de classificação das espondiloartrites
que tem como acometimento principal a coluna vertebral, e pode evoluir em um
processo limitante de funcionalidade e de rigidez progressiva no esqueleto
axial, apresentando o início da doença em jovens adultos predominantemente do
sexo masculino de cor branca e em indivíduos que apresentam o marcador HLA-B27
positivo [1].
A
EA grave desenvolve comorbidades extras no esqueleto axial como também defeitos
na condução cardíaca, regurgitação aórtica, sequelas neurológicas, fibrose
pulmonar, amiloidose e artrite psoriática
[2,3] e a uveíte anterior aguda demonstrada em 20% a 30% dos pacientes sendo a
mais comum a incidência extra-articular [4]. A
etiologia da (EA) encontra um forte componente genético. Múltiplos alelos já
foram descritos como possíveis alvos de mutações envolvidos na (EA) [5].
Contudo, a principal mutação responsável pela doença é no gene codificante de
superfície celular HLA-B27 das células apresentadoras de antígeno. O defeito no
dobramento de HLA- B27, por sua vez, acarreta um estresse no retículo
endoplasmático celular, culminando na produção inicial de Interleucina -23 e
posteriormente de Interleucina -17, que gera as manifestações articulares
características da doença, alterando a atividade de osteoblastos e osteoclastos
[6].
Os
pacientes portadores de (EA) apresentam sintomas axiais como dores em região
lombar de caráter inflamatório e sintomas periféricos como artrite, entesite e dactilite. A sintomatologia inicial se apresenta com
lombalgia noturna de forma insidiosa persistente com o repouso, mas
apresentando alívio das dores com a prática de atividade física. Um estudo
multicêntrico brasileiro relacionado às espondiloartrites
incluindo a (EA) descobriu que os pacientes que tiveram o início da doença
antes dos 40 anos apresentavam sintomas axiais na coluna vertebral, já os
pacientes que apresentavam os sintomas periféricos se mostravam numa fase mais
tardia e eram predominantemente mulheres [7].
O
principal instrumento diagnóstico para a (EA) é encontrado nos critérios ASAS (Assessment
of Spondylo Arthritis International Society)
e os critérios de Nova York, e o paciente deve apresentar as seguintes
características: sacroiliíte radiográfica, lombalgia
e redução da mobilidade axial e algumas características de espondiloartrites
que são: uveíte, HLA-B27, entesite, dactilite, doença
de Crohn, proteína C reativa quantitativamente
elevada, artrite, lombalgia inflamatória, psoríase, boa resposta a
anti-inflamatórios não estereoidais e história
familiar [8].
Para
a avaliação da atividade de doença, progressão da doença e prognóstico
utilizam-se dois principais instrumentos: Bath
Ankylosing Spondylitis Disease Activity Index
(BASDAI) e o Ankylosing Spondylitis
Disease Activity Score
(ASDAS) [9].
Durante
o processo de glicólise, a glicose é convertida em piruvato e este composto,
sob condições aeróbias, é transformado em acetil-CoA
para integrar o ciclo de Krebs e assim gerar energia. Contudo, em situação
anaeróbia, o piruvato é convertido em lactato via enzima lactato desidrogenase
(LDH). Este ácido, em solução aquosa, é dissociado em H+ e lactato [10]. O
lactato pode ser produzido pela musculatura esquelética, cérebro, pele, medula
da adrenal e em vários outros órgãos e em células, como nos eritrócitos, que
inclusive só utilizam da via anaeróbia para a obtenção de energia. Fígado,
coração e rins normalmente utilizam o lactato presente no sangue, mas em
situações de extrema privação podem produzi-lo também [11].
Espondiloartrites (EpA)
correspondem a uma parte das doenças reumáticas com origem imunológica e padrão
familiar, acometem principalmente o esqueleto axial, assim como articulações
periféricas e enteses, majoritariamente em membros inferiores. Espondilite
anquilosante, artrite reativa e artrite psoriática
são exemplos importantes de (EpA) [12].
A
literatura relata que o lactato está possivelmente envolvido com mecanismos
autoimunes e alguns estudos demonstraram uma atividade modulatória
sobre as células T, como, por exemplo, na migração das células TCD4 e TCD8, que
é inibida por derivados do lactato. Ainda quanto à atividade sobre estas
células, constatou-se que o TCD8+ perde sua atividade citolítica
em presença de lactato e o TCD4+, em contato com lactato de sódio, começa a
expressar IL-17, importante interleucina pró-inflamatória. Na artrite reumatoide
já se sabe da existência de quantidades significantes de lactato no líquido
sinovial [13].
Todavia,
estudos relacionando ao papel do lactato nas espondiloartrites
mostram-se escassos, validando assim a busca por mais conhecimentos nesta área.
Lactacidemia é o nível de lactato encontrado no
sangue capilar. Os valores de referência de normalidade do lactato devem se
apresentar entre 1,0 e 1,8 mmoles/l realizando-se as
avaliações em punção capilar [14], em que os valores séricos elevados, acima de
1,8 mmol/l, são indicativos de hiperlactacidemia e
valores abaixo de 1,0 mmol/l são considerados hipolactacidemia.
Métodos
Neste
estudo observacional quantitativo não controlado, foram selecionados do
ambulatório de reumatologia do serviço de espondiloartrites
do Hospital de Clínicas da Universidade Federal do Paraná pacientes que
apresentavam diagnóstico de espondilite anquilosante. Todos preencheram os
critérios propostos pela American Society of Rheumatology; ASAS (Assessment of
Spondylo Arthritis International Society) e dos Critérios de Nova York.
Foram avaliados os prontuários dos pacientes para verificação da existência da
doença e os exames laboratoriais relacionados, o exame da Proteína C Reativa
(PCR) com valores de normalidade até 0,3 mg/dL, e em processos
inflamatórios leves entre 0,3 mg/L até 1,0 mg/L que em relação ao ASDAS (Disease Activity State) nos demonstrava a atividade da doença que
poderia se apresentar inativa, moderada atividade, alta atividade e muito alta
atividade.
Os
pacientes do estudo eram do sexo masculino e feminino com idade entre 18 e 80
anos que aceitaram participar da pesquisa e assinaram o termo de consentimento
livre e esclarecido aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos
do Hospital de Clínicas da Universidade Federal do Paraná sob o número
13908819.1.0000.0096.
Os
critérios de inclusão foram portadores de espondilite anquilosante com e sem
atividade clínica de doença e que preencheram os questionários específicos para
doença; já os critérios de exclusão foram os pacientes descartados do estudo
por fazer uso de medicamentos, etilismo crônico e comorbidades que poderiam
alterar os níveis séricos do lactato tanto acima quanto abaixo dos valores de
referência. Logo após, foi realizada uma anamnese na qual constavam perguntas
relacionadas à doença, e aplicados dois questionários específicos para a
espondilite anquilosante, o BASDAI (Bath Ankylosing Activity Index) e
o ASAS.
Determinação
do lactato
As
coletas das concentrações dos níveis séricos de lactato nas amostras de sangue
capilar em pacientes com espondilite anquilosante foram realizadas por
perfuração cutânea transdérmica in loco da porção
digital utilizando as lancetas descartáveis Accu-Chek
Soft Clix Pró, estéreis, seguindo as normas da vigilância sanitária em
vigência. Colocou-se uma gota de sangue sobre uma tira de teste de lactato BM-Lactate com reagente específico da Roche Diagnostics Brasil em um único momento do dedo indicador,
introduzindo a tira em um aparelho que realiza a fotometria de reflectância (Accutrend Lactate, Roche Diagnostics Brasil). Após a perfuração, foi aguardado o
aparecimento da primeira gota de sangue, a qual foi imediatamente submetida à
avaliação do lactato em 60 segundos em mmoles/L.
Análise
estatística
Além
das análises descritivas, foram realizados testes inferenciais. A análise
estatística e os gráficos foram realizados pelo software estatístico R (R Core
Team,2020), versão 3.6.3. Testes não paramétricos realizados foram de Kruskal-Wallis e o teste de t de Student
para amostras.
Resultados
O
estudo apresentou uma amostra de 51 pacientes homens (n = 30) e mulheres (n =
21), faixa etária entre 19 e 80 anos, diagnosticados clinicamente com
espondilite anquilosante. Os participantes foram avaliados de acordo com os
critérios propostos pela American Society of Rheumatology e pelos critérios do ASDAS que relaciona o
grau de atividade da doença como inativa em moderada atividade, alta atividade
e muito alta atividade.
A
tabela I apresenta a análise descritiva em relação ao número de casos, à idade,
à proteína C-reativa absoluta e aos valores do lactato absoluto agrupados e
separados, sendo avaliados a média, valores mínimos e máximos e desvios
padrões.
Tabela
I - Análise
descritiva dos pacientes com espondilite
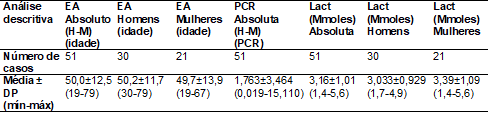
EA
= Espondilite Anquilosante; Lact = Lactacidemia
Os
dados apresentados abaixo na figura 1 estão relacionados ao comportamento da lactacidemia absoluta em homens e mulheres com espondilite
anquilosante em 100% dos casos (n = 51). A lactacidemia
se comportou nos pacientes com a doença 90,20% acima, 1,96% na normalidade e
7,84% abaixo dos valores de referência que ficam entre 1,0 e 1,8 mmoles.
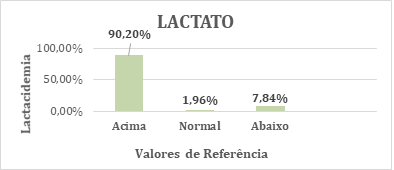
Figura
1 - Lactacidemia
absoluta
A
figura 2 relata o comportamento da lactacidemia em
homens (n = 30) e mulheres (n = 21) separados em dois grupos. Os dados
apresentados demonstram os níveis séricos do lactato mais elevados em mulheres.
Por meio do teste t student apresentou o valor de p =
0.23, não relatando significância estatística, demonstrando o valor de (p ≥
0.05). O resultado mostra que não existe uma relação entre a espondilite
anquilosante e os níveis séricos do lactato.
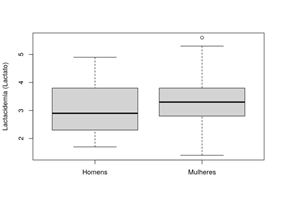
Figura
2 - Comportamento da
lactacidemia em homens e mulheres
A
análise inferencial da lactacidemia absoluta
correlacionada às atividades de doença inativa, moderada, alta e muito alta nos
pacientes agrupados, citados na figura 3, demonstra que o resultado da lactacidemia se apresentou mais elevada na inatividade da
doença. O valor apresentado através do teste estatístico de Kruskal-Wallis
foi de p= 0.73 não apresentando significância estatística na relação entre os
níveis de lactacidemia com as atividades de doença
com valor de p ≥ 0.05.
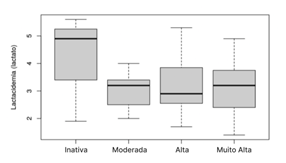
Figura
3 - Análise
inferencial da lactacidemia absoluta correlacionada
às atividades de doença inativa, moderada, alta e muito alta
A
análise inferencial da correlação entre a atividade de doença absoluta com o
resultado do exame da proteína C reativa (PCR) absoluta encontra-se na figura 4.
O teste de Kruskal Wallis demonstrou um valor p =
0,001 com significância estatística de p ≤ 0,05. Foi aplicado o teste de
comparações múltiplas. Demonstrando uma forte significância dos valores da
proteína C reativa e a doença.
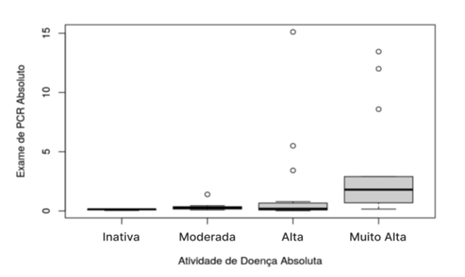
Figura
4 - Análise inferencial
da correlação entre os testes de proteína C reativa e a espondilite
anquilosante
Discussão
É
consenso que o lactato é um componente fisiológico e bioquímico produzido de
forma natural pelo organismo, encontrado no sangue, músculos, tecido adiposo e
em processos inflamatórios e em doenças de caráter específico que alteram o
metabolismo da glicose, que é produzido por meio do processo da glicogenólise e
da glicólise [15]. As alterações dos níveis do lactato estão relacionadas a
vários fatores que podem ser encontrados em doenças específicas e também
durante a atividade física [16]. A lactacidemia é
definida pelos níveis de lactato sanguíneo, sendo seus valores de normalidade
entre 1,0 e 1,8 mmoles/l. A hiperlactacidemia
acontece quando os níveis de lactato estão acima dos valores de referência e hipolactacidemia quando os níveis estão abaixo [14]. A
espondilite anquilosante é uma doença classificada no grupo das espondiloartrites, considerada uma doença incapacitante de
caráter crônico e inflamatório [1] e está envolvida com os mecanismos
autoimunes numa relação de atividade modulatória
sobre as células T. Estudos anteriores na área da reumatologia relacionam os
níveis de lactato em quantidades elevadas significantes em líquido sinovial na
artrite reumatoide [13]. Em relação ao comportamento do lactato basal, no
presente estudo, observou-se que os valores obtidos na análise in loco em
repouso nos pacientes com espondilite anquilosante se apresentaram elevados em
relação aos valores de referência em ambos os sexos. No entanto, as mulheres
apresentaram os níveis de lactato mais elevados que os homens, ainda assim não
demonstraram uma forte significância estatística.
Esse
fato não se relaciona aos estudos anteriores que demonstraram alterações do
lactato em processos inflamatórios [13], pois a espondilite anquilosante
apresenta-se etiologicamente como uma doença inflamatória. Segundo pesquisa
relacionada ao lactato e aos processos inflamatórios [13], identifica-se que o
ambiente ácido se apresenta como uma característica de locais inflamatórios.
Esses processos inflamatórios estão presentes em doenças como a sinovite
artrítica, placas ateroscleróticas e em pequenos locais tumorais onde
repercutem alterações na lactacidemia, pois está
envolvida como produto da glicólise que, em condições de hipóxia, atua na
modulação da resposta imune-inflamatória. O processo fisiológico metabólico do
lactato atua como inibidor da mobilidade das células T, o qual interfere no
processamento da glicólise necessária para a migração das células T, faz com
que essas células produzam mais citocinas pró-inflamatórias IL-17 e repercutem
numa perda da atividade citolítica em processos
inflamatórios crônicos [13].
Os
pacientes diagnosticados com a doença, por meio de critérios diagnósticos do
ASDAS (Ankylosing Spondylits
Disease Activity Score),
podem se encontrar nos escores de atividade de doença como inativa, moderada,
alta e muito alta [9]. Quando analisamos os níveis de lactato basal, os testes
realizados demonstraram que os níveis de lactato se mostraram mais elevados em
todos os níveis absolutos da doença entre homens e mulheres pareados, com uma
maior evidência nos pacientes com a doença inativa, mas não apresentando
significância da doença com a lactacidemia. A
proteína C reativa (PCR) faz parte dos critérios diagnósticos dos níveis e
graus da doença em que os pacientes espondilíticos se
encontram. A avaliação realizada entre o PCR e o lactato absoluto
correlacionados, bem como analisados separadamente entre homens e mulheres, não
se mostrou significante, não tendo relação entre as alterações dos níveis do
lactato e os valores da proteína. Os resultados apresentados entre a relação
entre a PCR absoluta e a doença absoluta criaram uma forte relação
significativa no estudo, quando os níveis da doença se apresentavam mais altos,
o nível da proteína C reativa encontrava-se mais elevado dentro dos seus
valores de referência.
Observamos
que, em outros estudos, a relação da proteína C reativa (PCR) com a espondilite
anquilosante é muito intensa em relação à atividade de doença, cerca de 50% a
70% dos pacientes com a doença ativa apresentaram elevação da PCR [17,18]. A
correlação entre a doença absoluta em homens e mulheres analisados isoladamente
não apresentou significância, apesar de os valores do lactato continuarem
elevados de acordo com a atividade da doença. A proteína C reativa absoluta
analisada relacionada entre ambos os sexos separadamente não se demonstrou
significante.
Tendo
em vista os resultados apresentados em relação aos valores significativos de p,
sugerimos novos estudos com uma amostra maior de pacientes com espondilite anquilosante
e outras doenças autoimunes, com a adição de parâmetros que nos levem a uma
interpretação dos parâmetros metabólicos em relação à lactacidemia.
Conclusão
Na
amostra envolvida neste estudo, o lactato não apresentou relação com a
espondilite anquilosante. Apesar de os valores séricos do lactato se
apresentarem elevados em todos os pacientes da amostra e nas atividades
clínicas da doença, os resultados não foram significantes. Existe a
possibilidade de que o metabolismo destes pacientes com a doença esteja
funcionando de forma anaeróbica, ou seja, sem o uso do oxigênio, utilizando o
processo da glicólise e apresentando metabolicamente o lactato como produto
final. Provavelmente o aumento dos níveis do lactato esteja envolvido com o
mecanismo de glicação que envolve o processo
inflamatório relacionado à glicose, e talvez, por esse motivo, essas alterações
estejam relacionadas ao processo inflamatório da doença e os aumentos dos
níveis séricos do lactato. Sugerimos pesquisas a posteriori com uma amostra
maior e investigações mais aprofundadas no assunto que possam relacionar os
níveis de lactato como um dos marcadores para o diagnóstico de processos
inflamatórios.
Agradecimentos
Os
autores e colaboradores agradecem à Universidade Federal do Paraná (UFPR) e ao
departamento de Reumatologia pela oportunidade da realização desta pesquisa.
Conflitos
de interesse
Os
autores declaram não haver conflito de interesse.
Fonte
de financiamento
Não
há
Contribuições
dos autores
Concepção
e desenho da pesquisa:
Sá Ribeiro GAC, Azevedo VF; Coleta de dados: Sá Ribeiro GAC, Rafael LK, Novakoski GO; Análise e interpretação dos dados: Sá
Ribeiro GAC, Azevedo VF; Análise estatística: Sá Ribeiro GAC, Petterle RR, Hajar FN; Redação
do manuscrito: Sá Ribeiro, GAC, Pallu PHR; Revisão
crítica do manuscrito quanto ao conteúdo intelectual importante: Sá
Ribeiro, GAC, Azevedo, VF.
Referências
- Zhu W, He X, Cheng K, Zhang L, Chen D, Wang X, et al.
Ankylosing spondylitis: etiology, pathogenesis, and treatments. Bone Res. 2019;7:22. doi: 10.1038/s41413-019-0057-8 [Crossref]
- Khan MA. Spondyloarthropathies. Rheum Dis Clin North Am 1992;18(1):1-276. doi: 10.1007/978-1-4615-6499-7_5 [Crossref]
- Khan MA. The Spondylarthritides. 4.ed. Oxford: Oxford University Press; 1998. doi: 10.1093/med/9780199229994.003.0007 [Crossref]
- Rosembaum JT. Acute uveitis and spondyloarthropathies.
Rheum Dis Clin North Am 1992;18(1):143-52.
- Cortes A, Pulit SL, Leo PJ, Pointon JJ, Robinson PC, Weisman MH, et al. Major histocompatibility complex associations of ankylosing spondylitis are complex and involve further epistasis with ERAP1. Nature Communications 2015;6. doi: 10.1038/ncomms8146 [Crossref]
- Ranganathan V, Gracey E, Brown MA, Inman RD, Haroon N. Pathogenesis of ankylosing spondylitis — recent advances and future directions. Nat Rev Rheumatol. 2017;13(6):359-67. doi: 10.1038/nrrheum.2017.56 [Crossref]
- Skare TL, Leite N, Bortoluzzo AB, Gonçalves
CR, Silva JAB, Ximenes AC, et al. Effect of age at disease onset in the
clinical profile of spondyloarthritis: a study of
1424 Brazilian patients. Clin Exp Rheumatol.
2012;30(3):351.
- Van Der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. Arthritis & Rheumatism. 1984;27(4):361-8. doi: 10.1002/art.1780270401 [Crossref]
- Garret S, Jenkinson T, Kennedy LG, Whitelock
H, Gaisford P, Calin A. A new approach to defining
disease status in ankylosing spondylitis: the bath ankylosing spondylitis
disease activity index. The Journal of Rheumatology. 1994;21.
- Barrie Phypers FRCA, Tom Pierce JM, MRCP FRCA. Lactate physiology in health and disease. Continuing Education in Anaesthesia Critical Care & Pain 2006;6(3):128-32. doi: 10.1093/bjaceaccp/mkl018 [Crossref]
- Johnson RN. Lactic acidosis revisited. Annals of
Clinical Biochemistry 1989;26(2):113-4. doi: 10.1177/000456328902600202 [Crossref]
- Haas R, Smith J, Rocher-Ros V, Nadkarni S, Montero-Melendez T, D'Acquisto F, et al. Lactate regulates metabolic and proinflammatory circuits in control of T cell migration and effector functions. PLoS Biology. 2015;13(7):1-24. doi: 10.1371/journal.pbio.1002202 [Crossref]
- Gobelet C, Gerster JC. Synovial fluid lactate levels in septic and
non-septic arthritides. Annals of the Rheumatic
Diseases 1984;43(5):742-45. doi: 10.1136/ard.43.5.742 [Crossref]
- Bula das Tiras Teste BM Lactato. Roche Diagnostics GmbH, Mannheim, Germany; 2017.
- Karvonen J, Vuorimaa T.
Heart and exercice intensity during sports
activities: Practical application. Sports Medicine. 1988;5:303-12. doi: 10.2165/00007256-198805050-00002 [Crossref]
- Yamada H, Iwaki Y, Kitaoka R, Fujitani M, Shibakusa T, Fujikawa T, et al. Blood lactate functions as a signal for enhancing fatty acid metabolism during exercise via TGF-B in the brain. J Nutr Sci Vitaminol (Tokyo). 2012;58:88-95. doi: 10.3177/jnsv.58.88 [Crossref]
- Jung SY, Park MC, Park YB, Lee SK. Serum Amyloid A as a useful indicator of disease activity in patients with ankylosing spondylitis. Yonsei Med J 2007;48:218-24. doi: 10.3349/ymj.2007.48.2.218 [Crossref]
- Kaya T, Bal S, Gunaydin R. Relationship between the severity of enthesitis and clinical and laboratory parameters in patients with ankylosing spondylitis. Rheumatol Int. 2007;;27:323-7. doi: 10.1007/s00296-006-0218-0 [Crossref]
