ARTIGO
ORIGINAL
Treino
do passo e da marcha com estimulação auditiva rítmica na doença de Parkinson:
um ensaio clínico randomizado piloto
Gait and step training with rhythmic auditory stimulation in Parkinson's
disease: a pilot clinical trial
Renato Alves da
Silva*, Ihana Thaís Guerra de Oliveira Gondim*, Caroline de Cássia Batista de
Souza*, Kássia Maria Clemente da Silva*, Liliane Pereira da Silva*, Maria das
Graças Wanderley de Sales Coriolano, D.Sc.**
*Programa
Pró-Parkinson, Hospital das Clínicas, Universidade Federal de Pernambuco,
Recife/PE, **Professora adjunta, Departamento de Anatomia, Universidade Federal
de Pernambuco, Recife/PE, Programa Pró-Parkinson, Hospital das Clínicas,
Universidade Federal de Pernambuco, Recife PE
Recebido em 12 de
janeiro de 2017; aceito em 9 de outubro de 2017.
Endereço
para correspondência:
Maria das Graças Wanderley de Sales Coriolano, Departamento de Anatomia, Centro
de Ciências Biológicas, Universidade Federal de Pernambuco, Av. Prof. Moraes
Rêgo, 1235, Cidade Universitária, 50670-901 Recife PE, E-mail:
proparkinsonfisio@gmail.com; Renato Alves: renatoa95@gmail.com; Ihana Thaís
Guerra de Oliveira Gondim: ihanafisio@hotmail.com; Caroline de Cássia Batista
de Souza: carolcb_souza@hotmail.com; Kássia Maria Clemente da Silva:
kassiamaria35@gmail.com; Liliane Pereira da
Silva: pereiradasilva20@hotmail.com.
Resumo
Introdução: Estudos têm
evidenciado que estímulos sensoriais podem ser utilizados para adequação da
marcha de indivíduos com doença de Parkinson. Objetivo: Avaliar os efeitos do treino do passo e da marcha
associados à estimulação auditiva rítmica sobre a marcha e mobilidade funcional
na doença de Parkinson. Métodos:
Ensaio clínico randomizado piloto. Os indivíduos foram randomicamente alocados
em dois grupos e ambos receberam como intervenção nove exercícios. O grupo com
estimulação auditiva rítmica (GEAR) executou o treino do passo e da marcha com
a estimulação auditiva rítmica, enquanto o grupo controle (GC), sem o estímulo.
Os indivíduos foram avaliados pelo Teste de caminhada de 10 metros (TC10m) e o Timed Up
& go (TUG). Resultados: O
GEAR apresentou redução do tempo no TUG (diferença de média DM = -0,27;
intervalo de confiança IC 95% 4,12-4,65) e no TC10m
(DM = -0,53; IC 95% 1,76-2,81), maior velocidade (DM = 0,14; IC 95% 0,44-0,72)
e cadência (DM= 0,12; IC 95% 0,19-0,43) no TC10m. Não houve diferença
significativa com o teste T pareado em nenhum parâmetro (p>0,05). Conclusão: Considerando as limitações,
não é possível inferir que a estimulação auditiva rítmica adicionada aos
treinos propiciou melhores resultados que a realização dos treinos
isoladamente, entretanto, a análise pareada no GEAR sugere que esta estratégia
pode ser promissora, necessitando mais investigações.
Palavras-chave: doença de Parkinson,
estimulação acústica, música, marcha, limitação da mobilidade.
Abstract
Introduction: Studies have shown that sensory stimuli can be used to adjust the gait
of individuals with Parkinson's disease. Objective:
To assess the effects of gait and step training associated with the Rhythmic
Auditory Stimulation on gait and functional mobility in Parkinson's disease. Methods: Randomized pilot clinical
trial. Subjects were randomly allocated into two groups and both received nine
exercises. The group with Rhythmic Auditory Stimulation (GRAS) performed gait
and step training with Rhythmic Auditory Stimulation, while the control group
(CG), without the stimuli. Subjects were assessed by 10-meter walk test
(10-mWT) and Timed Up & Go (TUG). Results: The GRAS showed a time
reduction in the TUG (mean difference MD = -0.27, 95%; confidence interval CI
4.12-4.65) and in the 10-mWT (MD = -0.53, 95% CI 1.76-2.81), higher speed (MD =
0.14, 95% CI 0.44-0.72) and cadence (MD = 0.12, 95% CI 0.19-0.43) at 10-mWT.
There was no significant difference in any parameter (p>0.05), using paired
T-test. Conclusion: Considering the
limitations of the study, it is not possible to infer that the Rhythmic
Auditory Stimulation added to the trainings provided better results than the realization
of the training itself, though the paired analysis of the GRAS suggests that
this strategy may be promising and raises further investigation.
Key-words: Parkinson’s
disease, acoustic stimulation, music, gait, mobility limitation.
Introdução
A dificuldade na
marcha é uma causa comum de incapacidade funcional em pessoas com doença de
Parkinson (DP) que normalmente promove diminuição da mobilidade, perda da
independência e aumento do risco de quedas. É caracterizada pela diminuição do
comprimento do passo, aumento da cadência, redução da velocidade da caminhada e
do balanço dos membros superiores, bem como aumento do tempo de duplo apoio
[1].
Uma alteração também
importante na DP é a variabilidade da marcha, que diz respeito à diminuição da
habilidade para manter um padrão e um ritmo constantes [2,3]. Esta alteração
está relacionada a uma dificuldade intrínseca para coordenar, temporalizar
movimentos e programar uma ação, ou seja, uma perda da manutenção do ritmo
temporal interno para execução de uma atividade [4,5].
Considerando a ampla
variedade de intervenções que têm como enfoque a marcha destes indivíduos,
estudos têm evidenciado que estímulos externos (auditivos, visuais e
somatossensoriais) podem ser utilizados para adequação da marcha por meio do
aumento do comprimento da passada e da regulação da cadência [6-9].
Entre os estímulos
externos, o auditivo faz-se importante no processo de facilitação da marcha
[10,11]. Também, em comparação a estimulação visual, apresenta uma melhor
resposta motora em termos de regulação da marcha quanto à manutenção do ritmo
interno [12] e melhor desempenho na execução de outras atividades realizadas
com a marcha, na chamada dupla-tarefa [13].
A estimulação
auditiva rítmica (EAR) é uma terapia promissora, sendo desenvolvida como forma
de facilitação da reabilitação de movimentos naturalmente rítmicos, como a
marcha [14]. Sendo assim, pacientes com DP vêm sendo alvo desta terapia para
melhora de padrões motores observados na sua forma de andar [6,15-17]. A EAR
geralmente utiliza a batida do metrônomo como recurso sonoro rítmico, mas
também é comum ver a associação de músicas às batidas do instrumento, ou
somente a música. A instrução básica é que o paciente execute a atividade harmonicamente
com a música, “sem sair do ritmo” [14].
Pesquisas sobre a
efetividade do treino com a EAR na DP ainda são limitadas, principalmente
quando associadas ao treino do passo e da marcha. Diante disso, este estudo tem
como objetivo avaliar os efeitos do treino do passo e da marcha associado à
técnica de EAR sobre os padrões de marcha e a mobilidade funcional na DP.
Material
e métodos
Desenho
de estudo e participantes
Trata-se de um ensaio
clínico randomizado piloto, sem cegamento, realizado entre abril de 2015 e
junho de 2016. Foram incluídas pessoas de ambos os sexos entre 45 e 70 anos,
com diagnóstico de DP idiopática de acordo com a Portaria nº 228/2010 do Ministério
da Saúde do Brasil [18], Hoehn e Yahr (HY) original I a III e atendidas pelo
Programa Pró-Parkinson do Hospital das Clínicas da Universidade Federal de
Pernambuco.
Foram critérios de
exclusão: outras doenças neurológicas; patologia ortopédica, reumática e/ou
vascular, com restrição funcional moderada ou severa em um ou ambos os membros
inferiores; hipertensão e/ou doença cardíaca não controlada; comprometimentos
visual e/ou auditivo limitantes para a execução do protocolo; amputados,
usuários de próteses e órteses em membros inferiores; e déficit cognitivo,
considerando escores do Miniexame do Estado Mental (MEEM) não correspondentes a
sua escolaridade [19].
Procedimentos
e coleta de dados
A amostra de
conveniência foi composta por voluntários encaminhados pelo ambulatório de
Neurologia do Programa Pró-Parkinson. A alocação em cada um dos dois grupos,
dez pessoas no GEAR (grupo com estimulação auditiva rítmica) e sete no GC
(grupo controle), ocorreu por meio de sorteio simples. Não foi feita a análise
por intenção de tratar.
O trabalho teve
parecer favorável do comitê de ética (CAAE nº 44385115.2.0000.5208). Após
informações a respeito da pesquisa, os participantes assinaram o Termo de
Consentimento Livre e Esclarecido (TCLE) e responderam a um questionário para
coleta de dados gerais e clínicos.
Na avaliação e
reavaliação, em fase “on” da
medicação (após 1 h da tomada da medicação), os pacientes foram submetidos a
dois instrumentos de avaliação dinâmica: 1) o teste de caminhada de 10 metros (TC10m), sendo analisadas as variáveis velocidade, cadência,
número de passos e tempo percorrido entre os marcadores; 2) o Teste Timed Up & Go (TUG). A avaliação e
reavaliação foram realizadas no período máximo de uma semana antes e após o
período de intervenção, respectivamente.
O TC10m
é um teste para análise cinemática da marcha [20]. Requer um caminho de 10 m em
linha reta, sendo os 2 m iniciais para aceleração, 6 m para andar em velocidade
autosselecionada, e os 2 m finais para desaceleração. Neste estudo, o paciente
foi instruído a caminhar em um ritmo confortável e um avaliador utilizou um
cronômetro para determinar o tempo que o paciente levou para atravessar os 6 m
centrais. Dentro dos 6 m centrais um segundo avaliador fez a contagem do número
de passos do paciente, enquanto um terceiro fez a filmagem com uma câmera ao
longo do percurso para a comprovação desta contagem. Foram tomados os
resultados de três testes realizados separadamente.
O TUG foi utilizado
para mensurar o risco de queda e a mobilidade funcional [21]. Consiste em
levantar-se de uma cadeira, sem ajuda dos braços, andar a uma distância de três
metros, dar a volta e retornar. No início do teste, o paciente deve estar com o
dorso apoiado no encosto da cadeira e, ao final, deve encostar novamente. O
paciente deve receber a instrução “vá” para realizar o teste e o tempo será
cronometrado a partir do comando de voz até o momento em que ele apoie
novamente o dorso no encosto da cadeira. O teste deve ser realizado uma vez
para familiarização e uma segunda vez para tomada do tempo. Foram tomadas
quatro medidas. Com a primeira descartada, tiramos a média aritmética das três
últimas.
Intervenção
Ambos os grupos
receberam como intervenção um tratamento fisioterapêutico composto por nove
exercícios com enfoque em queixas e disfunções motoras da doença. Foram
realizadas 15 sessões, duas vezes por semana, com duração
média de 50 minutos e aplicadas em três níveis de dificuldade progressiva, com
modificação da complexidade nas sessões seis e onze. O protocolo,
desenvolvido pelo grupo Pró-Parkinson Fisioterapia, teve como base as
“Diretrizes fisioterapêuticas para pacientes com doença de Parkinson”, da
Sociedade Holandesa de Fisioterapia [22].
O GC participou
normalmente dos atendimentos com o protocolo fisioterapêutico, enquanto o GEAR
participou com o mesmo protocolo adicionado da EAR durante os exercícios de
treino de marcha e do passo, exercícios que também seguiam a lógica da
graduação da dificuldade de acordo com a fase do protocolo.
O estímulo auditivo
foi constituído por batidas do metrônomo mediante uso do aplicativo para Android “Metrônomo
Batidas”. O metrônomo é um instrumento que produz pulsos regulares e
uniformes, sendo utilizado para fins de estudo, execução musical e faixas
musicais com tempo e andamento fixos bem demarcados. Cada participante do GEAR
foi equipado com um headphone
conectado a um player durante toda a
seção do treino do passo e da marcha.
O andamento de cada
música foi expresso pela medida de frequência de batidas por minuto (BPM). Os
arranjos encontraram-se entre as faixas de Larghetto
(60 BPM) e Allegro (160 BPM), com
incrementos de 5 em 5 BPM (60, 65, 70...160 BPM), e
gravados em um player. O volume
sonoro oferecido na estimulação auditiva rítmica foi de aproximadamente 60 dB, nível bem acima daquele percebido por idosos com perda
auditiva, que é de 25 a 40 dB [23].
O treino da marcha
nos dois grupos foi realizado em duas velocidades: normal/confortável (a do seu
cotidiano) e rápida (ou acelerada). Os pacientes receberam orientações quanto à
pisada correta e dissociação de cinturas, além de serem incentivados a aumentar
o comprimento do passo sem perder a velocidade. Na primeira fase, em barras
paralelas, trabalharam-se as marchas anterior, lateral e posterior (por
segurança, esta última somente treinada em velocidade normal). Na fase dois,
marcha livre em corredor, numa distância de 100 metros. Na última fase foram
adicionadas tornozeleiras de ½ kg em cada perna.
O GEAR foi instruído
a realizar as duas velocidades “sem sair do ritmo do som”
emitido pelo headphone. Dessa
forma, estímulos sonoros com diferentes andamentos foram aplicados para esse
exercício: um estímulo semelhante à cadência normal do paciente e outro com
andamento numericamente superior em cerca de 15%, ou
seja, dentro da faixa utilizada em estudos anteriores [8,9,24]. A cadência
normal do exercício adotada para cada paciente foi definida já no momento da
avaliação, com o TC10m, através da transformação de
medidas: de passos por segundo (passos/s) para passos por minuto (passos/m), ou
seja, multiplicando-se por 60. O GC recebeu o comando de “andar normalmente”,
quando em velocidade normal, e “andar mais rápido sem perder o ritmo” para a
velocidade superior.
O treino do passo era
iniciado diariamente com um sorteio para definição da sequência das pernas
(direita ou esquerda) e das direções que o paciente iria desempenhar naquele
dia de acordo com a fase do protocolo. De pé, em posição anatômica, era
assistido lateralmente de uma barra e de um terapeuta, para prevenir possíveis
acidentes.
Diferentemente do
treino da marcha, o treino do passo foi trabalhado em 3
velocidades: normal, lenta e rápida. A primeira fase, a única que o participante
reproduzia cada velocidade duas vezes, constou de três passos unidirecionais
(frente-volta; lado-volta; trás-volta), a segunda de seis bidirecionais
(trás-frente-volta; trás-lado-volta; frente-lado-volta; frente-trás-volta;
lado-frente-volta; lado-trás-volta) e a terceira de seis passos tridirecionais
(trás-frente-lado-volta; trás-lado-frente-volta; frente-lado-trás-volta;
frente-trás-lado-volta; lado-frente-trás-volta; lado-trás-frente-volta). Nas
fases dois e três reproduzia cada exercício somente uma vez em cada velocidade.
O GEAR foi instruído
a realizar os passos requisitados “sem sair do compasso ou batida do
metrônomo”. Como em um estudo anterior [15], utilizamos três faixas de
andamento no metrônomo: normal/confortável (com andamento semelhante à cadência
normal avaliada para o treino do passo), rápida (10 a 20% maior que o normal) e
lenta (10 a 20% menor que o normal). Utilizamos o compasso binário para a fase
um, o ternário para a fase dois e o quaternário para a fase três. O GC realizou
as três velocidades sem o estímulo, em seu próprio ritmo.
Aferimos a cadência
normal para o treino do passo do grupo EAR no primeiro dia de intervenção. Com
o auxílio de um cronômetro, no período de 10 segundos, verificamos a quantidade
de vezes repetidas, em velocidade confortável, que o paciente tocava com o pé o
chão a sua frente e voltava (como se fosse dar um passo a frente e voltasse
ininterruptas vezes). Obtendo o resultado em toques por 10 segundos
(toques/10s), reproduzimos o processo duas vezes em cada perna alternadamente,
e depois tiramos uma média aritmética dos quatro testes. O resultado final foi
multiplicado por 6, a fim de adequar para toques por
minuto (toques/min) e relacioná-lo ao andamento do metrônomo (em batidas por
minuto).
Análise
estatística
Os dados foram
expressos através de estatística descritiva em medidas de tendência central e
dispersão e analisados com software BioEstat5.3
considerando p<0,05. Para análise intragrupo foi utilizado Teste T pareado e
intergrupo, Teste T independente.
Resultados
A amostra analisada
foi composta por seis indivíduos (Figura 1), sendo três no GEAR e três no GC.
Quanto ao estágio da doença, o GEAR apresentou dois pacientes com HY2 e um HY3,
já o GC apresentou dois indivíduos com HY2 e um com HY1. Todos os pacientes
apresentaram MEEM compatível com a escolaridade. Apesar da pequena amostra, os
grupos foram considerados iguais antes da intervenção (Tabela I).
No GEAR, o tempo no
TUG e o tempo no TC10m diminuíram, enquanto que a
velocidade e a cadência no TC10m aumentaram, com diferença estatisticamente
significativa (p<0,05) para o tempo e cadência no TC10m (Tabela II). Já no
grupo controle, o tempo no TUG, o tempo no TC10m e o
número de passos diminuíram, enquanto que a velocidade e a cadência no TC10m
aumentaram, mas sem diferença significativa (Tabela III).
O tempo no TUG, o
tempo no TC10m e o número de passos no GEAR foi menor
do que no grupo controle, enquanto que a velocidade e a cadência no TC10m foram
maiores no GEAR, mas sem diferença significativa (Tabela IV).
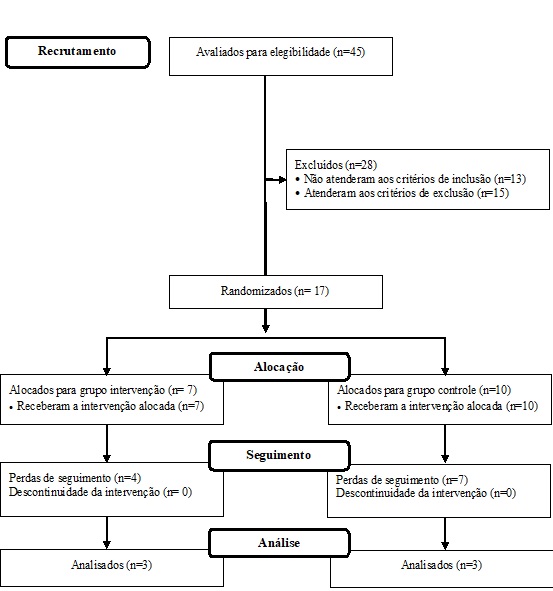
Figura
1 - Fluxograma de constituição amostral.
Tabela
I - Características gerais da amostra (dados de
antes da intervenção).
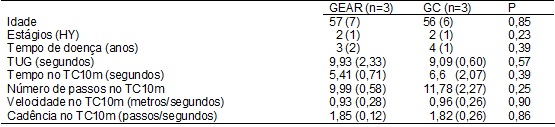
P = Teste T
independente; GEAR = Grupo com a estimulação auditiva rítmica; GC = Grupo
controle; HY = Escala de Hoehn and Yahr; TUG = Timed up & go; TC10 = Teste de caminhada de 10 metros. Valores
expressos em média e seus respectivos desvios-padrão.
Tabela
II -
Resultado da intervenção com a
Estimulação auditiva rítmica.
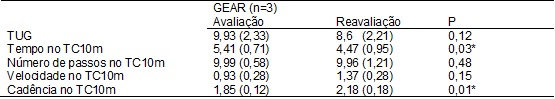
P = Teste T pareado;
GEAR = Grupo com a estimulação auditiva rítmica; TUG = Timed up & go; TC10m = Teste de caminhada de 10 metros; Valores
expressos em média e seus respectivos desvios-padrão. *p<0,05.
Tabela
III
- Resultado da intervenção sem
Estimulação auditiva rítmica.

P = Teste T pareado;
GC = Grupo controle; TUG = Timed up & go; TC10m =
Teste de caminhada de 10 metros; Valores expressos em média e seus respectivos
desvios-padrão.
Tabela
IV -
Comparação entre os grupos após a
intervenção.
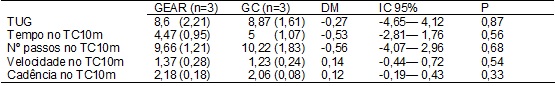
DM = Diferença de
médias; IC = Intervalo de confiança da média; P = Teste T independente; GEAR =
Grupo com a estimulação auditiva rítmica; GC = Grupo controle; TUG = Timed up &
go; TC10m = Teste de caminhada de 10 metros; Valores expressos em média e seus
respectivos desvios-padrão.
Discussão
Na busca por um
melhor desempenho na reabilitação da marcha de indivíduos com DP, o presente
estudo investigou o efeito da incorporação da EAR aos exercícios de treino da
marcha e do passo sobre a mobilidade e a marcha desses pacientes. A hipótese
inicial era que a adição da EAR melhoraria os desfechos em questão, entretanto,
utilizando uma amostra pequena, não achamos nenhuma diferença estatística
significativa entre as duas formas de intervenção.
Dos nove exercícios
do protocolo deste estudo, sete não tinham como enfoque os ganhos sobre a
marcha e mobilidade, mas sim outras queixas motoras evidenciadas pela
literatura [22] buscando melhor atender às demandas do paciente com DP.
Ademais, utilizou-se a associação dos treinos da marcha e do passo à EAR,
combinação terapêutica essa não localizada na literatura. Estudo com pacientes
com DP [25] que utilizou os treinos da marcha e do passo sem a EAR mostrou
resultados favoráveis para a melhora da marcha e redução do risco de quedas. O
treino do passo, isoladamente, parece reduzir em aproximadamente 50% o risco de
quedas em idosos saudáveis [26] e, quando realizado em pacientes parkinsonianos
e associado à EAR [15], possibilita melhores resultados na mobilidade através
do TUG e na diminuição de episódios de congelamento. Neste estudo, não houve
nenhuma diferença estatística significativa intergrupos em relação ao TUG, não
obstante tenha havido uma diminuição maior na diferença de média do grupo que
recebeu a estimulação auditiva, o que sugere um melhor efeito na mobilidade e
na prevenção ao risco de quedas.
Para avaliação das
variáveis da marcha utilizamos o TC10m, um teste
recomendado para esse fim em pacientes com DP [27]. Observou-se um aumento
maior da velocidade no GEAR, embora não significativo. Biomecanicamente, esse
aumento pode ser explicado como resultado do incremento da cadência ou do
comprimento do passo. Como a cadência nesses indivíduos geralmente encontra-se
com valores elevados e associada a passos curtos, é
interessante uma terapia que consiga aumentar a velocidade da marcha e o
comprimento do passo sem aumentar a relação de passos pelo tempo. Não avaliamos
o comprimento e o tempo do passo e da passada e variabilidade por não
possuirmos um aparato tecnológico que possibilitasse tal aferição.
Uma revisão
sistemática com metanálise [28], com uso de metodologias diversas e estímulos
auditivos em diferentes tempos de intervenção, evidenciou um incremento
significativo da velocidade associado aos aumentos de cadência e comprimento do
passo na marcha desses pacientes. Tal resultado faz pensar em uma marcha mais
rápida e com passos mais longos, porém não suficientemente grandes para
provocar uma diminuição da relação de passos pelo tempo quando adicionamos a
EAR. Semelhante à revisão sistemática, neste trabalho houve um aumento
significativo da cadência no grupo com a pista auditiva (indicando uma
limitação deste tipo de intervenção), mas não se sabe se esta foi acompanhada
do aumento do comprimento do passo.
Embora os ganhos com
a associação dos exercícios com a EAR não tenham se mostrado significativos, um
fator que pode ser ponderado pelo terapeuta na decisão clínica é o prazer e a
felicidade relatados pelos pacientes quando se exercitam com a música [29]. De
fato, o bem-estar também experienciado no GEAR pode estar relacionado à melhora
da motivação [30], à menor percepção da fadiga, e/ou à tolerância por mais
tempo ao exercício [31], proporcionados pelo estímulo
sonoro, o que faz pensar que os efeitos da adição da EAR aos treinos suscitam
maiores investigações.
Das limitações, o
primeiro fator limitador é que o protocolo deste estudo se propôs a investigar
os efeitos da EAR na faixa de estadiamento de leve a moderada da doença e, por
isso, sugere-se cautela quanto ao emprego deste em pacientes com DP avançada. O
segundo diz respeito ao número importante de pacientes que entraram nos
critérios de exclusão. Embora muitos não se situassem entre os critérios de
exclusão, possuíam dificuldades de locomoção ou não dispunham do auxílio de
terceiros para se deslocar até o serviço. Outra questão a ser elencada foi a quantidade de pacientes que tiveram que abandonar a
terapia, em especial, devido à epidemia de arboviroses no estado de Pernambuco,
Brasil.
Conclusão
Considerando as
limitações do estudo, não é possível inferir que a EAR adicionada aos treinos
propiciou melhores resultados do que a realização dos treinos isoladamente,
entretanto a análise pareada no GEAR sugere que essa estratégia pode ser
promissora e suscita mais investigações.
Agradecimentos
À Pró-Reitoria para
Assuntos de Pesquisa e Pós-Graduação (PROPESQ) da Universidade Federal de
Pernambuco e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico
(CNPq) pelo apoio e fomento.
Referências
- Morris ME, Iansek R,
Matyas TA, Summers JJ. The pathogenesis of gait hypokinesia in
Parkinson’s disease. Brain 1994;117(Pt 5:1169-1.
- Blin O, Ferrandez AM, Serratrice
G. Quantitative analysis of gait in Parkinson patients: Increased variability
of stride length. J Neurol Sci
1990;98:91-7.
- Del Olmo MF, Cudeiro
J. Temporal variability of gait in Parkinson disease: Effects of a rehabilitation
programme based on rhythmic sound cues. Park Relat Disord 2005;11(1):25-33.
- Jones CRG, Malone TJL, Dirnberger G, Edwards
M, Jahanshahi M. Basal ganglia, dopamine and temporal
processing: performance on three timing tasks on and off medication in Parkinson’s
disease. Brain Cogn 2008;68:30-41.
- Wearden JH, Smith-Spark JH, Cousins R, Edelstyn NMJ,
Cody FWJ, O’Boyle DJ. Stimulus
timing by people with Parkinson’s disease. Brain Cogn
2008;67:264-79.
- Nieuwboer A, Kwakkel G, Rochester L, Jones D, van Wegen
E, Willems AM, et al. Cueing training in the home improves gait-related
mobility in Parkinson’s disease: the RESCUE trial. J Neurol
Neurosurg Psychiatry 2007;78:134-40.
- McIntosh GC, Rice RR, Hurt C, Thaut MH. Long-term training effects of rhythmic auditory stimulation on gait
in patients with Parkinson’s disease. Mov Disord 1998;13:212.
- Suteerawattananon M, Morris GS, Etnyre BR, Jankovic J, Protas EJ. Effects of visual and auditory cues on gait in
individuals with Parkinson’s disease. J Neurol
Sci 2004;219:63-9.
- Thaut MH, McIntosh GC, Rice RR, Miller
RA, Rathbun J, Brault JM. Rhythmic auditory stimulation in gait training for Parkinson’s
disease patients. Mov Disord
1996;11(2):193-200.
- Nieuwboer A, Baker K, Willems
A-M, Jones D, Spildooren J, Lim I et al. The
short-term effects of different cueing modalities on turn speed in people with
Parkinson’s disease. Neurorehabil Neural Repair 2009;23:831-6.
- Lim I, van Wegen E, Jones D, Rochester L, Nieuwboer A, Willems A-M et al. Does cueing training
improve physical activity in patients with Parkinson’s disease?
Neurorehabilitation and Neural Repair 2010;24(5):469-77.
- Jantzen KJ, Steinberg FL, Kelso JAS. Functional MRI reveals the existence of modality and
coordination-dependent timing networks. Neuroimage
2005;25:1031-42.
- Rochester L, Hetherington V, Jones D, Nieuwboer
A, Willems AM, Kwakkel G et al. The
effect of external rhythmic cues (auditory and visual) on walking during a
functional task in homes of people with Parkinson’s disease. Arch Phys
Med Rehabil 2005;86:999-1006.
- Nombela C, Hughes LE, Owen
AM, Grahn JA. Into the groove: can rhythm influence
Parkinson’s disease? Neurosci
Biobehav Rev 2013;37(10):2564-70.
- Kadivar Z, Corcos DM,
Foto J, Hondzinski JM. Effect of step training and rhythmic auditory stimulation on functional
performance in Parkinson patients. Neurorehabil Neural Repair 2011;25:626-35.
- McIntosh GC, Brown SH, Rice RR, Thaut MH. Rhythmic auditory-motor facilitation of gait patterns in patients
with Parkinson’s disease. J Neurol Neurosurg Psychiatry 1997;62:22–6.
- Freedland RL, Festa C, Sealy M, McBean A, Elghazaly P, Capan A et al. The effects of pulsed auditory stimulation
on various gait measurements in persons with Parkinson’s
Disease. Neuro
Rehabilitation 2002;17(1):81-7.
- Ministério da Saúde,
Secretaria de Atenção à Saúde. Cadernos de Atenção Primária
Rastreamento 2010;29:95.
- Lourenço R, Veras RP.
Mini-Exame do Estado Mental: características psicométricas em idosos
ambulatoriais. Rev Saude
Publica 2006;40(4):712-9.
- Lang JT, Kassan TO, Devaney LL, Colon-Semenza C, Joseph MF. Test-retest reliability and minimal
detectable change for the 10-meter walk test in older adults with Parkinson’s
disease. J Geriatr Phys Ther
2016;39(4):165-70.
- Steffen T, Seney M. Test-retest reliability
and minimal detectable change on balance and ambulation tests, the 36-item
short-form health survey, and the unified Parkinson disease rating scale in
people with parkinsonism. Phys Ther
2008;88(6):733-46.
- Keus SH, Hendriks HJ, Bloem BR, Bredero-Cohen AB, Goede CJT, van Haaren M et al.
KNGF Guidelines for physical therapy in patients with Parkinson´s disease.
Dutch J Physiothapy 2004;114(3Supl):1-86.
- Dalton DS, Cruickshanks KJ, Klein BEK, Klein
R, Wiley TL, Nondahl DM. The impact of hearing loss on quality of life in
older adults. Gerontologist 2003;43:661-8.
- Ford MP, Malone LA, Nyikos I, Yelisetty R, Bickel CS. Gait training
with progressive external auditory cueing in persons with Parkinson’s
disease. Arch Phys Med Rehabil 2010;91:1255–61.
- Protas EJ, Mitchell K, Williams A, Qureshy H, Caroline K, Lai EC. Gait and
step training to reduce falls in Parkinson’s disease. Neuro Rehabil 2005;20:183-90.
- Okubo Y, Schoene D, Lord SR. Step training
improves reaction time, gait and balance and reduces falls in older people: a
systematic review and meta-analysis. Br J Sports Med 2017;51:586-93.
- Bloem BR, Marinus
J, Almeida Q, Dibble L, Nieuwboer A, Post B et al.
Measurement instruments to assess posture, gait, and balance in Parkinson’s
disease: Critique and recommendations. Mov Disord 2016;31(9):1342-55.
- Spaulding SJ, Barber B, Colby M, Cormack B, Mick T, Jenkins ME. Cueing
and gait improvement among people with Parkinson’s disease: A meta-analysis.
Arch Phys Med Rehabil 2013;94(3)562-70.
- Pacchetti C, Mancini F, Aglieri R, Fundarò C, Martignoni E, Nappi G. Active
music therapy in Parkinson’s disease: an integrative method for motor and
emotional rehabilitation. Psychosom Med 2000;62:386-93.
- Salimpoor VN, Zald DH, Zatorre RJ, Dagher A, McIntosh AR. Predictions and the brain: How
musical sounds become rewarding. Trends Cogn Sci 2015;19(2):86-91.
- Clair AA, Lyons KE, Hamburg J. A feasibility study of the effects of music and movement on physical
function, quality of life, depression, and anxiety in patients with parkinson disease. Music Med 2012;4:49-55.