RELATO
DE CASO
Perfil
ventilatório e capacidade funcional de pacientes com mucopolissacaridoses
Ventilatory profile and
functional capacity of patients with mucopolysaccharidosis
Juliana Leal de
Oliveira, Ft., M.Sc.*, Fernanda Warken Rosa Camelier,
Ft.,D.Sc.**, Fabíola Ramos Jesus, Ft.***, Rosa Maria Alves Barreto, Ft.****,
Palmireno Pinheiro Ferreira, M.Sc.*****, Regina Terse-Ramos, D.Sc.******,
Emília Katiane Embiruçu de Araújo Leão, D.Sc.*******, Angelina Xavier Acosta,
D.Sc.********, Carlos Maurício Cardeal Mendes, D.Sc.*********
*Mestre
pelo programa de pós-graduação de processos interativos de órgãos e sistemas
(ICS/UFBA), **Pós Doutoral na Universitat de Barcelona-Espanha, Professora
adjunta (UNEB-BA), ***Pós-graduada do Programa de Residência Integrada
Multiprofissional em Saúde (HUPES/UFBA), ****Hospital Universitário Professor
Edgar Santos (HUPES/UFBA), *****Especialista em Fisioterapia Cardiorrespiratória
pela Universidade de Tuiuti no Paraná (UTP), Mestre em Medicina e Saúde (UFBA),
******Médica, Professora adjunta do Departamento de Pediatria – FMB (UFBA),
*******Médica, Professora adjunta (UNEB-BA), ********Médica, Professora associada
nível II do departamento de Pediatria (UFBA), *********Médico, especialista em
Saúde Pública - ENSP/UFBA e Estatística Aplicada (UFBA), Professor da
Pós-Graduação - ICS/UFBA
Recebido em 25 de
fevereiro de 2016; aceito em 3 de fevereiro de 2017.
Endereço
para correspondência:
Juliana Leal de Oliveira, Rua Luís de Camões, Ed. Camões, 101/012, 40270909
Salvador BA, E-mail: jlealfisio@yahoo.com.br; Fernanda Warker Rosa Camelier:
fwrcamelier@yahoo.com.br; Fabíola Ramos Jesus: fisiobiola@gmail.com; Rosa Maria
Alves Barreto: rmabfisio@yahoo.com.br; Palmireno Pinheiro Ferreira:
palmipf@uol.com.br; Regina Terse-Ramos: reginaterse@gmail.com; Emília Katiane
Embiruçu de Araújo Leão : ekeleao@yahoo.com.br;
Angelina Xavier Acosta: axacosta@hotmail.com; Carlos Maurício Cardeal Mendes:
mcardeal@ufba.br
Resumo
Objetivos: Caracterizar o
perfil ventilatório e a capacidade funcional de pacientes com
mucopolissacaridoses (MPS). Métodos:
O perfil ventilatório caracterizou-se pela espirometria e pela forma da caixa
torácica. A capacidade funcional foi obtida pela distância percorrida no teste
de caminhada de seis minutos (DTC6M) e por questionários funcionais, Childhood Health Assessment Questionaire (CHAQ)
e Health Assessment Questionaire
(HAQ). Resultados: Dezenove pacientes
com MPS, maioria do sexo masculino 16 (84,2%) e com mediana e intervalo
interquartilíco (IIQ) de idade de 13,4 (6,3) anos. O MPS VI
foi o mais frequente, 57,9%. Alteração na espirometria em 17/18 pacientes, com
predomínio para o distúrbio ventilatório restritivo (DVR), 72,2%. Apresentaram alteração
da caixa torácica 73,7%. Houve piora da capacidade vital forçada (CVF) (%
previsto) com o aumento da idade para todos os tipos (r = -0,37) e, ao retirar
da análise o tipo II, a correlação aumentou consideravelmente (r = -0,726). A
DTC6M em mediana e IIQ foi de 349 (106,5) metros, com
variação mediana percentual, 64,7%, da distância percorrida prevista obtida
pela equação de referência para indivíduos saudáveis, 575,2 (128,5) metros. Nos
questionários funcionais, 13/19 pacientes tiveram leve comprometimento da
capacidade funcional. Conclusão:
Houve alterações da função pulmonar na espirometria, da caixa torácica e
comprometimento da capacidade funcional.
Palavras-chave:
mucopolissacaridoses, espirometria, teste de esforço, atividades cotidianas.
Abstract
Aims: To characterize the
ventilatory profile and functional capacity of
patients with mucopolysaccharidosis. Methods: The ventilatory
profile was characterized by spirometry and evaluating the shape of the rib
cage. Functional capacity was obtained by the distance covered on the
six-minute walk test (6MWD) and, through functional questionnaires, the
Childhood Health Assessment Questionnaire (CHAQ) and the Health Assessment
Questionnaire (HAQ). Results:
Nineteen patients were evaluated with MPS, most males, 16 (84.2%) with median
and interquartile range (IQR) age of 13.4 (6.3) years. The most common types
were VI, 57.9%. Change in spirometry in 17/18 patients who were examined, with
predominance of restrictive ventilatory disorder,
72.2%. 73.7% patients had abnormal rib cage. There was worsening on forced
vital capacity (FVC) (% predicted) with increasing age for all types (r =
-0.37) and when withdrawing from Type II analysis, the correlation increased
significantly (r = -0.726). The 6MWD median was 349 (IQR = 106.5) meters, with
median percentage change, 64.7%, of distance traveled expected and obtained by
reference equation for healthy individuals, 575.2(128.5) meters. Thirteen among
19 patients were assessed by functional questionnaires with mild impairment of
functional capacity. Conclusion:
Alterations were found in lung function through spirometry, abnormal rib cage
and impaired functional capacity.
Key-words: mucopolysaccharidosis, spirometry, exercise testing, daily
activities.
Introdução
As
mucopolissacaridoses (MPS) são doenças hereditárias raras causadas pela
deficiência de enzimas lisossômicas específicas, levando ao acúmulo lisossomial
de glicosaminoglicanos (GAG) com alteração do metabolismo celular,
comprometimento multissistêmico [1], envolvimento respiratório [2] e
incapacidade funcional [3].
Entre os fatores
relacionados ao comprometimento respiratório, a macroglossia e alterações
mandibulares aumentam o risco de obstruções nas vias aéreas. Pode ocorrer
depósito de GAG na parede da traqueia, com seu estreitamento, prejudicando a
função respiratória [4]; e no parênquima pulmonar, levar a uma doença
intersticial crônica que poderá resultar em comprometimento ventilatório
restritivo [5]. Anormalidades esqueléticas do tórax e a hepatoesplenomegalia
podem prejudicar a mobilidade diafragmática e a biomecânica pulmonar [6],
levando a redução de volumes e capacidades pulmonares [5]. A associação entre a
função ventilatória e as anormalidades musculoesqueléticas podem exigir um maior
esforço para realizar tarefas básicas [7], podendo levar a incapacidade funcional [3], e ambas são alterações que podem estar
presentes nos pacientes com MPS.
A correlação entre o
comprometimento da capacidade funcional e a gravidade da doença tem sido
abordada por instrumentos validados, com objetivo de avaliar a funcionalidade
[3] e a tolerância ao esforço durante uma atividade [8]. Sua aplicação é
importante em doenças crônicas no intuito de acompanhar a progressão da doença
e estabelecer planos terapêuticos individualizados.
A MPS é uma
enfermidade com baixa incidência mundial, de natureza crônica, progressiva,
incapacitante funcionalmente, com comprometimento respiratório, sendo de grande
interesse para a Fisioterapia. Entretanto, ainda existem poucos estudos sobre
as alterações respiratórias e a capacidade funcional de pacientes com MPS.
Assim, o objetivo deste trabalho é caracterizar o perfil ventilatório e a
capacidade funcional de uma série de pacientes com diagnóstico de MPS, no intuito
de agregar conhecimento sobre o tema e alertar sobre a necessidade de seu
diagnóstico precoce, enfatizando a importância da utilização de instrumentos
que acompanhem a progressão da doença, favorecendo o estabelecimento de
propostas terapêuticas, destacando a atuação do fisioterapeuta neste contexto.
Material
e métodos
Estudo de série de
casos realizado, em 2014, em pacientes com diagnóstico de MPS por amostra de
conveniência, acompanhados no Serviço de Genética Médica do Hospital
Universitário Professor Edgar Santos – HUPES/UFBA, Salvador/BA. Os critérios de
inclusão foram: diagnóstico confirmado de MPS obtido nos prontuários, idade
superior a 6 anos, capacidade de deambulação e
assinatura do termo de consentimento livre e esclarecido. Os critérios de
exclusão foram: a falta de colaboração e compreensão do paciente e desistência
da continuidade de participação da pesquisa.
Coleta
de dados
Foram mensuradas:
naturalidade, sexo, idade, peso, altura, tipo de MPS, realização ou não de
terapia de reposição enzimática (TRE), tempo de tratamento, idade do
diagnóstico, acompanhamento fisioterapêutico (avaliações periódicas semanais,
mensais e/ou semestrais), alteração da caixa torácica (cifose torácica,
escoliose, pectus carinatum e pectus escavatum). As alterações da
caixa torácica foram obtidas de dados de prontuários e confirmadas no exame
físico, através da avaliação postural por inspeção da caixa torácica. A
caracterização do perfil ventilatório foi pela espirometria e seus parâmetros
foram coletados: capacidade vital forçada (CVF), volume expiratório forçado no primeiro segundo (VEF1), relação VEF1/CVF, fluxo expiratório
forçado entre 25-75% da CVF (FEF25%-75%) e, o diagnóstico obtido no exame. A
distância percorrida foi obtida no teste de caminhada de seis minutos (DTC6M)
e, finalmente, a pontuação nos questionários Childhood Health Assessment Questionaire (CHAQ) e o Health Assessment Questionaire (HAQ).
Espirometria
A espirometria foi
realizada nos maiores de seis anos dentro das normas previstas na literatura
[9,10], utilizando o aparelho Koko (PDS Instrumentation Inc., Louisville, CO,
EUA). As variáveis analisadas foram: CVF, VEF1 e FEF25-75%, cujos valores foram
representados em percentual do previsto para sexo, idade e altura segundo as
normas da ATS e a tabela de Kudson para crianças e adolescentes [11,12].
Segundo a literatura foi aceito o nível percentual de 80%, com relação aos
valores previstos para altura e sexo, como limite inferior da normalidade para
os parâmetros da CVF, VEF1 e da relação VEF1/CVF; para o FEF25-75%, foi aceito o limite inferior de 70% [9,11].
A classificação da
gravidade do distúrbio ventilatório de acordo com os resultados obtidos na
espirometria foi estabelecida com critérios da literatura [13].
Teste
de caminhada de seis minutos (TC6M)
O TC6M foi utilizado
para avaliar a capacidade funcional e realizado com critérios padronizados pela
American Thoracic Society (ATS) [14].
A previsão da DTC6M
foi obtida através de duas equações de referência brasileiras que são
utilizadas para indivíduos saudáveis, uma referente à faixa etária de 6 a 12
anos: DTC6M = 145,343 + (11,78 x idadeanos) + (292,22 x estaturam)
+ (0,611 x diferença absoluta na FC) – (2,684 x pesokg) [15] e a
outra compreendendo a faixa etária de 13 a 84 anos: DTC6M = 622,461 – (1,846 x
Idadeanos) + (61,503 x Gênerohomens = 1; mulheres = 0)
[16].
Health Assessment Questionnaire (HAQ) e Childhood
Health Assessment Questionnaire (CHAQ)
Os aspectos físicos
da capacidade funcional foram avaliados pela aplicação dos questionários
validados para a língua portuguesa, o CHAQ, destinado aos pais, e o HAQ podendo
ser respondido pelos próprios pacientes quando estes tivessem idade superior a
14 anos [17] e conseguissem responder sozinhos.
A versão do HAQ/CHAQ
é composta de 20 perguntas em 8 domínios que avalia
atividades do dia a dia: vestir-se e realizar cuidados pessoais, levantar-se,
alimentar-se, andar, realizar a higiene pessoal, alcançar objetos e, segurá-los
e desenvolver atividades gerais; e a sua pontuação indica o grau de dificuldade
para realizar essas atividades (0, sem dificuldade; 1, com alguma dificuldade;
2, muita dificuldade; ou 3, incapaz de realizar) [18,19].
Análise
estatística
O plano amostral foi
não probabilístico, assim não foram calculadas estatísticas inferenciais devido
a estimativa inadequada do erro padrão em tal
circunstância [20]. Foram calculadas as estatísticas descritivas (proporções,
medidas de tendência central e dispersão) adequadas ao nível de mensuração das
variáveis do estudo. Para se avaliar a correlação entre a variável CVF da
função pulmonar com a idade dos pacientes, foi utilizado o coeficiente de
correlação de Spearman. Os dados foram digitados no Epidata [21] e analisados
no pacote estatístico R.
Ética
em pesquisa
A participação na
pesquisa foi condicionada à anuência do paciente ou seu responsável com o TCLE
e o termo de assentimento livre e esclarecido nas crianças acima de seis anos
de idade, conforme o Art. IV.2 Resolução CNS nº
466/12. O projeto de pesquisa foi aprovado sob protocolo
801.670, pelo Comitê de Ética e Pesquisa do Instituto de Ciências da Saúde da Universidade
Federal da Bahia.
Resultados
Todos os pacientes realizaram o TC6M, um
paciente não conseguiu realizar o exame da função pulmonar devido à dificuldade
de compreensão da técnica. Treze deles foram avaliados pelo questionário
funcional.
Características
clínico-epidemiológicas
Dos 19 pacientes, a
maioria foi do sexo masculino, 16(84,2%), com mediana e intervalo
interquartílico (IIQ) de idade de 13,4 (7,1) anos, pesando 23,9 (20,5) kg e com
baixa estatura, 1,2 (0,3) metros. Houve predomínio de MPS tipo VI com 11
(57,9%) pacientes. A mediana e IIQ de idade do diagnóstico foi tardia, 4(3,5) anos, com idade mediana e IIQ de aparecimento dos
primeiros sintomas respiratórios de 3 (2,8) anos, apresentando como sintomas
mais referidos a dispneia e o ronco (Tabela I).
Tabela
I - Características clínico-epidemiológicas dos
pacientes com MPS, Salvador/BA, 2014 (N = 19).
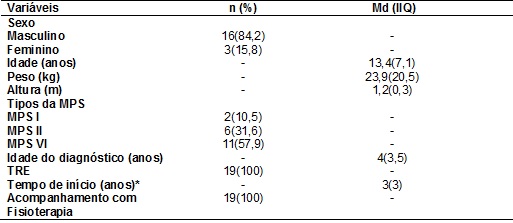
TRE: Terapia de
reposição enzimática; Md: Mediana; IIQ: intervalo interquartílico (percentil
75-percentil 25); Acompanhamento com fisioterapia refere-se às avaliações
periódicas desses pacientes; * Um paciente tinha menos de um ano de idade no
início da TRE na avaliação e dois valores foram perdidos.
Caracterização
do perfil ventilatório
Os valores
espirométricos medianos em porcentagem do previsto foram respectivamente para a
CVF, 39,5 (30,5)% e, para o VEF1, 42 (22,5)%. A
relação VEF1/CVF obteve mediana de 100 (21,6)% (Tabela
II). O tipo de distúrbio ventilatório mais frequente foi o restritivo (DVR) com
72,2% dos pacientes, 22,2% com distúrbio ventilatório obstrutivo (DVO) e,
desses, três com VEF1/CVF abaixo de 80% do previsto e um com DVO leve,
caracterizado por redução do FEF25-75%; um paciente apresentou função pulmonar
normal. A maioria dos pacientes apresentou alteração da caixa torácica, 73,7%,
com maior frequência para cifose torácica (35,7%) (Tabela III).
Tabela
II -
Caracterização dos parâmetros da
espirometria dos pacientes com MPS, Salvador/ BA, 2014 (N = 18).

CVF = Capacidade vital
forçada; VEF1: volume expiratório forçado no primeiro segundo; FEF25-75% =
fluxo expiratório forçado; PFE = pico de fluxo
expiratório; DVO = distúrbio ventilatório obstrutivo; DVR = distúrbio
ventilatório restritivo; Md = mediana; IIQ = intervalo interquartílico
(percentil 75-percentil 25).
Tabela
III
- Caracterização da frequência dos
distúrbios ventilatórios e da forma da caixa torácica dos pacientes com MPS,
Salvador/BA, 2014.

DVO = distúrbio
ventilatório obstrutivo; DVR = distúrbio ventilatório restritivo.
Correlação
entre a função pulmonar (CVF % previsto) com a idade
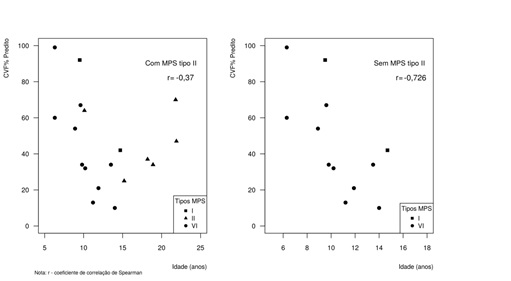
Houve uma correlação
inversa fraca com a idade em relação à CFV (% previsto) para todos os tipos de
MPS (r = -0,37), porém ao serem retirados os pacientes com MPS II esta
correlação negativa aumentou consideravelmente (r = -0,726) (Figura 1).
Figura
1 - Diagrama de dispersão entre a CVF
(%previsto) e a idade (anos) de 18 pacientes com MPS.
Capacidade
funcional
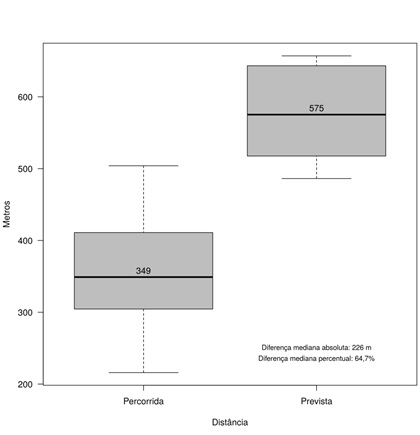
A DTC6M demonstrou um
baixo desempenho mediano e IIQ, 349(106,5)m, com valor mínimo de 216m e máximo
de 504m. Já a distância percorrida prevista apresentou mediana e IIQ de
575,2(125,8)m, sendo a variação percentual mediana entre a distância percorrida
dos pacientes e a distância percorrida prevista de 64,7% (Figura 2).
Questionários
CHAQ e HAQ
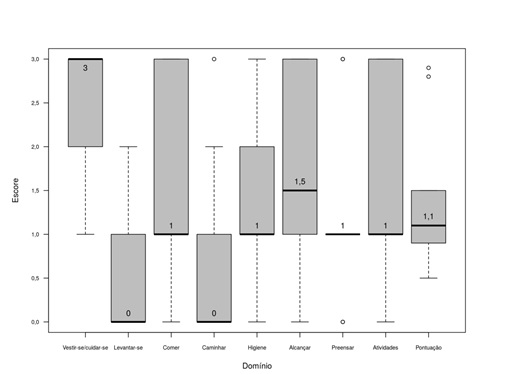
Os nove pacientes aos
quais se aplicou o CHAQ apresentaram um leve comprometimento funcional mediano
e IIQ, 1,1(0,6), na sua pontuação, sendo o domínio mais comprometido, o
vestir-se e cuidar-se, com mediana e IIQ de 3(0,8).
Entretanto, 25% dos pacientes apresentaram escore 3,
nos domínios comer, alcançar e atividades gerais (Figura 3). Os 4 pacientes que responderam ao HAQ também apresentaram leve
comprometimento funcional mediano e IIQ, 0,6(0,1). A pontuação mediana e IIQ
obtida para o domínio vestir-se foi 1(1); 0(0) para o
domínio levantar-se, andar e higiene pessoal; 1(0) para o domínio alcançar e
segurar objetos e 1(1) para atividades gerais.
Figura
2 - Boxplot da distância percorrida e distância
percorrida prevista em metros dos 19 pacientes com MPS.
Figura
3 - Boxplot dos valores dos domínios obtidos
pelo questionário CHAQ de 9 indivíduos com MPS.
Discussão
A maioria dos
pacientes do presente estudo foi do sexo masculino, jovens com baixa estatura e
predomínio para o MPS do tipo VI; a idade de diagnóstico foi tardia. O perfil
ventilatório foi caracterizado pela presença de DVR grave como o mais frequente
e elevada alteração da caixa torácica. A DT6M foi diminuída, e esses valores
foram inferiores ao que seria esperado para os pacientes, de acordo com a distância
prevista, calculada na equação de referência para indivíduos saudáveis. Na
avaliação da capacidade funcional pelos instrumentos CHAQ/HAQ foram encontrados
valores discretamente alterados na pontuação geral, nos quais o domínio do CHAQ
que obteve maior comprometimento foi o vestir-se e cuidar-se.
O predomínio para o
sexo masculino encontrado neste estudo está em conformidade com Lin et al. [22], em que 22/35 pacientes do seu
estudo eram do sexo masculino devido sobretudo ao fato de que 12 pacientes da
amostra eram MPS tipo II, a qual possui padrão de herança ligada ao cromossomo
X [23]. Os indivíduos avaliados foram mais jovens, em concordância com Lin et al. [22] cuja média de idade foi
14,6(5,9) anos, o que pode estar relacionado à baixa expectativa de vida dessa
população [23]. A baixa estatura é uma manifestação frequente e foi encontrada
neste estudo, assim como em estudos publicados, com média e desvio padrão (DP)
de 136,3(14,1) cm no tipo I [24], variação de 103,9-122,8 cm no
tipo II [25], e média de 101,9 cm no tipo V [26], provavelmente devido à
presença de manifestações musculoesqueléticas e redução do crescimento. Houve
preponderância da MPS tipo VI no estudo atual e isso pode se justificar pela
frequência elevada dessa doença na cidade de Monte Santo, interior da Bahia
[27], além de ser um dos tipos mais diagnosticados no Brasil [28].
A idade média do
diagnóstico de MPS I foi tardia, 6,3 anos, na MPS II foi de 7,9 anos e na MPS
VI de 4,3 anos [28] que está em conformidade com os achados medianos deste
estudo, 4,5(3) anos, para todos os tipos de MPS. A idade de aparecimento dos
sintomas pode ser variável, pois, ao nascimento, a maioria das crianças é
normal [23] não apresentando manifestações anatômicas e fisiológicas da doença,
o que pode interferir no diagnóstico precoce, além do pouco conhecimento sobre
essa patologia devido a sua raridade.
Alterações da caixa
torácica dos pacientes encontradas neste estudo são também relatadas na
literatura [23] e a sua presença pode levar a prejuízos da biomecânica pulmonar
e surgimento de doença pulmonar restritiva [29].
O comprometimento da
função pulmonar é uma manifestação presente nesses pacientes [26] e o seu
prejuízo esteve presente em 57% dos pacientes com MPS [22], já no presente estudo,
94,4% dos pacientes apresentaram essas alterações. Resultados do percentual
previsto da CVF abaixo de 80% foram identificados em pacientes com MPS II
[26,31], com média (DP) de 74,2 (25,4)% [22], e grave
redução média, 49,9 (13,9)%, foi identificada na MPS I [24], corroborando o
presente estudo que teve valores medianos ainda mais baixos, 39,5 (30,5)%,
indicando a presença de DVR grave para a maioria dos pacientes investigados,
72,2%, conforme a literatura [1,24,22].
A doença pulmonar
restritiva caracteriza-se por uma respiração rápida e curta, uma baixa reserva
pulmonar pode levar a taquipneia e ao aumento do trabalho respiratório, acúmulo
de secreção e atelectasias, insuficiência respiratória crônica e diminuição na
capacidade de exercícios [29]. Diante disto, medidas terapêuticas que objetivem
otimizar a função respiratória são indicadas, dentre
elas a fisioterapia, que ajuda a reorganizar a mecânica ventilatória, melhorar
a ventilação pulmonar, manter vias aéreas desobstruídas, diminuir o esforço
respiratório, favorecendo a realização de atividades com um menor gasto
energético [31].
O valor médio da VEF1
relacionado com a porcentagem do previsto foi abaixo do normal, 73,9 (28,9)%, e menores valores foram encontrados por Wooten et al. [32], com mediana de 56%, que
está de acordo com os achados deste estudo em que o resultado mediano foi
inferior, 42 (22,5)%. A VEF1, apesar de avaliar basicamente eventos
obstrutivos, pode estar reduzida secundariamente à redução da CVF, na presença
de DVR isolado [9].
Há citação na
literatura da presença da relação VEF1/CVF abaixo de 80% do previsto
nas MPS, indicando a presença de DVO [2,32]. Todavia, valores reduzidos de VEF1/CVF
não foram referidos por outros autores [24,22] assim como nesta casuística, com
mediana de 100%. Porém, três pacientes estudados obtiveram valores abaixo de
80% do previsto, caracterizando a presença de DVO nesses casos. A presença de
eventos obstrutivos pode ser justificada pelas alterações anatômicas, deposição
de GAG na árvore traqueobrônquica e inflamação crônica ou infecções de
repetição [32].
A alteração das vias
aéreas de pequeno calibre identificada pelo percentual previsto do FEF25-75%
esteve reduzida em 91% dos pacientes com MPS [22], corroborando os achados
deste estudo que apresentou valores percentuais abaixo da normalidade para todos
os pacientes. Apenas um paciente foi diagnosticado como DVO leve devido à
presença da redução isolada do FEF25-75% e um paciente apresentou
função pulmonar normal. Resultados normais da função pulmonar também foram
encontrados em 43% dos pacientes com MPS [22].
A função pulmonar
pode estar reduzida com o aumento da idade em indivíduos saudáveis e isso se
torna mais evidente a partir dos 55 anos devido às mudanças nas propriedades
elásticas do pulmão [9]. Todavia, nas MPS, o declínio da função pulmonar foi
relatado em indivíduos jovens [22], bem como reportado no presente estudo,
talvez devido às alterações de caráter crônico e progressivo que acometem esta
doença. A piora da função pulmonar de acordo com o aumento da idade obteve uma
correlação negativa, (r = -0,47), em relação à CVF (% previsto) para todos os
tipos de MPS investigados [22], similar ao encontrado no presente estudo com
correlação inversa fraca, r = -0,37. Porém, ao realizar a análise retirando os
pacientes com MPS II no presente estudo, esta correlação negativa aumentou
consideravelmente (r = 0,726). Talvez pelo fato dos pacientes com MPS tipo II
apresentarem a forma mais atenuada da doença e um menor comprometimento de
caixa torácica.
A
espirometria é
fundamental para avaliação da evolução da
doença pulmonar, porém não há uma
padronização diagnóstica nos indivíduos com
MPS devido às peculiaridades da
doença [24,26], e a sua realização depende da
cooperação e compreensão do
indivíduo e de um bom vedamento labial, o que é
difícil para os pacientes com
MPS devido às alterações nas arcadas
dentárias, macroglossia e deficiência
cognitiva [25].
Além do exame
espirométrico, alguns instrumentos funcionais têm sido aplicados como forma de
avaliar a progressão e a gravidade da doença. O TC6M vem sendo utilizado na
prática clínica do fisioterapeuta, em pacientes com MPS para avaliação do
estado funcional, acompanhamento e avaliação da resposta ao tratamento [23] e
em crianças com doenças crônicas [24], visto que ele avalia a resposta ao
exercício dos principais sistemas envolvidos na atividade, o cardiopulmonar e
musculoesquelético, sendo esta resposta um bom indicador das mudanças da
condição funcional de indivíduos [7].
É descrito na
literatura valores reduzidos na DTC6M de indivíduos com MPS [25,30]. Na MPS VI,
caminharam 268,8 m no TC6M [33]; na MPS II foi identificado DTC6M entre 300-500
m [30] e na MPS I, 25% dos pacientes foram incapazes de caminhar 320 m,
caracterizando uma redução da resistência ao exercício [34], concordando com os
achados medianos do presente estudo, 349 m. As descrições na população saudável
demonstram valores da DTC6M acima de 550 m em diferentes faixas etárias
[15,16].
Segundo as equações
de referência utilizadas, a mediana e IIQ da DTC6M prevista foi de 577,7
(128,5) m, com diferença percentual mediana de 64,7%, em relação ao valor
percorrido de fato de 349 (106,5) m, mostrando que indivíduos com MPS
caminharam menos do que o esperado. Não há dados na literatura da utilização de
equações de referência para população saudável em indivíduos com MPS, para
comparação com o estudo atual, sendo necessária cautela na interpretação desses
resultados.
A avaliação funcional
através do CHAQ em indivíduos com MPS II demonstrou prejuízo leve da capacidade
funcional, com escores mais deficientes para os domínios higiene, alcançar e
vestir-se e como pontuação geral no CHAQ/HAQ apresentou valor entre 1 e 2 [35], coincidindo com os resultados do presente
estudo. Apesar da pontuação final do CHAQ ter sido levemente alterada,
observa-se para os domínios comer, alcançar e atividades gerais que 25% dos
pacientes do presente estudo apresentaram estas funções comprometidas com
escore de 3. O domínio que apresentou maior
deficiência mediana, 3 (0,8), nesse estudo, foi o
vestir-se e o cuidar-se. A presença de limitações articulares nos membros
superiores pode ser uma justificativa para esses achados [35].
O domínio caminhar
não apresentou prejuízo no HAQ/CHAQ, mas, ao se avaliar a tolerância ao esforço
pelo TC6M, este se mostrou comprometido, demonstrando uma discordância entre a
percepção e o resultado objetivo do teste. A dificuldade na marcha pode
acontecer e a necessidade da utilização de dispositivo auxiliar da marcha foi
encontrada com uma frequência de 30% em adultos e 25% em crianças [36].
Conclusão
A avaliação minuciosa
nesses pacientes é necessária, tanto do ponto vista respiratório quanto motor,
a fim de estabelecer um diagnóstico funcional e instituir programas
terapêuticos de acordo com a necessidade individual, enfatizando a importância
da atuação do fisioterapeuta que tem como finalidade promover a otimização da função pulmonar, manter e preservar a
independência e a funcionalidade.
Referências
- Muhlebach MS, Wooten W, Muenzer J. Respiratory manifestations in mucopolysaccharidoses. Paediatr Respir Rev 2011;12(2):133-8.
- Yeung AH, Cowan MJ, Horn B, Rosbe KW. Airway management in children with mucopolysaccharidoses.
Arch
Otolaryngol Head Neck Surg 2009;135(1):73-9.
- Guarany NR. Avaliação
do efeito da terapia de reposição enzimática na capacidade funcional de
pacientes com mucopolissacaridose [dissertação]. Porto Alegre: Universidade
Federal do Rio Grande do Sul; 2011. 120p.
- Simmons MA, Bruce IA, Penney S, Wraith E, Rothera
MP. Otorhinolaryngological manifestations of the mucopolysaccharidoses.
Int J Pediatr Otorhinolaryngol 2005;69(5):589-95.
- Dinwiddie R. The lung in multi-system disease. Paediatr Respir Rev 2000;1(1):58-63.
- Muenzer J, Wraith JE, Clarke
LA. Mucopolysaccharidosis I: Management and Treatment
Guidelines. Pediatrics
2009;123(1):19-29.Morales-Blanhir JE, Vidal P, Damián
C, Romero R, Jesús M de, Castro G, et al. Six-minute walk test: a valuable tool for assessing pulmonary
impairment. J Bras Pneumol 2011;37(1):110-7.
- McDonald A, Steiner R, Kuehl K, Turbeville S.
Clinical utility of endurance measures for evaluation of treatment in patients
with mucopolysaccharidosis VI (Maroteaux-Lamy
syndrome). J
Pediatr Rehabil Med 2010;3(2):119-27.
- Anon. I consenso
brasileiro sobre espirometria. J Pneumol 1996;22(3):105-64.
- Sociedade Brasileira
de Pneumologia e Tisiologia. Jornal Brasileiro de Pneumologia 2002. 260 p.
- Standardization of Spirometry, 1994 Update. American Thoracic Society. Am J Respir Crit Care Med 1995;152(3):1107-36.
- Knudson RJ, Lebowitz MD, Holberg
CJ, Burrows B. Changes in the normal maximal expiratory flow-volume curve with
growth and aging. Am Rev Respir Dis
1983;127(6):725-34.
- Rodrigues JC,
Cardieri JMA, Bussamra MHCF, Nakaie CMA, Almeida MB, Silva Filho LVF, et al. Provas de função pulmonar em crianças e adolescentes.
J Pneumol 2002; 28(3):207-21.
- ATS Committee on Proficiency Standards for Clinical Pulmonary Function
Laboratories. ATS statement: guidelines for
the six-minute walk test. Am J Respir Crit Care Med 2002;166(1):111-7.
- Priesnitz CV, Rodrigues GH, Stumpf CS, Viapiana G, Cabral CP,
Stein RT, et al. Reference values for the 6-min walk test in healthy children
aged 6-12 years. Pediatr
Pulmonol 2009;44(12):1174-9.
- Iwama AM, Andrade GN,
Shima P, Tanni SE, Godoy I, Dourado VZ. The six-minute walk test and body weight-walk distance product in
healthy Brazilian subjects. Braz J Med Biol Res 2009;42(11):1080-5.
- Harmatz P, Mengel KE, Giugliani R, Valayannopoulos V, Lin S-P, Parini
R, et al. The Morquio A Clinical Assessment Program:
baseline results illustrating progressive, multisystemic
clinical impairments in Morquio A subjects. Mol Genet Metab 2013;109(1):54-61.
- Bruce B, Fries JF. The Stanford Health Assessment Questionnaire: a
review of its history, issues, progress, and documentation. J Rheumatol 2003;30(1):167-78.
- Singh G, Athreya BH, Fries JF, Goldsmith DP. Measurement of health status in children with juvenile rheumatoid
arthritis. Arthritis Rheum 1994;37(12):1761-9.
- Vacha-Haase T. Statistical
significance should not be considered one of life’s guarantees: effect sizes
are needed. Educ Psychol Meas 2001;61(2):219-24.
- Development Core Team. {R: A
language and environment for statistical computing}. Vienna: R Foundation for
Statistical Computing; 2009. 409 p.
- Lin S-P, Shih S-C, Chuang C-K, Lee K-S, Chen M-R, Niu
D-M, et al. Characterization of pulmonary function impairments in patients with
mucopolysaccharidoses--changes with age and
treatment. Pediatr Pulmonol
2014;49(3):277-84.
- Wraith JE, Scarpa M, Beck M, Bodamer OA, De Meirleir L, Guffon N et al. Mucopolysaccharidosis
type II (Hunter syndrome): a clinical review and recommendations for treatment
in the era of enzyme replacement therapy. Eur J Pediatr 2008;167(3):267-77.
- Clarke LA, Wraith JE, Beck M, Kolodny EH, Pastores GM, Muenzer J et al.
Long-term efficacy and safety of laronidase in the
treatment of mucopolysaccharidosis I. Pediatrics
2009;123(1):229-40.
- Glamuzina E, Fettes E,
Bainbridge K, Crook V, Finnegan N, Abulhoul L et al.
Treatment of mucopolysaccharidosis type II (Hunter
syndrome) with idursulfase: the relevance of clinical
trial end points. J Inherit Metab Dis 2011;34(3):749-54.
- Harmatz P, Yu Z-F, Giugliani R, Schwartz IVD, Guffon
N, Teles EL et al. Enzyme replacement therapy for mucopolysaccharidosis VI: evaluation of long-term pulmonary
function in patients treated with recombinant human N-acetylgalactosamine
4-sulfatase. J
Inherit Metab Dis 2010;33(1):51-60.
- Costa-Motta FM,
Acosta AX, Abé-Sandes K, Bender F, Schwartz IVD, Giugliani R, et al. Genetic studies in a
cluster of mucopolysaccharidosis type VI patients in
Northeast Brazil. Mol
Genet Metab 2011;104(4):603-7.
- Vieira T, Schwartz I,
Muñoz V, Pinto L, Steiner C, Ribeiro M et al. Mucopolysaccharidoses in Brazil: what happens from birth to biochemical diagnosis? Am J Med
Genet A 2008;146A(13):1741-7.
- Mogayzel PJ, Marcus CL.
Skeletal dysplasias and their effect on the
respiratory system. Paediatr Respir
Rev 2001;2(4):365-71.
- Muenzer J, Wraith JE, Beck
M, Giugliani R, Harmatz P, Eng CM et al. A phase II/III clinical
study of enzyme replacement therapy with idursulfase
in mucopolysaccharidosis II (Hunter syndrome).
Genet Med Off J Am Coll Med Genet 2006;8(8):465-73.
- Lima MP. Curso
Básico Reequilíbrio Tóracoabdominal [Internet]. Florianópolis; 2013. [citado
2014 Dez 12]. Disponível em: URL: www.rtaonline.com.br
- Wooten WI, Muenzer J, Vaughn BV, Muhlebach MS. Relationship of sleep to pulmonary function
in mucopolysaccharidosis II. J Pediatr 2013;162(6):1210-5.
- Harmatz P, Ketteridge
D, Giugliani R, Guffon N, Teles EL, Miranda MCS, et
al. Direct comparison of measures of endurance, mobility,
and joint function during enzyme-replacement therapy of mucopolysaccharidosis
VI (Maroteaux-Lamy syndrome): results after 48 weeks
in a phase 2 open-label clinical study of recombinant human N-acetylgalactosamine 4-sulfatase. Pediatrics 2005;115(6):e681-9.
- Wraith JE, Clarke LA, Beck M, Kolodny EH, Pastores GM, Muenzer J et al.
Enzyme replacement therapy for mucopolysaccharidosis
I: a randomized, double-blinded, placebo-controlled, multinational study of
recombinant human alpha-L-iduronidase (laronidase). J Pediatr 2004;144(5):581-8.
- Raluy-Callado M, Chen W-H, Whiteman DA, Fang J, Wiklund I. The impact of Hunter syndrome (mucopolysaccharidosis
type II) on health-related quality of life. Orphanet J Rare Dis 2013;8(1):101.
- Hendriksz CJ, Lavery C, Coker M, Ucar SK, Jain
M, Bell L et al. Burden of disease in patients with Morquio
A syndrome: results from an international patient-reported outcomes survey. Orphanet J Rare Dis 2014;9:32.