REVISÃO
Reabilitação
pulmonar em indivíduos com fibrose pulmonar idiopática: qual a evidência?
Pulmonary rehabilitation in individuals with idiopathic pulmonary
fibrosis: what is the evidence?
Pablo Costa Cortêz,
Ft.*, Roberta Lins Gonçalves, Ft.D.Sc.**, Ayrles Silva
Gonçalves Barbosa Mendonça, Ft., M.Sc.***, Rosiney de Souza Pantoja****, Elisa
Brosina de Leon, Ft., D.Sc.*****, Fernanda Figueirôa Sanchez, Ft., D.Sc.*****
*Mestrando
em Ciências da Saúde na Universidade Federal do Amazonas/UFAM – UFAM, **Docente
da FEFF/UFAM, Coordenadora da Residência em área profissional da saúde:
Fisioterapia em Terapia Intensiva Neonatal. Coordenadora Científica da Regional
do AM da Assobrafir, Docente da Pós-graduação em Ciências da Saúde/UFAM,
***Professora da UFAM, ****Fisioterapeuta graduado na FEFF/UFAM, *****Docente
da FEFF/UFAM
Recebido 25 de
novembre de 2015; aceito 15 de fevereiro de 2017
Endereço
para correspondência:
Prof. Dra. Roberta Lins Gonçalves, E-mail: betalinsfisio@yahoo.com.br, Pablo
Costa Cortêz: p.c_c@outlook.com; Ayrles Silva Gonçalves Barbosa Mendonça:
ayrles@yahoo.com.br; Rosiney Pantoja: neypantoja1@hotmail.com; Elisa
Brosina de Leon: elisadleon@yahoo.com.br; Fernanda Figueirôa Sanchez: fersanchez1@hotmail.com
Resumo
Introdução: A fibrose pulmonar
idiopática (FPI) é uma pneumonia intersticial idiopática crônica, progressiva,
sem cura, com morte entre 3 meses a 4 anos após o
diagnóstico. A qualidade de vida (QV) dos indivíduos com FPI é baixa, com
muitos sintomas respiratórios. Têm-se demonstrado que a melhora da QV e dos
sintomas pode ocorrer com a reabilitação pulmonar (RP). Contudo, existem poucos
estudos nacionais sobre o assunto sendo esta conduta pouca realizada no Brasil.
Objetivos: Investigar evidências
científicas sobre a RP em indivíduos com FPI. Métodos: Revisão sistemática de estudos secundários: diretrizes,
guidelines e revisões sistemáticas, em inglês e português, publicados entre
2000 e 2016 nas bases de dados: BVS, Cochrane Library, PEDro,
PubMed, Scielo Org. Os descritores e seus correlatos foram identificados no Medical Subject Headings e nos
Descritores em Ciências da Saúde. A questão PICO foi: P: indivíduo com FPI, I:
reabilitação pulmonar, O: tempo livre de piora, dispneia, distância percorrida
no teste de caminhada de 6 minutos, saturação periférica de oxigênio (SpO2), QV, capacidade vital forçada (CVF) e sobrevida. A
qualidade metodológica foi avaliada através do Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) e do Revised Assessment of Multiple Systematic Reviews
(R-AMSTAR). O grau de recomendação e a sugestão da prática foram baseados no United States Preventive Services Task Force
(USPSTF). Resultados: Seis
artigos foram incluídos com boa qualidade metodológica. A RP foi recomendada
para a maioria dos indivíduos com FPI – grau de recomendação B. Conclusão: A RP foi capaz de melhorar
positivamente a maioria dos desfechos analisados, devendo ser incluída no rol
de condutas terapêuticas para indivíduos com FPI que desejarem realiza-la.
Palavras-chave: reabilitação,
fibrose pulmonar idiopática, exercícios respiratórios, terapia por exercício.
Abstract
Introduction: Idiopathic pulmonary fibrosis (IPF) is a chronic, progressive and
idiopathic interstitial pneumonia, uncured, with fatal issue in 3 months to 4
years after diagnosis. Quality of life (QOL) of patients with IPF is weak, with
many respiratory symptoms. Improving QOL and symptoms can occur with pulmonary
rehabilitation (PR). However, there are few national studies on the subject and
this rehabilitation has little place in Brazil. Objectives: To investigate scientific evidence available on the RP
in patients with IPF. Methods:
Systematic review of secondary studies: policies, guidelines and systematic
reviews in English and Portuguese, published between 2000 and 2016 in the data
bases: BVS, Cochrane Library, PEDro, PubMed, Scielo Org. Descriptors and their specific correlates were
identified in the Medical Subject Headings (MESH) and the Descriptors in Health
Sciences (DECS). The question PICO was: P: individual with IPF, I: pulmonary
rehabilitation, O: outcome: worsening of free time, dyspnea, distance
walked in 6-minute walk test, oxygen saturation (SpO2), QOL, forced vital
capacity (FVC) and survival. Methodological quality was assessed using the
Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) and
the Revised Assessment of Multiple Systematic Reviews (R-AMSTAR). The degree of
recommendation and practical suggestions were based on the United States Preventive
Services Task Force (USPSTF). Results:
Six articles were included with good methodological quality. The RP is
recommended for most individuals with IPF - degree of recommendation B. Conclusion: The RP was able to
positively improve most of the outcomes and should be included in the list of
therapeutic approaches for individuals with IPF who want to achieve it.
Key-words:
rehabilitation, idiopathic pulmonary fibrosis, breathing exercises, exercise
therapy.
Introdução
A fibrose pulmonar
idiopática (FPI) é a mais comum das doenças pulmonares intersticiais (DPI) e a
que carrega pior prognóstico [1-3]. Acomete o parênquima pulmonar de forma
progressiva, caracterizando-se por infiltração celular inflamatória crônica e
variáveis níveis de fibrose intersticial, com características clínicas,
radiológicas e fisiopatológicas particulares [2,4-6].
A sobrevida média de
indivíduos com FPI é de aproximadamente 3 anos a
partir do diagnóstico [2,4-8]. A prevalência é estimada em ± 30casos/100.000
indivíduos, aumentando com a idade: mais de 100 indivíduos/100.000 em idade ≥
75 anos [5]. Acomete mais homens, 20 casos/100.000, do que mulheres, 13
casos/100.000 [5,9]. Os dados epidemiológicos relativos à FPI são raros na
literatura nacional [4,10].
Os sinais e sintomas
incluem dispneia, alterações funcionais ventilatórias compatíveis com quadro
restritivo, infiltrados pulmonares difusos ao RX de tórax e ausculta pulmonar
com crepitações difusas, acompanhadas de redução da capacidade de difusão
pulmonar de monóxido de carbono (DLCO) e hipoxemia em repouso e/ou durante o
exercício, com aspecto histopatológico compatível com ausência de infecção,
granuloma ou processo neoplásico que possa indicar outra entidade ou fator
desencadeante para a fibrose pulmonar [4,10].
A maioria das
evidências disponíveis não relatam benefícios suficientes que apoiem qualquer
terapia medicamentosa específica capaz de mudar a história natural da doença
[9,11]. Contudo, atualmente, existe forte evidência (revisão sistemática com metanálise)
que a Pirfenidona, fármaco antifibrótico, seja a melhor opção, uma vez que
aumenta o tempo livre de piora dos sintomas, a distância percorrida no teste de
caminhada de seis minutos (TC6m), a saturação de pulso
de oxigênio (SpO2) no TC6m e em repouso, a DLCO, reduzindo o % de
piora da capacidade vital forçada (CVF) e a dispneia, devendo ser considerada
como um fármaco de primeira linha para o tratamento da FPI [12].
A Reabilitação
Pulmonar (RP) é uma intervenção que tem sido associada à melhora da qualidade
de vida (QV) e das variáveis cardiopulmonares em doentes pulmonares crônicos
[3,13]. Programas de RP para estes indivíduos resultam em melhora na habilidade
de realização das atividades de vida diária (AVD), na capacidade de realizar
exercícios, na redução dos sintomas respiratórios, na ansiedade e na depressão
[3,13]. Contudo, pouco ainda se sabe sobre a RP em indivíduos com FPI, sendo
que no Brasil, a maioria destes indivíduos não é encaminhada para esta
terapêutica.
Em virtude disso, o
objetivo deste estudo foi investigar evidências científicas sobre a RP em
indivíduos com FPI e responder se esta terapêutica deve ou não ser recomendada à indivíduos com FPI.
Métodologia
Revisão sistemática
de estudos secundários: diretrizes, guidelines e revisões sistemáticas
publicados entre os anos de 2000-2016, em inglês e português. A questão
PICO foi P - paciente: indivíduo com FPI, I - intervenção: reabilitação pulmonar, C – controle: só foram
incluídos estudos secundários que analisaram ensaios clínicos randomizados e
controlados, O - desfecho: dispneia,
exacerbação aguda, distância percorrida no TC6m, SpO2,
QV, CVF, DLCO, tempo livre de piora e sobrevida. Foram pesquisadas as bases de
dados BVS, Cochrane Library, PEDro, PubMed e Scielo Org,
no período de 1 de junho a 1 de setembro de 2016, utilizando os descritores: Rehabilitation, Idiopathic Pulmonary
Fibrosis, Breathing Exercises e Exercise Therapy e seus correlatos
específicos identificados no Medical
Subject Headings (MESH): Habilitation,
Idiopathic Pulmonary Fibroses, Usual Interstitial Pneumonitis, Cryptogenic
Fibrosing Alveolitis, Exercise Breathing, Respiratory Muscle Training, Muscle
Respiratory Training, Training Respiratory Muscle, Exercise Therapies, Therapy
Exercise e nos Descritores em Ciências da Saúde (DECS): Reabilitação,
Fibrose Pulmonar Idiopática, Exercícios Respiratórios e Terapia por Exercício
em português e inglês. A busca dos artigos em inglês e português foi realizada
separadamente.
Para a pesquisa nas bases
de dados BVS, Cochrane Library, PubMed e Scielo Org os
termos foram combinados entre si através do operador booleano “OR”. A base de
dados PEDro não admitiu o uso dos dois operadores booleanos ao mesmo tempo.
Assim, as pesquisas nesta base foram feitas pela combinação individual dos
termos e seus correlatos através do operador booleano AND. Quando possível
foram utilizados os filtros: ano (2000-2016), pesquisa em seres humanos na área
temática da saúde, com os desenhos metodológicos: diretrizes, guidelines e revisões sistemáticas com
ou sem metanálise. Quando não foi possível utilizar a opção de filtro, a
seleção foi realizada pela leitura dos títulos dos artigos.
A busca dos artigos
em inglês resultou em: BVS (1.062.080 artigos), Cochrane Library (34.764
artigos), PEDro (8 artigos), PubMed (476.797 artigos)
e Scielo Org (730 artigos). Destes, foram descartados os que não contemplavam
os desenhos metodológicos propostos e publicados antes do ano 2000, restando 23
artigos que foram selecionados e lidos na íntegra. Desses, 17 foram descartados
por não abordarem as questões clínicas de interesse. Para esta revisão foram
incluídos seis artigos em inglês (5 Guidelines e 1 revisão sistemática),
conforme descrito no Quadro 1.
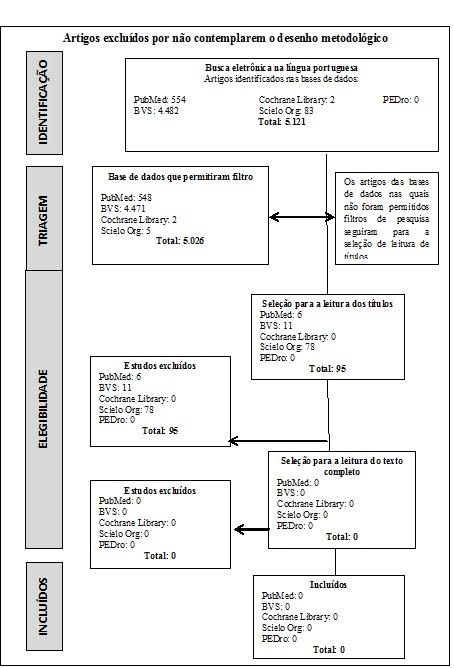
A busca dos artigos
em português resultou em: BVS (4.482 artigos), Cochrane Library (2 artigos), PEDro (0 artigos), PubMed (554 artigos) e Scielo
Org (83 artigos). Foram descartados os artigos que não contemplavam os desenhos
metodológicos propostos e aqueles publicados antes do ano 2000, não restando
artigos em português para serem incluídos nesta revisão, conforme descrito no
Quadro 2.
Um revisor extraiu os
artigos selecionados para a inclusão e o segundo revisor repetiu a busca para
melhorar a acurácia. As análises foram realizadas por três revisores de maneira
independente. Os revisores discutiram o nível de evidência e a avaliação das
recomendações. Discordâncias foram resolvidas através de discussão até o
consenso. Quando necessário, os autores dos estudos foram contatados
informações. Outros estudos além dos seis incluídos para a revisão sistemática
foram utilizados para a discussão, não servindo como base para a recomendação
baseada na evidência.
Avaliação
da qualidade metodológica e análise da evidência
A avaliação da
qualidade metodológica dos artigos incluídos foi baseada no Preferred Reporting Items for Systematic
reviews and Meta-Analyses (PRISMA) [14] e no Revised Assessment of Multiple Systematic Reviews (R-AMSTAR) [15].
O grau de recomendação e a sugestão da prática foi baseada
no United States Preventive Services Task
Force (USPSTF) [16].
O PRISMA Checklist 2009 é uma evolução do QUOROM guidelines utilizado para avaliar
revisões sistemáticas e metanálises com intervenções em saúde [14]. Consiste de
27 itens em checklist num diagrama de
quatro fases, cujo objetivo é avaliar se os estudos selecionados incluem itens
essenciais para a transparência necessária a uma boa revisão sistemática [14].
O R-AMSTAR é um instrumento validado para avaliar a força da evidencia
científica de revisões sistemáticas através da análise metodológica [15].
Possui onze domínios, com pontuação máxima de 44 pontos [15]. É classificado da
seguinte maneira: Qualidade A –
melhor evidencia possível – 100-90% - nota: 44-40 pontos; Qualidade B – de 89-80% - nota: 39-36 pontos; Qualidade C – de 79-70% - nota: 35-31 pontos; Qualidade D – menor que 69% - nota menor que 31 pontos [15].
O USPSTF é uma escala
de recomendações baseada em critérios explícitos avaliados ponto a ponto, facilitando
a tomada de decisão baseada na melhor evidência disponível [16]. Este
instrumento permite a revisão das evidências, estimando a magnitude dos
benefícios e malefícios [16]. O USPSTF avalia o grau de força da evidência
como: "A" (fortemente recomendado) oferecer/providenciar este
procedimento, "B" (recomendado) oferecer/providenciar este
procedimento, "C" (recomendação depende de cada paciente)
oferecer/providenciar apenas se outras considerações indicarem este
procedimento a um paciente individualmente, "D" (não recomendado)
desencorajar o uso deste procedimento, ou "I" (evidências
insuficientes para recomendar a favor ou contra) acompanhar novas considerações
clínicas sobre esta recomendação. Se este procedimento é oferecido, o paciente
deve compreender a incerteza do risco/benefício e do prejuízo atribuído a esta
conduta [16]. Para cada questão clínica os resultados foram analisados e
discutidos ponto a ponto, sendo a recomendação baseada na evidência conforme o
USPSTF.
Extração
dos dados e análise dos dados
Os dados foram
extraídos por desfechos e separados por estudo. As características relevantes
de cada artigo foram apresentadas de maneira descritiva no Quadro III.
Quadro
1 - Fluxograma de busca em língua inglesa.
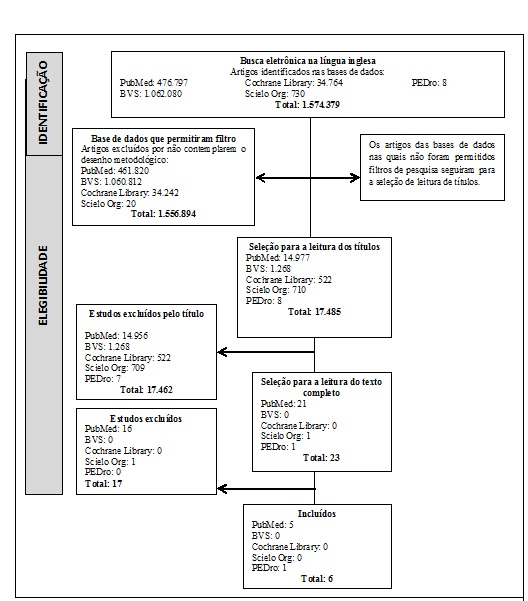
Quadro
2 - Fluxograma de busca em língua portuguesa.
Resultados
Quadro
3 - Aspectos relevantes dos seis artigos
incluídos. (ver PDF em anexo)
Foram analisados seis
artigos com boa qualidade metodológica, sendo cinco guidelines e uma revisão
sistemática com meta-análise, cujos aspectos mais relevantes foram descritos no
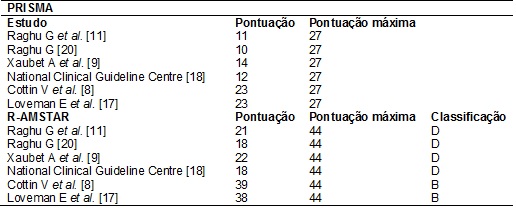
quadro 3. As avaliações metodológicas dos estudos
incluídos segundo o PRISMA e R – AMSTAR estão descritas na Tabela I.
Tabela
I - Resultado da avaliação da qualidade
metodológica dos estudos incluídos segundo PRISMA e R-AMSTAR.
Discussão
A FPI é uma doença
devastadora, progressiva, rápida e fatal. Não existem fármacos que possam mudar
a história natural da doença. Contudo, melhorar a QV e reduzir os sintomas são desfechos relevantes na vida destes indivíduos.
Atualmente, existe apenas um fármaco com esta capacidade. Por isso, a
possibilidade de mais estratégias terapêuticas torna-se relevante. Como a RP
tem demonstrado bons resultados em indivíduos com doenças crônicas, a questão
clínica que norteou este estudo foi avaliar se existem evidências da RP em
indivíduos com FPI [17].
O National Clinical Guideline Centre
investigou revisões sistemáticas, ensaios clínicos randomizados e estudos de
coorte comparando a RP versus nenhum tratamento ou o tratamento convencional em
indivíduos com DPI e encontrou treze estudos que demonstraram benefícios [18].
Contudo, os desfechos clínicos para documentar a resposta terapêutica foram
controversos [9,11]. Sistemas mistos de classificação que combinam sintomas e
achados clínicos como, RX de tórax, tomografia computadorizada de alta
resolução, avaliação da CVF e % de redução da CVF e TC6m
têm sido utilizados [9,11].
Reabilitação
pulmonar
Segundo a American Thoracic Society e a European Respiratory Society a RP é um
conjunto de procedimentos realizados por uma equipe multidisciplinar. Ela
inclui educação em saúde, suporte psicossocial, nutricional e reabilitação
física, sendo esta última a parte mais importante [3,13,19].
Evidências têm demonstrado, contudo, que mesmo em programas de RP com menos
profissionais da saúde, como acontece na maioria dos programas brasileiros, os
resultados podem ser satisfatórios, desde que sejam
capazes identificar e suprir as necessidades individuais dos pacientes
[3,13,19].
De acordo com Loveman
et al. [17], a RP é uma intervenção bem
estabelecida para indivíduos com doença pulmonar obstrutiva crônica (DPOC) com
objetivos de redução do impacto físico e emocional da doença no indivíduo. Para
estes indivíduos a prioridade deve ser o condicionamento aeróbio, mas deve-se
incluir o fortalecimento da musculatura de membros superiores e inferiores e
exercícios de flexibilidade e respiratórios. Com isso espera-se melhora da
capacidade funcional com maior tolerância ao esforço, redução da dispneia e
melhores condições para que o indivíduo realize suas AVDs, melhorando assim a
QV [3,8,9,11,13,17,19].
Apesar de existirem
poucos estudos que abordaram a RP na FPI, as evidências
existentes são suficientes para que esta terapêutica
seja incluída para os indivíduos que desejem realiza-la. No caso da RP em
indivíduos com FPI, segundo a American
Thoracic Society e a European Respiratory Society ela pode ser realizada em
qualquer nível de atenção com benefícios consistentemente obtidos nos três
níveis [3,19]. A maioria dos estudos analisados realizou RP ambulatorial,
ressaltando que a RP domiciliar vem adquirindo grande importância para se
conseguir uma maior abrangência de tratamento aos doentes [19]. Uma revisão em
colaboração com a Cochrane demonstrou que a RP é segura em indivíduos com DPI,
incluindo indivíduos com FPI, melhorando a distância percorrida no TC6m, a dispneia e a QV [9].
A maioria dos estudos
afirma que como não existe ainda um programa de RP específico para os
indivíduos com FPI, a RP realizada foi bem semelhante àquela realizada em
indivíduos com DPOC, incluindo um pacote de exercícios supervisionados por
fisioterapeutas, exercícios respiratórios, técnicas de conservação de energia e
suporte educacional por um período de 6 a 8 semanas. Eles discutem que é
importante incluir uma avaliação da saúde relacionada principalmente a
dispneia, QV, SpO2 em repouso e durante o TC6min,
inclusive para se avaliar a necessidade de suplementação de O2 durante o
exercício e para a realização das AVDs [9,11,17].
Dispneia
e qualidade de vida
De acordo com Loveman
et al. [17], a dispneia progressiva é
considerada uma importante variável subjetiva, sendo sua avaliação encorajada
por ferramentas validadas. Dispneia, fadiga e redução da tolerância ao
exercício são sintomas frequentes em indivíduos com FPI e todos prejudicam
fortemente a QV [8]. Sendo assim, a avaliação destas variáveis é essencial para
quantificar o impacto da FPI na vida do indivíduo, além de ser um importante
parâmetro de avaliação da terapêutica e do prognóstico [9,11,17,20].
A dispneia e a QV estão correlacionadas e podem ser um marcador de sobrevida
nestes indivíduos [9,11,17,20].
De acordo com Xaubet et al. [9], em dois estudos com evidências
de baixa qualidade metodológica demonstrou-se que a RP pode ser clinicamente
eficaz na redução da dispneia imediatamente após a sessão, em comparação com
aqueles que não realizaram a reabilitação. Raghu [11] analisou dois ensaios
clínicos randomizados que demonstraram que a RP causou melhora à curto prazo da dispneia e da QV de indivíduos com FPI,
especialmente naqueles com pior estado funcional inicial. Segundo Nascimento et al. [19] após um programa de RP os
indivíduos com FPI melhoram a QV, aumentam o tempo gasto com as AVDs, diminuem
a dispneia e aumentam a tolerância ao exercício.
Capacidade
vital forçada e difusão pulmonar de monóxido de carbono
Segundo Raghu et al. [11], Xaubet et al. [9], Loveman et al.
[17] e Selman et al. [22], é
recomendado que avaliação da CVF e da DLCO sejam realizadas durante a
monitorização de rotina de indivíduos com FPI. Para eles a diminuição da CVF é
a medida da função pulmonar que melhor prediz a mortalidade nesses indivíduos.
Evidências confirmam
que redução de 10% na CVF (com ou sem concomitante mudança da DLCO) ou redução
de 15% na DLCO (com ou sem alteração concomitante da CVF) são marcadores de
mortalidade considerados como piora ou progressão da FPI [9,11,17,22].
Contudo, o intervalo de tempo ideal para esta monitorização não tem sido
formalmente investigado [1]. Sugere-se que intervalos de 3 a 6 meses sejam
adequados. Mas existe um subconjunto de indivíduos com rápida progressão ou
agravamento agudo que pode não demonstrar progressão durante este intervalo e
ainda assim piorar rapidamente [11]. Desta maneira, uma abordagem flexível para
o monitoramento da progressão da doença é necessária, com maior frequencia de
avaliação em indivíduos com piora da dispneia [11].
De acordo com Xaubet et al. [9], Raghu et al. [11], e Loveman et al. [17], a progressão da
doença correlacionada com os níveis da CVF e da DLCO indicam um pior prognóstico
e um declínio agudo do quadro respiratório quando a DLCO apresenta valores <
40% do valor previsto no momento do diagnóstico e diminuição ≥ 10% da CVF
e ≥ 15% da DLCO em 6-12 meses. Recentemente, Bois et al. [21], demonstraram que pacientes com uma diminuição ≥
10% na CVF em 24 semanas têm quase 5 vezes mais risco de morrer no ano
seguinte, e aqueles com 5-10% de diminuição da CVF tem mais do dobro do risco
de morte no ano seguinte.
Os estudos incluídos
para essa revisão não analisaram os impactos da RP na CVF e na DLCO. O National Clinical Guideline Centre
também relata que estes desfechos não foram investigados na RP de indivíduos
com FPI [17]. Contudo, este guideline sugere uma moderada melhora na redução %
dos níveis de CVF e da DLCO por meio de um pacote supervisionado de RP
incluindo, exercícios aeróbicos e de flexibilidade por um período de 6 à 8 semanas [17]. De acordo com Raghu [11] e Selman et al. [22], as evidências relativas a
alteração da CVF e da DLCO com a RP em indivíduos com FPI foram insuficientes
para a determinação da progressão da doença. Contudo, mudanças menores que 5%
da CVF e menores que 10% da DLCO devem ser interpretadas com cautela [11,22].
Desta maneira, mais estudos são necesários para analisar o impacto da RP na CVF
e na DLCO de indivíduos com FPI.
Teste
de caminhada de 6 minutos e dessaturação de oxigênio
O TC6m
é amplamente utilizado na prática clínica. Contudo, vários autores discutem que
seu valor prognóstico é limitado em indivíduos com FPI devido à falta de
valores de referência [9,11,17,20]. De acordo com
National Clinical Guideline Centre, o TC6m deve ser
utilizado para avaliação e análise de indivíduos com FPI, especialmente para
avaliar a necessidade de suplementação de oxigênio (O2) e a resposta
terapêutica, não devendo ser utilizado para prognóstico [18].
Segundo Xaubet et al. [9], Raghu et al.
[11] e Loveman et
al. [17],
a maioria dos estudos sugere que a dessaturação (diminuição da SpO2 para menos
de 88%) durante o TC6m é um marcador de risco aumentado de mortalidade.
Estima-se que uma redução > 50 m na distância percorrida no TC6m em 24 semanas está associada a um aumento quatro vezes
maior do risco de morte em um ano [9,11,17,20]. Sendo assim, discute-se que a
dessaturação discrimina o parâmetro funcional mais adequado para o
acompanhamento do TC6m nestes indivíduos [17,20].
Em individuos com SpO2 ≤ 88%, uma
redução de > 15 % na DLCO em 6 meses é o melhor preditor de mortalidade,
enquanto naqueles com SpO2 > 88%, o parâmetro mais importante é a
diminuição > 10% na CVF [9,11,17,20]. Segundo Raghu et al. [11], o monitoramento da dessaturação durante o TC6m é útil, e
em indivíduos com intolerância significativa ao exercício é necessário avaliar
a necessidade de O2 suplementar.
A importância da
recuperação da frequência cardíaca após o TC6m também
foi observada [9,17,20]. Uma diminuição menor que 14 batimentos após o primeiro
minuto é um fator independente de mau prognóstico [9]. O TC6m
apresentou uma boa correlação com o volume máximo de oxigênio (VO2max)
medido no teste de esforço cardiopulmonar nestes indivíduos. Um VO2max abaixo de 8,3 ml.kg-1.min-1 está associado
com um maior risco de mortalidade [9,17,20].
Conclusão
A RP foi recomendada
para a maioria dos indivíduos com FPI: Grau de recomendação B, ou seja, existe
certeza que o benefício é moderado ou há moderada certeza de que o conjunto de
benefícios é de moderado a substancial.
A quantidade de
estudos que abordam o tema FPI é escassa e a qualidade metodológica varia.
Alguns pontos específicos da RP em indivíduos com FPI ainda permanecem sem
respostas, como tempo, frequência e a melhor conduta. Sendo assim, torna-se
importante que mais estudos sejam realizados e as recomendações sejam
frequentemente atualizadas.
Referências
- American Thoracic Society. European Respiratory Society International. Multidisciplinary consensus classification of the idiopathic
interstitial pneumonias. Am J Respir Crit Care Med 2002;165(2):277-304.
- Swigris JJ, Kuschner WG, Kelsey JL, Gould MK. Idiopathic pulmonary
fibrosis: challenges and opportunities for the clinician and investigator.
Chest 2005;127(1):275-83.
- American Thoracic Society. European Respiratory Society International.
Idiopathic pulmonary fibrosis: diagnosis and treatment. Am J Respir Crit Care Med 2000;161(2Pt1):646-64.
- Vainshelboim B. Exercise training
in idiopathic pulmonary fibrosis: is it of benefit? Breathe (Sheff) 2016;12(2):130-8.
- Martinez TY, Pereira
CA, dos Santos ML, Ciconelli RM, Guimarães SM, Martinez JA. Evaluation of the short-form 36-item questionnaire to
measure health-related quality of life in patients with idiopathic pulmonary
fibrosis. Chest.
2000;117(6):1627-32.
- De Vries J, Kessels
BL, Drent M. Quality of life of idiopathic pulmonary
fibrosis patients. Eur
Respir J 2001;17(5):954-61.
- Kawano D, Kairalla
RA, Carvalho RR. Fibrose pulmonar idiopática: uma atualização. Pulmão RJ 2013;22(1):33-37.
- Cottin V, Crestani
B, Valeyre D, Wallaert B, Cadranel J, Dalphin JC et
al. Diagnosis and management of idiopathic pulmonary fibrosis: French practical
guidelines. Eur
Respir Rev 2014;23(132):193-214.
- Xaubet A, Ancochea J,
Bollo E, Fabrellas EF, Franquet T, Molina MM et al. Guidelines for the diagnosis and treatment of idiopathic pulmonary
fibrosis. Arch
Broncopneumol 2013;49(8):343-53.
- Rubin AS, Moreira JS,
Porto NS, Irio KL, Moreira RF, Scheidt B. Fibrose pulmonar idiopática:
características clínicas e sobrevida em 132 pacientes com comprovação
histológica. J Pneumol 2000;26:61-68.
- Raghu G, Collard
HR, Egan JJ, Martinez FJ, Behr J, Brown KK et al. An official
ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based
guidelines for diagnosis and management. Am J Respir Crit Care Med 2011;183(6):788-824.
- Spagnolo P, Del Giovane C, Luppi F, Cerri S, Balduzzi
S, Walters EH et al. Non-steroid agents for idiopathic pulmonary fibrosis.
Cochrane Database Syst Rev 2010;8(9).
- Zanchet RC, Viegas CAA, Lima T. Efficacy of
pulmonary rehabilitation: exercise capacity, respiratory muscle strength and
quality of life in patients with chronic obstructive pulmonary disease. J Bras Pneumol 2005;31(2):118-24.
- Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gotzsche
PC, Loannidis JPA et al. The PRISMA statement for
systematic reviews and meta-analyses of studies that evaluate health care
interventions: Explanation and elaboration. Ann Intern Med 2009;151(4):W65-94.
- Kung J, Chiappelli F, Cajulis
OO, Avezova R, Kossan G,
Chew L et al. From systematic reviews to clinical recommendations for
evidence-bases health care: validation of revised assessment of multiple
systematic reviews (R-AMSTAR) for grading of clinical relevance. Open Dent
J 2010;16(4):84-91.
- United States Preventive Services Task Force. Process for Recommendation Statements [Internet].
[cited
2015 August]. Disponível em URL:
http://www.uspreventiveservicestaskforce.org/Page/Name/process-for-recommendation-statements/.
- Loveman E, Copley
VR, Colquitt J, Scott DA, Clegg A, Jones J et al. The
clinical effectiveness and cost-effectiveness of treatments for idiopathic
pulmonary fibrosis: a systematic review and economic evaluation. Health Technol Assess 2015;19(20):i-xxiv,1-336.
- National Clinical Guideline Centre, 2013. Diagnosis and management of suspected idiopathic pulmonary fibrosis:
idiopathic pulmonary fibrosis. United Kingdon; 2013.
- Nascimento OA,
Iamonti VC, Jardim JR. Reabilitação Pulmonar. Pulmão RJ 2013;22(2):65-69.
- Raghu G. Idiopathic pulmonary fibrosis: guidelines for diagnosis and
clinical management have advanced from consensus-based in 2000 to
evidence-based in 2011. Eur
Respir J 2011;37(4):743-6.
- Du Bois RM, Weycker
D, Albera C, Bradford WZ, Costabel U, Kartashov A et
al. Forced vital capacity in patients with idiopathic
pulmonary fibrosis: test properties and minimal clinically important
difference. Am J Respir Crit Care Med 2011;184(12):1382-9.
- Selman M, King TE, Pardo A, American Thoracic Society, European
Respiratory Society, American College of Chest Physicians. Idiopathic pulmonary
fibrosis: prevailing and evolving hypotheses about its pathogenesis and
implications for therapy. Ann Intern Med 2001;134(2):136-51.