ARTIGO
ORIGINAL
Efeito
imediato da técnica de mobilização nas interfaces fasciais profundas da região
peitoral em pacientes submetidas à mastectomia
Immediate effect of deep fascia mobilization of the pectoral region in
patients submitted to mastectomy
José Roberto de Abreu
Prado Junior, M.Sc.*, Kelly Rosane Inocêncio, Ft.**,
André Custódio da Silva***, Marcia
dos Santos Almeida****, Anke Bergmann, D.Sc.*****, Júlio Guilherme
Silva, D.Sc.******
*Centro
Universitário Augusto Motta (UNISUAM), Rio de Janeiro/RJ, **Fisioterapeuta-Chefe
do Serviço de Fisioterapia Oncológica do Centro Municipal de Reabilitação
Engenho de Dentro, Rio de Janeiro/RJ, ***Prof.
Assistente do Curso de Fisioterapia da Universidade Veiga de Almeida, Prof.
Colaborador do Laboratório de Biomecânica da Universidade Estadual do Rio de
Janeiro (UERJ), ****Especialista em Fisioterapia Traumato-Ortopédica –
Universidade Gama Filho, Colaboradora do Laboratório de Análise de Movimento
Humano – UNISUAM / RJ, Programa de Iniciação Científica – UNISUAM / RJ,
*****Epidemiologista, Instituto Nacional de Câncer (INCA) – RJ, ******Prof. do
Programa de Mestrado e Doutorado em Ciências da Reabilitação do UNISUAM, Prof.
Adjunto do Departamento de Fisioterapia – Faculdade de Medicina, Universidade
Federal do Rio de Janeiro (UFRJ), Coordenador do Grupo de Pesquisa em Terapias
Manuais (GETEM/UFRJ) Marcia dos Santos Almeida
Recebido em 8 de setembro de 2015; aceito em 3 de outubro de 2016.
Endereço
para correspondência:
Júlio Guilherme Silva, Centro Universitário Augusto Motta (UNISUAM), Programa
de Mestrado e Doutorado em Ciências da Reabilitação Laboratório de Análise do
Movimento Humano (LAMH), Praça das Nações, 33, 3? andar,
21041-021 Rio de Janeiro RJ, E-mail: jglsilva@yahoo.com.br; José Roberto de
Abreu Prado Junior jrpradojr@terra.com.br; Kelly Rosane Inocêncio:
kellyinocencio@hotmail.com; André Custódio da Silva:
acustodiodasilva@yahoo.com.br; Marcia dos Santos Almeida:
marciasantos.fisio@gmail.com; Anke Bergmann: abergmann@inca.gov.br
Resumo
Introdução:
O câncer de mama
apresenta alta incidência, morbidade e mortalidade. Seu
tratamento pode
acarretar diferentes complicações, com
repercussões físicas, emocionais e
sociais. No âmbito da reabilitação das
alterações musculoesqueléticas, condutas
de prevenção e tratamento das complicações
pós-operatórias têm merecido atenção
especial, dentre elas podemos destacar as disfunções da
cintura escapular e
ombro. As abordagens terapêuticas miofasciais no tratamento das
disfunções do
ombro pós-operatórias podem favorecer o restabelecimento
da função do membro
superior. Objetivo: Analisar o efeito
imediato da técnica de mobilização fascial profundas na dor e no arco de
movimento (ADM) em mulheres submetidas à mastectomia. Métodos: Neste estudo pré e pós-intervenção em 28 mulheres
mastectomizadas, com intercostobraquialgia e bloqueio de ADM para a flexão do
braço, as pacientes foram submetidas à técnica de mobilização fascial profunda
da região peitoral, em uma única intervenção de 10 segundos. A flexão do braço
foi mensurada por meio da fotogoniometria e a dor avaliada pela escala
analógica visual (EVA). Os dados de ADM foram analisados através do Teste T
student com um nível de significância de 95% (p < 0,05). Resultados: A média da ADM
pré-intervenção foi de 109,99o e pós de 146,08o (p = 0,001) com um percentual
médio de melhora de 32% (± 24,26). A dor teve um percentual de redução pré e
pós-intervenção de 60% (± 24,26). Os dados apontaram para um ganho de ADM e
diminuição da dor nas disfunções do ombro decorrente da mastectomia. Conclusão: Novas investigações devem ser
realizadas para avaliar os resultados da técnica de liberação miofascial
profunda em outros movimentos do ombro, como também comparar com as demais
estratégias cinesioterapêuticas no tratamento das disfunções do ombro em mulheres
mastectomizadas.
Palavras-chave: fáscia, terapia
manual, câncer de mama, ombro.
Abstract
Introduction: Breast cancer has high incidence, morbidity and mortality and its
treatment can result in different complication with physical, emotional and
social repercussions. In musculoeskeletal
rehabilitation, prevention and postoperative treatment of complications have
been highlighted, especially in scapular girdle and shoulder. Myofascial
technique in treatment of the shoulder dysfunctions can benefit the reestablishment
in upper limb function. Objective:
The aim of this study was to evaluate the effect of deep myofascial technique
in pain and range of motion (ROM), in women post-surgery breast cancer. Methods: In this study pre and post
intervention, 28 subjects with intercostobrachialgia
and decreasing ROM were analyzed and submitted to only one intervention during
10 seconds in deep pectoral fascia. Arm flexion was evaluated using photogoniometric technique and for pain Visual Analogical
Scale (VAS). ROM data was analyzed by Test T student with level of significance
95% (p < 0.05). Results: The mean
of ROM pre-intervention was 109,9o and post 146,08o (p = 0.001) and ROM
percentage gain 32% (± 24.26). There was 60% of pain percentage reduction
between pre and post intervention. The results revealed increase of ROM and
decrease of pain in shoulders dysfunction due to mastectomy. Conclusion: Further investigations
should be performed to evaluate the results of deep myofascial technique in
different shoulders movements, as well as to compare with other therapeutic
exercise strategies to treat shoulder dysfunction of mastectomized
women.
Key-words: fascia,
manual therapy, breast cancer, shoulder.
Introdução
O câncer de mama é a
neoplasia de maior incidência na população feminina e a principal causa de
mortes por câncer em mulheres no Brasil [1]. A incorporação de novos métodos
para detecção precoce e tratamento do câncer de mama tem proporcionado aumento
da sobrevida dessas mulheres tanto em países desenvolvidos como em
desenvolvimento [2]. O tratamento primário do câncer de mama consiste na
retirada parcial (cirurgia conservadora) ou total da glândula mamária
(mastectomia), associada à abordagem axilar (linfadenectomia ou biópsia do
linfonodo axilar). Atualmente as mastectomias preservam o músculo peitoral
maior e/ou menor, dependendo das condições cirúrgicas da paciente. Independente
da técnica realizada, após o tratamento cirúrgico, diversas complicações são
relatadas na literatura, entre elas o linfedema, fibrose, aderência
cicatricial, desvios posturais e retrações miofasciais [3-6].
Dentre as diversas
estratégias fisioterapêuticas de intervenção musculoesquelética, uma que tem
merecido destaque é a intervenção no esqueleto fascial. Esta estrutura de
tecido conjuntivo permeia todo o corpo humano e relacionam-se com aponeuroses,
ligamentos, tendões, retináculos, cápsulas articulares, túnicas dos vasos e
órgãos, epineuros, meninges, periósteos, todas as fibras miofasciais do
endomísio e intermusculares [7]. Segundo Myers [8], a unidade músculo-fascial
tem suas matrizes extracelulares, especialmente as miofáscias, cujas forças de
tração são regulares e fortes e estão dispostas como as fibras musculares.
Assim, os “trilhos” de fáscias projetam-se além das origens e inserções
músculo-tendinosas, conectando-se a outros grupos musculares em cadeia. Devido
a essa interface com vários tecidos, os estudos tem apontado a liberação como
um potencial recurso no reestabelecimento da funcionalidade do sistema musculoesquelético
e na redução da dor [8-10].
Baseado nesse
contexto, no campo da fisioterapia oncológica, não há até o momento uma
discussão substancial na literatura acerca da possibilidade de utilização de
técnicas miofasciais no pós-operatório de mastectomias, principalmente sobre os
efeitos imediatos da liberação fascial na dor e no arco de movimento (ADM).
Assim, o objetivo deste trabalho foi avaliar o efeito agudo da aplicação da
técnica de liberação fascial nas interfaces profundas da região peitoral, no
arco de movimento e na dor em pacientes submetidas ao tratamento cirúrgico do
câncer de mama.
Material
e métodos
Delineamento
e população de estudo
Foi realizado um
estudo transversal do tipo pré e pós-intervenção em mulheres submetidas a
tratamento cirúrgico de câncer de mama, todas com preservação do músculo
peitoral, em acompanhamento no serviço de Fisioterapia Oncológica do Centro
Municipal de Reabilitação (CMR), no bairro de Engenho de Dentro, Rio de
Janeiro/RJ. Foram incluídas no estudo aquelas com intercostobraquialgia e
bloqueio de ADM para a flexão do braço. Foram excluídas as pacientes com
malformações congênitas no membro superior com comprometimentos funcionais no
ombro prévio ao tratamento cirúrgico do câncer de mama; pacientes com o
tratamento radioterápico em curso, mulheres submetidas à cirurgia paliativa com
presença de metástases à distância e mulheres que não apresentaram condições de
responder às perguntas inerentes a pesquisa.
O presente estudo foi
aprovado pelo comitê de ética em pesquisa do Centro Universitário Augusto Motta
(UNISUAM) sob o número 020/11 e obedeceu todas as
exigências da Resolução 466/12. Os participantes assinaram o termo de
consentimento livre e esclarecido.
Intervenção
Todas as pacientes
foram posicionadas em decúbito dorsal em uma maca visando minimizar a rigidez
músculo-articular e os aspectos de biotensegridade, conforme proposto por
Ingber [11]. As pacientes foram posicionadas com o antebraço em supinação, com
abdução do ombro em 30º e o cotovelo estendido, expondo os componentes
tendinosos do grupo muscular peitoral, a área de tecido cutâneo e subcutâneo, e
do tecido adiposo da região anterior axilar [10]. Nesta posição, o pesquisador
acessou manualmente a interface mais profunda do grupamento muscular peitoral,
através de um acesso sobre o gradil costal anterior, formando com o segundo,
terceiro e quarto dedos uma superfície côncava, que se encaixava com a
convexidade das costelas mais superiores do paciente (fig. 1a e 1b).
Figura
1A e 1B
– Posicionamento das mãos para aplicação
da técnica de liberação fascial peitoral.
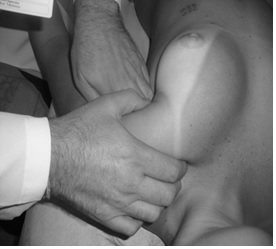
Fig.1A – Posição
inicial, introdução dos dedos na borda anterior da axila. Introdução do 2º ao
4º dedos na região axilar utilizando como referencia a borda anterior da axila.
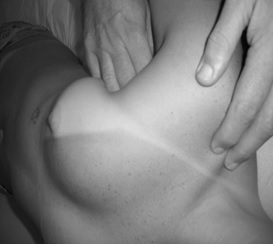
Fig.1B – Após a
introdução dos dedos no espaço fascial da região peitoral, o terapeuta realiza
angulação caudal dos dedos de 45º. Após a inclinação, o fisioterapeuta realiza
uma pinça com o indicador e o polegar e tracionará a borda superior e inferior
do peitoral maior e realiza o movimento de liberação.
A mobilização
obedeceu à arquitetura do esqueleto fascial, seguindo na direção da articulação
esterno-clavicular, e o trajeto respeitou uma angulação aproximada de 45º, de
acordo com o padrão dos trilhos fasciais da região e o modelo matemático em
mosaico do esqueleto fascial [12]. A técnica de mobilização seguiu o
procedimento padrão de mobilizar as fáscias profundas, fazendo um movimento
elíptico com os dedos de forma a mobilizar a fáscia peitoral profunda. A
projeção dos dedos obedeceu a uma relação com a clavícula de 90º da região
peitoral, na borda anterior da axial, até o terço intermédio da clavícula
ipsilateral. Nesta região encontra-se um túnel fibroso, que obedece a mesma
arquitetura fascial supracitada [12-14]. A manobra foi dirigida através desse
túnel fibroso até a região infraclavicular, quando foi completado o
descolamento do grupo muscular dos peitorais. Após a chegada ao ponto esternal
de acesso, foi realizada uma manobra de tração axial e descolamento
crânio-caudal dos músculos peitorais completando o procedimento no tempo de 10
segundos.
Desfechos
Para avaliação da
resposta terapêutica foi considerada a alteração pré e pós-intervenção da dor e
da amplitude de movimento do braço homolateral. Referente à avaliação da dor,
foi utilizada a Escala Visual Analógica (EVA) que consiste de uma linha de 10
cm, com âncoras em ambas as extremidades. Numa delas é marcada “nenhuma dor” e
na outra extremidade é indicada “a pior dor possível” [15]. As pacientes
indicaram a magnitude da dor no início (DI) e imediatamente após, ou seja, ao
final da intervenção (DF). Para avaliação da alteração percentual de dor (APD)
entre as avaliações, foi utilizada a fórmula APD = [(DI-DF) ÷ DI] × 100.
Para
avaliação da
amplitude do movimento flexão de braço (ADM), o avaliador
cego registrou as
condições pré e
pós-intervenção pela técnica de
fotogrametria. Para captação do
ADM, foi utilizada uma sala com 24m2 de dimensão. Utilizou-se
uma câmera
digital Sony, modelo DSC-W30, assim como o software
Fotogoniômetro, fisiometer
versão 5.0, que possibilitou a quantificação dos
dados referentes aos
deslocamentos angulares em perfil do movimento de flexão do
membro superior. Um
tripé ficou posicionado a 0,83 m de altura do solo e a 2,5 m de
distância dos
sujeitos. Para o delineamento do modelo foram utilizados marcadores
passivos
amarelos de 20 mm, fixados em pontos anatômicos
estratégicos, sendo eles:
crista ilíaca, ângulo do acrômio, epicôndilo
lateral e processo estiloide da
ulna (Fig. 2). Ressaltamos, também, que foi colocado um pano
preto no fundo a
fim de gerar contraste. Para a execução do ato motor
supracitado, adotou-se a posição
fundamental por ser natural, com o objetivo de determinar o
posicionamento
inicial de registro da imagem para possibilitar posteriormente a
comparação das
imagens nos momentos pré e pós-intervenção
(Fig. 3).
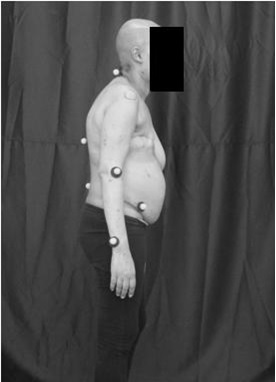
Figura
2 – Posicionamento inicial do paciente para
análise do movimento do ombro, vista de perfil. Em
branco os marcadores nos pontos de interesse.
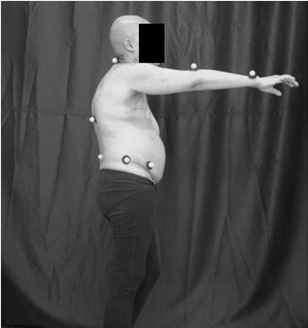
Figura
3 – Posicionamento final do paciente, movimento de flexão do braço, vista de perfil.
Para avaliação da
alteração percentual de amplitude de movimento (APADM) entre a ADM inicial
(ADMI) e a ADM ao final da intervenção (ADMF), foi utilizada a fórmula APADM=
[(ADMI-ADMF)/ADMI] ×100.
Cálculo
do tamanho amostral
Para o cálculo do
tamanho amostral foi estimado uma proporção de melhora de 50% no relato de dor
e na amplitude de movimento pré e pós-intervenção, com precisão absoluta de 20%
e nível de significância de 5%. Considerando estes parâmetros, o número mínimo
necessário à inclusão de 24 voluntários.
Análise
dos dados
Foi realizada uma
análise descritiva da população estudada por meio das medidas de tendência
central das variáveis contínuas e, para as categóricas, foi obtida a frequência
absoluta e relativa. Para tratamento estatístico dos valores pré e
pós-intervenção utilizou-se o Teste T pareado para análise das possíveis
diferenças entre os momentos de amplitude articular e Wilcoxon para avaliar a
dor, com o nível de significância de 95%.
Resultados
Foram incluídas 28
mulheres submetidas a tratamento cirúrgico para o câncer de mama, em média, há
45,5 ± 32,7 meses. Na inclusão do estudo, apresentavam média de idade de 63,7 ±
9,68 anos. O câncer de mama estava localizado, em sua maioria, no lado direito
(57,1%). A cirurgia mamária mais frequente foi a
mastectomia radical modificada (54%), todas com preservação dos músculos
peitorais (84,6%), sendo retirados em média, 11 linfonodos axilares (± 7,53). O
carcinoma ductal infiltrante foi tipo histológico mais predominante (78,9%). Em
relação ao tratamento adjuvante, 10,7% foram submetidas à quimioterapia, 77,8%
a radioterapia e 80,8% a hormonioterapia (tabela I).
Tabela
I –
Análise descritiva das características das mulheres incluídas no estudo (n =
28).
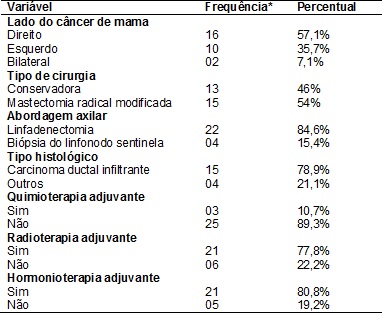
*As diferenças na
frequência correspondem à perda de informação.
Anterior a
mobilização nas interfaces fasciais profundas, 20 (71,4%) mulheres relataram
dor na região peitoral com intensidade valor de 4 na
EVA. Ao final da intervenção, 5 sujeitos (17,9%) ainda
se queixavam de dor com intensidade média de 3 na EVA. Considerando as que
mantiveram relato de dor após a intervenção, foi observado um percentual médio
de melhora de 60% na EVA. Não foi observado nenhum caso de piora da dor em
decorrência do procedimento realizado. A média de amplitude do movimento de
flexão homolateral ao câncer de mama, avaliado pela fotogrametria anterior a
intervenção, foi 109,99o ± 22,46 e após a intervenção foi de 146,08o ± 12,92 (p
= 0,001). Foi observado um percentual médio de melhora da ADM após a
intervenção de 32%.
Discussão
A realização da
mobilização fascial profunda da região peitoral em pacientes submetidas à
mastectomia proporcionou melhora imediata da dor e da amplitude articular de
movimento do ombro na maioria dos sujeitos da pesquisa. Como a fáscia é um
componente do tecido mole do sistema conectivo tissular que permeia o corpo
humano, ela funciona como uma matriz tridimensional de suporte estrutural
(esqueleto fibroso) permeando e envolvendo todos os órgãos, músculos, ossos e
fibras nervosas. Logo, influencia a funcionalidade de todos os sistemas [16].
Segundo Ingber [11],
o corpo humano é organizado em um sistema mecanicamente autoestabilizado,
caracterizado pelo perfeito equilíbrio das forças de tensão e compressão
(tensegridade). O corpo humano usa da arquitetura da tensegridade para
estabilizar sua forma e integrar a estrutura e função das células, tecidos,
órgãos e qualquer outra estrutura. As trocas bioquímicas intracelulares são originadas
a partir de forças aplicadas por um sistema mecânico molecular
(mecanotransdução). Isto é, as forças aplicadas em macroescalas produzem trocas
bioquímicas celulares, o que poderia vir a esclarecer como as aplicações locais
e sistêmicas da Fisioterapia podem influenciar fisiologicamente todos os tipos
de tecidos.
O processo que induz
às alterações do tecido miofascial tem sido cada vez mais investigado. Ercole et al. [9] sugerem que a causa pode estar
relacionada com a alteração da composição das fibras de colágeno, ou com a
transformação dos fibroblastos em miofibroblastos, ou ainda com uma alteração
da substância fundamental por influências neurofisiológicas que acarretariam em
mudanças nas relações bioquímicas celulares. Ercole et al. [9] ainda acrescentam que quando a fáscia perde a sua
flexibilidade e torna-se restrita, isto pode ser uma fonte de desalinhamento
corporal que acarreta problemas biomecânicos, alterando a força muscular, o
equilíbrio e, por conseguinte, prejudicando a coordenação motora. No final
deste processo os pacientes podem apresentar dores e perdas funcionais no
ombro, pela desorganização tecidual gerada pelas mudanças de sua tensegridade
[11]. De acordo com os nossos achados, o efeito agudo positivo pós-intervenção
da mobilização do trilho fascial anterior deve-se a quebra de aderências
provocadas pelo imobilismo, restrição de movimento do ombro no pós-cirúrgico.
Tal fato está em concordância com os estudos de Schleip e Müller [17]; Day,
Stecco e Stecco [18] e Fourie e Robb [19] sobre o restabelecimento da
distribuição de forças, após uma intervenção fascial. Assim, com um mecanismo
de fluidez de energia sobre a fáscia da região peitoral para o membro superior
[18], a técnica indica uma redução dos efeitos deletérios da aderência fascial
na dor e no arco de movimento do ombro. Fourie e Robb [19] apontam que no caso
das pacientes submetidas a mastectomias com sequelas funcionais da cintura
escapular e braço as mesmas podem ser denominadas Axilar web syndrome.
Quanto à dor
referida, é uma experiência sensorial e emocional desagradável, associada a um
dano real ou potencial dos tecidos. Cada indivíduo aprende a utilizar este
termo através de suas experiências traumáticas prévias [19]. Pacientes que
sentem dor possuem alterações biológicas e psicossociais, havendo prejuízos no
humor, relações sociais e também na funcionalidade do indivíduo como um todo
[20]. Com a mobilização da fáscia peitoral, os nossos dados estão em
consonância com os achados de Day, Stecco & Stecco [18] com a redução de
57% da dor entre os sujeitos após a intervenção miofascial, além do ganho de
arco de movimento do ombro em pacientes com dor crônica posterior no braço.
Apesar da eficiência
da abordagem cirúrgica para o tratamento do câncer de mama, várias complicações
têm sido relatadas decorrentes desses procedimentos, dentre elas destaca-se a
dor crônica pós-cirúrgica [21]. A dor crônica secundária ao procedimento
cirúrgico pode ser neuropática ou nociceptiva. A primeira é caracterizada como
a dor resultante da lesão de nervos ou disfunção do sistema nervoso, entidade
esta que tem sido mais estudada por ser mais frequente e corresponde à síndrome
dolorosa pós-mastectomia e a segunda é resultante da lesão dos músculos,
ligamentos e aderências miofasciais [22].
Fernández-Lao et al. [23], em seu estudo, analisaram
mulheres submetidas a cirurgia radical modificada. Foi constatada a presença de
dor na musculatura do pescoço e dos ombros, sugerindo que a dor pós-cirúrgica
do câncer de mama apresenta componentes miofasciais. As lesões de tecidos
moles, tradicionalmente diagnosticadas como sinais e sintomas da fase aguda,
podem resultar de inflamações crônicas nesses pacientes. Ultimamente estes
acometimentos são apontados como dor por disfunção fascial e fibrose [24]. Em
estudo realizado na população brasileira, foi observado incidência de 52,9% de
dor após 8 meses de tratamento cirúrgico do câncer de
mama [22]. Isto sugere que a manobra proposta neste estudo pode ser uma
ferramenta importante e inserida na rotina de especialistas no tratamento das
sequelas motoras no ombro pós-mastectomias.
A dor miofascial é
única e distinta, podendo se originar tanto no músculo como na fáscia. Tanto o
local da lesão quanto unidades miofasciais afetadas tornam-se menos
distensíveis. Isto acarreta uma diminuição da amplitude de movimento nas
unidades miofasciais e articulações associadas a um determinado segmento
[21-26]. Wadsworth [26] afirma que a tensão miofascial pode influenciar a
postura corporal, a flexibilidade, a amplitude de movimento e ainda levar a
sobrecargas biomecânicas que podem originar dores crônicas. Neste estudo, a
prevalência de dor foi de 71,4%. Após a mobilização nas interfaces fasciais
profundas, 17,9% ainda se queixavam de dor, entretanto com uma media percentual
de melhora em 60%. Ressaltamos, ainda, que não ocorreu na amostra um quadro de
piora pós-intervenção. Outro fator fascial que pode estar envolvendo a dor é o
abundante número de terminações nervosas (mecanorreceptores). A fáscia é uma
estrutura altamente inervada e consequentemente as aderências podem alterar a
condução nervosa. Assim, com a restauração do equilíbrio das tensões fasciais,
baseado no conceito de tensegridade [8], a dor musculoesquelética pode ser
reduzida imediatamente após a liberação. Tal fato pode explicar os nossos
resultados com uma redução substancial da dor entre os momentos pré e
pós-intervenção.
Como principais
limitações do presente estudo, podemos ressaltar a impossibilidade de verificar
o tempo de duração dos efeitos para os desfechos dor e ADM e a impossibilidade
do mascaramento da intervenção. Outro aspecto é a escassez na literatura de
trabalhos que abordem os efeitos sobre as intervenções fasciais nesta população
que dificulta as comparações entre a técnica aqui exposta e as demais
intervenções.
Conclusão
Os nossos resultados
apontam uma possível aplicabilidade da técnica miofascial para ganho de ADM e
diminuição do quadro álgico nas disfunções do ombro decorrente das
mastectomias. Entretanto, devido às limitações do nosso estudo como a
durabilidade do ganho funcional, o acompanhamento das pacientes sobre o quadro
álgico restringe maiores inferências. Novas investigações devem ser realizadas,
para avaliar os resultados da manobra nas interfaces profundas no trilho
fascial anterior, em outros movimentos uniplanares do ombro. Especialmente no
que se refere à duração e/ou a permanência do efeito de ganho do arco de
movimento, nossos resultados sugerem que a mobilização do trilho fascial anterior,
na região da musculatura peitoral pode ser introduzida na rotina dos serviços
de Fisioterapia Oncológica que tratam dessas disfunções. Principalmente, ao
tomar como referência o ADM e a dor e aumentar as possibilidades da
funcionalidade do segmento.
Referências
- INCA. Instituto Nacional
do Câncer, Brasil, “Estimativa 2014: Incidência de Câncer no Brasil”. [citado 2015
Abril 17]. URL: http://www.inca.gov.br/estimativa/2014
- Allemani C, Weir HK, Carreira
H, Harewood R, Spika D, Wang XS et al. CONCORD Working Group. Global surveillance of cancer survival 1995-2009:
analysis of individual data for 25,676,887 patients from 279 population-based registries
in 67 countries (CONCORD-2). Lancet 2015;385(9972):977-1010.
- Oliveira JF, Pereira TB, Dias RA, Ribeiro ACP, Abrahão
F, Silva JG, Bergmann A. Incidence and risk factors of winged scapula after axillary
lymph node dissection in breast cancer surgery. Appl Cancer Res 2009;29:69-73.
- Bergmann A, Mendes VV,
de Almeida Dias R, do Amaral e Silva B, da Costa Leite Ferreira MG, Fabro EA. Incidence and risk factors for axillary web syndrome after
breast cancer surgery. Breast Cancer Res Treat
2012;131(3):987-92.
- Fabro EAN, Bergmann A, Silva BA, Ribeiro
ACP, Abrahão KS, Ferreira MGC, ET al. Post-mastectomy
pain syndrome: incidence and risks. The Breast 2012;21:321-25.
- Bevilacqua JL, Kattan MW, Changhong Y, Koifman S, Mattos IE, Koifman RJ et al. Nomograms for predicting the risk of arm lymphedema
after axillary dissection in breast cancer. Ann Surg Oncol 2012;19(8):2580-9.
- Findley T. Fascia Research II: Second International Fascia Research Congress.
Int J Ther
Massage Bodyw 2009;2(3):4-9.
- Myers TW. Trilhos anatômicos:
meridianos miofasciais para terapeutas manuais e do movimento 2ª ed. Rio de Janeiro:
Elsevier; 2010.
- Ercole B, Antonio S, Ann
DJ, Stecco C. How much time is required to modify a fascial fibrosis? J Bodyw Mov Ther 2010;14(4):318-25.
- Ingber D. Tensegrity and Mechanotransduction. J Bodyw Mov Ther 2008;12(3):198-200.
- Stecco A, Masiero S, Macchi
V, Stecco C, Porzionato A, De Caro R. The pectoral fascia: anatomical and histological
study. J Bodyw Mov
Ther 2009;13(3):255-61.
- Ingber D. Tensegrity and Mechanotransduction. J Bodyw Mov Ther 2008;12(3):198-200.
- Ruggiero C, Benvenuti S, Borchi
S, Giacomini M. Mathematical model of retinal mosaic formation. Biosystems 2004;76(1-3):113-20.
- Fourie WJ, Robb KA. Physiotherapy management
of axillary web syndrome following breast cancer treatment: Discussing the use of
soft tissue techniques. Physiotherapy
2009;95(4):314-20.
- Stecco C, Gagey O, Macchi
V, Porzionato A, De Caro R, Aldighieri R, et al. Tendinous muscular insertions onto the deep fascia of the upper limb. First
part: anatomical study. Morphologie 2007;91(292):29-37.
- Schleip R, Naylor IL, Ursu D, Melzer W, Zorn A, Wilke HJ et al. Passive muscle stiffness
may be in?uenced by active contractility of intramuscular
connective tissue. Med Hypotheses 2006;66(1):66-71.
- Day JA, Stecco C, Stecco
A. Application of fascial manipulation technique in chronic shoulder pain - Anatomical
basis and clinical. J Bodyw Mov Ther
2009;13:128-35.
- Fourie WJ, Robb KA. Physiotherapy management
of axillary web syndrome following breast cancer treatment: Discussing the use of
soft tissue techniques. Physiotherapy 2009;95(4):314-20.
- Schleip R, Naylor IL, Ursu D, Melzer W, Zorn A, Wilke HJ, Horn FL, Klingler W. Passive
muscle stiffness may be in?uenced by active contractility
of intramuscular connective tissue. Med Hypotheses 2006;66(1):66-71.
- Huijing P. Muscle as a collagen
fiber reinforced composite: a review of force transmission in muscle and whole limb.
In: Findley T, Schleip R. (Eds.), Fascia Research. Munich:
Elsevier GmbH; 2007. p.90.
- Pimenta CAM, Cruz DALM.
Instrumentos para avaliação da dor: o que há de novo em nosso meio. Arq Bras Neurocir 1998;17(1):15-24.
- Fernández-Lao C, Cantarero-Villanueva I, Fernández-de-Las-Peñas C, Del-Moral-Ávila R, Menjón-Beltrán
S, Arroyo-Morales M. Development of active myofascial trigger points in neck and
shoulder musculature is similar after lumpectomy or mastectomy surgery for breast
cancer. J
Bodyw Mov Ther 2011;16(2):183-90.
- Couceiro TCM, Menezes
TC, Valênça MM. Síndrome dolorosa pós-mastectomia. A magnitude do problema. Rev Bras Anestesiol 2009;59(3):358-65.
- Manheim CJ. The myofascial release manual. Thorofare: Slack Inc.; 2008.
- Wadsworth D. Locomotor Slings: a new total body approach to treating chronic
pain. Journal
of the Australian Association of Massage Therapists 2007;1:17-21.