REVISÃO
Suplementação
com probióticos para intolerância a lactose: uma
revisão narrativa
Probiotics supplementation for lactose intolerance: a narrative review
Sinara Terezinha
Marchezan*, Roberta Hack Mendes, D.Sc.*
*Departamento
de Ciências da Saúde, Curso de Nutrição, Universidade Regional Integrada do
Alto Uruguai e das Missões, Frederico Westphalen/RS
Recebido 26 de julho
de 2017; aceito 15 de outubro de 218
Endereço
para correspondência:
Roberta Hack Mendes, Universidade Regional Integrada
do Alto Uruguai e das Missões- URI, Avenida Assis Brasil, 709 Itapajé 98400-000
Frederico Westphalen
RS, E-mail: nutribetahack@gmail.com; Sinara Terezinha
Marchezan: sinaramarchezan@hotmail.com
Resumo
A intolerância a
lactose (IL) primária costuma se manifestar a partir dos 3-4 anos, com
prevalência variando conforme etnia e idade. Lactose é um dissacarídeo
encontrado no leite dos mamíferos em quantidade variável, em torno de 2-8% do
volume de leite, com variações conforme as espécies. O quadro clínico conhecido
popularmente como IL caracteriza-se por diminuição parcial ou total da
atividade da enzima lactase na mucosa do intestino
delgado dos indivíduos acometidos pela doença. Esta revisão tem por objetivo
pautar o tratamento adequado para intolerância à lactose, dando ênfase ao
efeito da suplementação com probióticos. O possível
papel dos probióticos na IL não é completamente
compreendido. As culturas bacterianas podem beneficiar indiretamente o
hospedeiro, fornecendo enzima lactase para o
intestino delgado. Lise das bactérias por ácidos biliares permite que a lactase seja administrada, o que hidrolisa lactose,
permitindo a absorção do componente glicose e açúcares de galactose. Existem
evidências na literatura que justificam o uso de algumas cepas específicas na
terapia destes pacientes. No entanto, mais estudos clínicos randomizados são
necessários para verificar as possíveis interferências do tratamento com probióticos na saúde humana a longo prazo.
Palavras-chave: intolerância a
lactose, probióticos, microbioma
intestinal.
Abstract
Primary lactose intolerance (IL) usually manifests as early as 3-4
years, with prevalence varying according to ethnicity and age. Lactose is a
disaccharide found in milk of mammals in varying amounts, around 2-8% of milk
volume, with variations depending on the species. The clinical picture
popularly known as lactose intolerance is characterized by partial or total
decrease of the activity of the enzyme lactase in the mucosa of the small
intestine of the individuals affected by the disease. This review aims to guide
the appropriate treatment for lactose intolerance, with emphasis on the effect
of probiotic supplementation. The possible role of probiotics in lactose
intolerance is not fully understood. Bacterial cultures may indirectly benefit
the host by supplying lactase enzyme to the small intestine. Lysis of the bacteria by bile acids allows the lactase to
be administered, which hydrolyzes the lactose, allowing the absorption of the
glucose component and sugars of galactose. There is
evidence in the literature that justifies the use of some specific strains in
the therapy of these patients. However, more randomized clinical trials are
needed to verify the potential interference with long-term probiotic treatment
in human health.
Key-words: lactose
intolerance, probiotics, gut microbiome.
Introdução
Lactose é um
dissacarídeo (D+glucose e D+galactose)
encontrado no leite dos mamíferos em quantidade variável, em torno de 2-8% do
volume de leite, com variações conforme as espécies. Por exemplo, no leite
humano a cada 100 ml, 7,2 g é lactose. Já no leite de vaca 4,7 g a cada 100 ml
é lactose [1].
A intolerância a
lactose (IL) primária costuma se manifestar a partir dos 3-4 anos, com
prevalência variando conforme etnia e idade. Na Europa a prevalência é de
aproximadamente 7-20%, já no continente africano este número muda para 65-75% e
entre 60-90% no continente Asiático [2].
O diagnóstico da IL
pode ser feito de diferentes formas. O teste considerado padrão ouro é a
dosagem da atividade da lactase, sacarase
e maltase por meio de biópsia intestinal. Entretanto, a utilização deste método
não é comum devido à sua natureza invasiva. Os testes mais frequentemente
usados são os bioquímicos e colorimétricos, por serem pouco invasivos e rápidos
[3].
O quadro clínico
conhecido popularmente como IL (galactose β-1,4 glucose) caracteriza-se
principalmente pela diminuição parcial ou total da atividade da enzima lactase na mucosa do intestino delgado dos indivíduos
acometidos pela doença (Figura 1). Esta enzima é a responsável por hidrolisar o
dissacarídeo lactose em dois monossacarídeos, a glicose e a galactose [4].
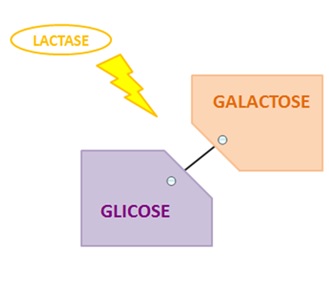
Figura
1 - Papel da enzima lactase
no lumen intestinal.
Com a presença da
lactose não absorvida, ocorre no lúmen intestinal um aumento da pressão
osmótica, retendo água e aumentando o trânsito intestinal, resultando em fezes
amolecidas e diarreia, entre outros sintomas gastrointestinais como
flatulências, dor e distensão abdominal, borborigmos e em alguns casos até
vômito, com isso comprometendo a absorção de cálcio pelo organismo. Não há uma
quantidade definida de lactose que irá causar sintomas, isso varia de indivíduo
para indivíduo, dependendo da dose de lactose consumida ou ingerida e o grau de
deficiência de lactase [5].
O tratamento da IL
não deve apenas buscar a melhorar absorção da lactose, mas recuperar o sistema
digestivo. Recentes estudos incluem os probióticos
como uma estratégia de tratamento para IL, pois eles alterariam a flora
intestinal e poderiam trazer benefícios para pacientes que manifestam a
síndrome do intestino irritável mesmo após melhora da absorção da lactose [6].
A FAO/WHO define probióticos como sendo micro-organismos vivos que, quando
administrados em doses adequadas, conferem benefícios à saúde do hospedeiro.
Dentre os efeitos benéficos pode-se destacar: alívio dos sintomas causados pela
intolerância à lactose, tratamento de diarreias, diminuição do colesterol
sérico, aumento da resposta imune e efeitos anticarcinogênicos
[7].
Assim, na tentativa
de compreender de forma mais efetiva o tema envolvendo intolerância alimentar,
considerando a importância do assunto para os profissionais da nutrição, esta
revisão tem por objetivo pautar o tratamento adequado para intolerância à
lactose, dando ênfase ao efeito da suplementação com probióticos.
Sinais
clínicos e tratamentos convencionais para intolerância a lactose
Nos quadros de
deficiência na digestão da lactose ocasionada pela ausência total ou parcial da
enzima lactase, esse carboidrato não pode ser hidrolisado,
acumulando-se no intestino. Esta lactose não digerida sofre fermentação pelas
bactérias do colón, gerando ácido láctico e outros ácidos orgânicos tais como
dióxido de carbono e gás hidrogênio, o que resulta em distensões e dores
abdominais. Ainda, a pressão osmótica aumenta quando a lactose passa pelo
intestino grosso, onde ocorre a retenção de água que dá início aos sintomas de
IL [4].
Os sintomas típicos
incluem dor abdominal, sensação de inchaço no abdome, flatulência, diarreia,
borborigmos e, particularmente nos jovens, vômitos. A dor abdominal pode ser em
cólica e frequentemente é localizada na região periumbilical
ou quadrante inferior. O borborigmo pode ser audível no exame físico e para o
paciente. As fezes usualmente são volumosas, espumosas e aquosas. Outra
característica importante é que estes indivíduos, mesmo com quadro de diarreia
crônica, geralmente não perdem peso. Em alguns casos a motilidade
gastrintestinal está diminuída e os indivíduos podem apresentar constipação,
possivelmente como consequência da produção de metano [8].
O
tratamento da
intolerância à lactose não deve visar primariamente
à redução da má absorção,
mas a melhora dos sintomas gastrointestinais. A restrição
da ingestão de
lactose é recomendada porque em estudos de pacientes com
intolerância à lactose
auto relatada, mesmo aqueles com Intestino Irritável
Predominante (IIP), pode ingerir pelo menos 12 g de lactose sem experimentar
sintomas. Doses ainda maiores (15 a 18 g de lactose) parecem ser toleradas quando
os produtos lácteos são tomados com outros nutrientes. Uma análise de caso
retrospectiva melhoria do desconforto abdominal, com restrição de lactose em
até 85% dos pacientes com IIP com má absorção de lactose; entretanto, estudos
prospectivos mostram que a restrição de lactose por si só não é alívio efetivo
dos sintomas na doença GI funcional. Esta abordagem é eficaz se os sintomas
estão relacionados apenas aos produtos lácteos [6].
A exclusão do leite
da dieta de pacientes portadores de má digestão da lactose pode acarretar
prejuízos nutricionais e consequentes danos à saúde. Existem no mercado
produtos alternativos, com reduzidos teores de lactose, capazes de suprir as
necessidades nutricionais desses pacientes. Entre esses produtos podemos destacar
os iogurtes, queijos duros e leites processados com baixos teores de lactose.
Esse é um nicho de mercado em expansão, favorável para investimento das
indústrias laticinistas [9].
A terapia de
reposição enzimática com lactase exógena (+β-galactosidase), obtida de leveduras ou fungos, constitui
uma possível estratégia para a deficiência primária de lactose. Estes
preparados comerciais de “lactase”, quando
adicionados a alimentos que contenham lactose ou ingeridos com refeições com
lactose, são capazes de reduzir os sintomas e os valores de hidrogênio expirado
em muitos indivíduos intolerantes à lactose. Entretanto, estes produtos não são
capazes de hidrolisar completamente toda a lactose da dieta com resultados
variáveis em cada paciente. As “lactases” exógenas
estão disponíveis comercialmente na forma líquida e em cápsulas e tabletes, e
possivelmente as diferentes preparações não são equivalentes. A enzima solúvel
pode ser adicionada ao leite que é então refrigerado de um dia para o outro
antes do uso (porém pouco prático para uso frequente). Apesar dos trabalhos
enfatizarem a eficácia das formulações líquidas de “lactase”
na melhora dos sintomas e na redução do hidrogênio expirado, a taxa real de
eficácia apresenta resultados discrepantes, que decorrem do tipo de microorganismo utilizado, da contribuição da atividade
residual da lactase da mucosa intestinal, e da dose
de reposição utilizada. As preparações em cápsulas e tabletes utilizadas na
hora da refeição são mais caras que o leite pré-hidrolisado,
porém são eficazes, palatáveis, de fácil uso e praticamente sem efeitos
colaterais, sendo uma boa alternativa para reposição enzimática nos pacientes
intolerantes à lactose [8].
Uso de
suplementação com probióticos no tratamento da
intolerância a lactose
Os probióticos podem ser considerados como alimentos
funcionais que visam assegurar o bem-estar e reduzir o risco de desenvolvimento
de doenças, sendo também uma alternativa que está sendo pesquisada no
tratamento de doenças, entre as quais podemos citar a intolerância à lactose.
Os probióticos são benéficos à saúde humana, pois
aliviam e ajudam aqueles que são intolerantes à lactose. Esses têm como
mecanismo de ação a diminuição na concentração da lactose em produtos
fermentados; a maior atividade da lactase em
preparações bacterianas que são usadas na fabricação dos produtos e a maior
atividade da enzima lactase que chega ao intestino
delgado junto com o produto fermentado ou dentre as bactérias viáveis capazes
de sobreviver à acidez e à bile [4].
A seleção de
bactérias probióticas tem como base os seguintes
critérios: o gênero, a origem (que deve ser humana), a estabilidade frente ao
ácido estomacal e aos sais biliares, a capacidade de aderir à mucosa
intestinal, a capacidade de colonizar, ao menos temporariamente, o trato
gastrintestinal humano, a capacidade de produzir compostos antimicrobianos e a
atividade metabólica no intestino. Para ser considerado probiótico
cada cepa de bactéria deve estar em concentração (108-10 por dia).
Mesmo assim, mais pesquisas são necessárias na área de dosagem e ultra dosagem, demonstrando a segurança de bactérias que
podem ser potencialmente patogênicas [10].
Os probióticos usados na alimentação, fornecidos como
suplementação alimentar ou como componente ativo de uma medicação registrada,
deve conseguir não apenas sobreviver à passagem por meio do aparelho digestivo
e mostrar sobrevivência ao ácido e à bile, mas ser capazes de proliferar no
intestino. Os probióticos devem ser capazes de
exercer seus benefícios sobre o hospedeiro por meio do crescimento e/ou da
atividade no corpo humano. A aplicação tópica ou local dos probióticos
também é proposta em vista da recente avaliação de dados científicos [11].
O gênero Lactobacillus é amplamente distribuído no meio ambiente,
especialmente em alimentos vegetais, no trato genital e gastrintestinal. Seu
crescimento é influenciado por fatores como pH,
presença de oxigênio, interações com outras bactérias e presença de fatores
específicos. Como produto do metabolismo primário, eles acumulam ácido lático
no meio, são estritamente fermentativos e raramente apresentam patogenicidade.
Entre suas espécies pode-se citar os Lactobacillus casei, Lactobacillus
rhamnosus, Lactobacillus acidophilus. Os lactobacilos inibem a proliferação de
microrganismos não benéficos, pela competição com locais de ligação e
nutrientes e produzem ácidos orgânicos, que reduzem o pH
intestinal, retardando o crescimento de bactérias patogênicas. As bifidobactérias são anaeróbicas ou anaeróbicas estritas,
normalmente predominantes no intestino grosso, e têm papel benéfico nos quadros
de diarreia [7]. Para um bom crescimento desses microrganismos, a temperatura
ideal é de 30-40°C [4].
Explicitam como
principais mecanismos de ação: o estímulo da resposta imune do hospedeiro (por
aumentar a atividade fagocitária, a síntese de IgA e a ativação de linfócitos T e B); a ligação e a
degradação de compostos com potencial carcinogênico; as alterações qualitativas
e/ou quantitativas na microbiota intestinal envolvidas na produção de
carcinógenos; a produção de compostos antimutagênicos
no cólon (como o butirato); alteração da atividade
metabólica da microbiota intestinal; alteração das condições fisicoquímicas do cólon com diminuição do pH; e efeitos sobre
a fisiologia do hospedeiro [7].
O possível papel dos probióticos na gestão da IL não é completamente
compreendido. As culturas bacterianas podem beneficiar indiretamente o
hospedeiro, fornecendo enzima lactase para o
intestino delgado. Lise das bactérias por ácidos biliares permite que a lactase seja administrada, o que hidrolisa Lactose,
permitindo a absorção do componente glicose e açúcares de galactose. Os probióticos adicionados aos produtos lácteos, podem aliviar
a intolerância, modificando as bactérias colônicas e,
assim, melhorar a função intestinal através da alteração do pH
intestinal para melhorar a hipersensibilidade visceral, diminuindo os sintomas.
Existem algumas evidências consistentes de que as culturas iniciais em iogurte
reduzem os sintomas de intolerância à lactose. No entanto, muitos dos estudos
realizados até agora que avaliam o uso de probióticos
reduzindo os sintomas de intolerância à lactose são consideravelmente pobres.
Existem também inconsistências nos diagnósticos utilizados para a intolerância
à lactose. Portanto, são necessárias mais pesquisas para chegar a uma conclusão
[12].
A literatura recente
mostrou que um dos mecanismos de ação dos probióticos
envolve a estimulação do sistema imunológico. O fato dos probióticos
precisarem estar ‘‘vivos’’ para induzir a modulação imune pode ser questionado.
Portanto, a definição talvez precise ser revisada no futuro [11].
Kefir e
outros alimentos probióticos que auxiliam na
intolerância a lactose
A inserção de
culturas probióticas na alimentação de pacientes
intolerantes à lactose auxilia na digestão da lactose devido à presença ativa
da enzima lactase, que favorece a regulação do
transito intestinal e alívio da sensibilidade aos sintomas de má absorção. Nesse
sentido, pesquisadores propuseram o uso de Streptococcus thermophiles, uma bactéria capaz de
metabolizar à lactose como um modelo metabólico para o
uso de carboidrato no intestino. Esses autores demonstraram, através de dados
recentes, que o consumo iogurte contendo esses microrganismos é capaz de
aliviar os sintomas da intolerância à lactose. Em um estudo realizado com 11
voluntários intolerantes a lactose utilizando suplementação como cápsulas de bifina (B.longum) e iogurtes probióticos
(com B. animalis,
L. bulgaricus, S. thermophilus)
foram analisados amostra de fezes e bactérias totais do cólon. Os resultados
obtidos demonstraram uma significativa melhora nos sintomas de intolerância à
lactose, com aumento na quantidade de bactérias totais durante o período de
suplementação. As bifidobactérias mantiveram-se em um
nível aumentado em relação ao período pré-suplementação,
enquanto vários outros grupos de bactérias tiveram sua população reduzida.
Concluiu-se que o uso de bifidobactérias como
alimentação modifica a quantidade e as atividades metabólicas na microbiota do
cólon e aliviam os sintomas em intolerantes à lactose [4].
O kefir,
também conhecido como quefir, tibicos, cogumelos
tibetanos, plantas de iogurte, cogumelos do iogurte, é um leite fermentado
produzido a partir dos grãos de kefir. É originário
do eslavo Keif
que significa "bem-estar" ou "bem-viver". Acredita-se que
teve sua origem nas montanhas do Cáucaso, no Tibet ou
Mongólia, há séculos atrás. Quando se pergunta sobre a origem dos grãos, os
caucasianos respondem que foram presentes de Alah
(Deus), o que explica ter recebido também o nome de "milho do
profeta", em alusão a Maomé [13].
Segundo o Ministério
da Agricultura, Pecuária e Abastecimento, através do Regulamento Técnico de
Identidade e Qualidade de Leites Fermentados define kefir
como: Leite fermentado, adicionado ou não de outras substâncias alimentícias,
obtidas por coagulação e diminuição do pH do leite, ou
reconstituído, adicionado ou não de outros produtos lácteos, cuja fermentação
se realiza com cultivos de ácido-lácticos elaborados com grãos de Kefir, Lactobacillus kefir, espécies dos gêneros Leuconostoc, Lactococcus e Acetobacter com produção de ácido
láctico, etanol e dióxido de carbono. Os grãos de Kefir
são constituídos por leveduras fermentadoras de lactose (Kluyveromyces marxianus) e leveduras não fermentadoras
de lactose (Saccharomyces omnisporus, Saccharomyces cerevisae e Saccharomyces exiguus), Lactobacillus casei, Bifidobaterium
sp e Streptococcus salivarius subsp thermophilus. Estabelece, ainda, que os microorganismos específicos devem ser viáveis, ativos e
abundantes no produto final durante seu prazo de validade com a contagem mínima
de 107 (ufc/g) de bactérias láticas totais
e de 104 (ufc/g) de leveduras específicas
e de 0,5 a 1,5 de Etanol (% v/m) [14].
A composição
nutricional do kefir
varia muito e é influenciada
pela composição do leite, a origem e a
composição dos grãos utilizados, o
tempo/temperatura de fermentação e
condições de armazenamento. No entanto, não
estão bem descritos na literatura. Quanto à
composição química, a umidade é a
predominante constituinte (90%), seguido de açúcares
(6%), gorduras (3,5%),
proteínas (3%) e cinzas (0,7%). Durante a
fermentação, as proteínas são
facilmente digeríveis devido à ação do
ácido, coagulação e proteólise. O Kefir apresenta aminoácidos ao leite utilizado como
substrato de fermentação. Os níveis de amoníaco, serina,
lisina, alanina, treonina, triptofano, valina,
lisina, metionina, fenilalanina e isoleucina são mais
elevados no kefir comparado com o leite não
fermentado. A lactose do leite é degradada a ácido durante a fermentação,
processo, que provoca a redução do pH e a
consistência. Aproximadamente 30% da lactose do leite é
hidrolisada pela enzima β-galactosidase,
transformando a lactose em glicose e galactose. Além disso, as bactérias
presentes no kefir convertem glucose em ácido
láctico. Neste contexto, o kefir é uma boa solução
para indivíduos intolerantes à lactose [15].
Contudo, o tratamento
à base de suplementação probiótica depende
principalmente da repopulação do trato
gastrointestinal, tornando necessário o uso continuo e de longo prazo destes
alimentos para que se tenha uma melhora realmente significativa nos sintomas de
intolerância [4].
Conclusão
A alteração do microbioma intestinal causada pela IL justifica a
suplementação probiótica como terapia auxiliar aliada
a dieta saudável e exclusão da lactose da dieta. Já existem evidências na
literatura que justificam o uso de algumas cepas específicas na terapia destes
pacientes. No entanto, mais estudos clínicos randomizados são necessários para
verificar as possíveis interferências do tratamento com probióticos
na saúde humana a longo prazo.
Referências
- Di Rienzo T, D'Angelo
G, D'Aversa F, Campanale
MC, Cesario V, Montalto
M, Gasbarrini A, Ojetti
V. From diagnosis to correct management. Eur Rev Med Pharmacol Sci 2013;17(Suppl2):18-25.
- Korterink JJ, Ockloen L, Benninga MA, tabbers MM, Hilbink M, Deckers-Kocken JM. Probiotics for childhood functional
gastrointestinal disorders: a systematic review and meta-analysis. Acta Paediatr 2014;103(4):365-72. https://doi.org/10.1111/apa.12513
- Ponte PR, Medeiros
PH, Havt A, Caetano JA, Cid DA,
Prata Mde M, Soares AM, Guerrant
RL, Mychaleckyj J Lima AÂ. Clinical evaluation, biochemistry and genetic polymorphism analysis for
the diagnosis of lactose intolerance in a population from
northeastern Brazil. Clinics 2016;71(2):82-9.
https://doi.org/10.6061/clinics/2016(02)06
- Almeida PC, Pinto
LPS, Baracho M, Simoni PU. O uso de probióticos para
o tratamento do quadro de Intolerância à Lactose. Revista Ciencia
& Inovação FAM 2015;2(1).
- Mathiús LA, Montanholi CHS, Oliveira LCN, Bernardes Daniele NA, Pires
A, Hernandez FMO. Aspectos atuais da intolerância à lactose. Revista
Odontológica de Araçatuba 2016;37(1):46-52.
- Misselwitz B, Deng Y, Dai N,
Fox M. Lactose intolerance in adults: biological mechanism and dietary
management. Nutrients 2015;7:8020-35. https://doi.org/10.3390/nu7095380.
- Flesch AGT, Poziomyck AK, Damin
DC. O
uso terapêutico dos simbióticos. ABCD Arq Bras Cir Dig 2014;27(3):206-9. https://doi.org/10.1590/s0102-67202014000300012
- Mattar R, Mazo DFC. Intolerância à lactose: mudança de paradigmas com
a biologia molecular. Revista da Associação Médica Brasileira 2010;56(2):230-6. https://doi.org/10.1590/s0104-42302010000200025
- Pereira JPF, Pereira
MCS, Brumano LP, Kamiyama
CM, Rodarte MP, Pinto MAO. Lácteos com baixo teor de
lactose: uma necessidade para portadores de má digestão da lactose e um nicho
de mercado. Rev Inst Latic Cândido Tostes 2012;67(389):57-65.
- Raizel R, Santini E, Kopper AM, Reis ADF.
Efeitos do consumo de probióticos, prebióticos e simbióticos para o organismo humano. Revista
Ciência & Saúde 2011;4(2):66-74.
- Doube G, Vandenplas
Y, Huy G. Probiotics: an update. J Pediatr
2015;91:6-21. https://doi.org/10.1016/j.jped.2014.08.005
- Staudacher H. Probiotics for lactose intolerance and irritable bowel syndrome. Br J of Community Nurs. 2015;20(Sup6a):S12-S14.
https://doi.org/10.12968/bjcn.2015.20.sup6a.s12
- Santos FL. Os
alimentos funcionais na mídia: quem paga a conta? In: Magalhães C, Brotas AMP, Bortoliero S, eds. Diálogos entre
ciência e divulgação científica: leituras contemporâneas. Salvador: Edufba; 2011. p.211-24.
- Brasil. Ministério da
Agricultura, Pecuária e Abastecimento. Resolução n° 46, de 23 de outubro de
2007. Padrões de Identidade e Qualidade (PIQ) de Leites Fermentados. Disponível
em: http://extranet.agricultura.gov.br/sislegis
- Rosa DD, Dias MMS, Grzes’kowiak ŁM, Reis AS, Conceição LL, Peluzio MCG. Milk kefir:
nutritional, microbiological and health benefits. Nutr
Res Rev 2017;30(1):82-96. https://doi.org/10.1017/s0954422416000275