REVISÃO
Efeito da
ingestão de canela como tratamento auxiliar não medicamentoso do diabetes
mellitus
Effect
of cinnamon intake as a complementary treatment of diabetes mellitus
Tamires Cássia de
Melo Souza*, Ana Carolina Pinheiro Volp, D.Sc.**
*Nutricionista, Mestranda em Saúde e Nutrição
pela Universidade Federal de Ouro
Preto (UFOP), **Nutricionista, professora adjunto da
Faculdade de Nutrição (FANUT) da Universidade Federal de Mato Grosso (UFMT),
Núcleo Permanente do Programa de Pós-Graduação em Saúde e Nutrição da
Universidade Federal de Ouro Preto (UFOP), Líder do Grupo de Pesquisa
cadastrado no Diretório do CNPq: Pesquisas em Nutrição Clínica, Compõe a
Comissão Nacional de Residência Multiprofissional em Saúde/ MEC
Endereço para correspondencia: Tamires Cássia de Melo Souza, Rua José
Raposo Jr., número 44/02 Mata Grande 35701-675 Sete Lagoas
MG, E-mail: tamirescmsouza@gmail.com; Ana Carolina Pinheiro
Volp: anavolp@gmail.com
Resumo
O objetivo
desse estudo é agrupar e avaliar dados relacionados à utilização da canela como
coadjuvante no tratamento do Diabetes
Mellitus (DM), verificando os possíveis benefícios e contraindicações,
dosagens recomentadas e forma de administração. Trata-se de uma
revisão sistemática, desenvolvida com artigos originais, publicados nos últimos
cinco anos. Foram encontrados 22 artigos nas bases de dados: 14 na PubMed e oito no Portal Capes. Após eliminar as referências
que se repetiam nas duas bases e aplicar os critérios de inclusão e exclusão, 7 artigos foram selecionados. Ao realizar a leitura, as
informações de cada artigo foram registradas em arquivos individuais. Foi possível perceber que o
potencial hipoglicemiante da canela está cada vez mais elucidado. As dosagens
utilizadas ainda diferem bastante em cada desenho metodológico. Em humanos,
dosagens entre 120 e 2000 g mostraram-se eficientes quando ofertadas
diariamente por um período de aproximadamente 90 dias. Doses únicas não
promoveram homeostase glicêmica.
Palavras-chave: diabetes, tratamento complementar, fitoterapia.
Abstract
The objective of this
study was to group and evaluate data related to the use of cinnamon as adjuvant
in the treatment of Diabetes Mellitus (DM), verifying the possible benefits and
contraindications, recommended dosages and forms of administration. This is a
systematic review, developed with original articles published in the last 5
years. We found 22 articles in the databases: 14 in PubMed and 8 in Portal
Capes. After eliminating the references that were repeated in the two databases
and applying the inclusion and exclusion criteria, 7 articles were selected. When reading, the information for each article was recorded in
individual files. It was possible to perceive that the hypoglycemic
potential of cinnamon is more and more elucidated. The dosages used still
differ greatly in each methodological design. In humans, dosages between 120
and 2000 g were effective when offered daily for a period of approximately 90
days. Single doses did not promote glycemic homeostasis.
Key-words: diabetes, complementary
therapy, phytotherapy.
Introdução
As últimas décadas
representaram para o Brasil importante período de transição nutricional,
decorrente de alterações no estilo de vida dos indivíduos [1], que
incluem mudança no perfil econômico e sociodemográfico, sedentarismo e
modificações no padrão alimentar relacionados à qualidade e quantidade da dieta
[2], tendo como característica redução do consumo de alimentos in natura e minimamente processados,
elevando-se a escolha por alimentos ultraprocessados [3], ricos em carboidratos
simples, gorduras e aditivos alimentares [4,5]. Essas modificações contribuíram
para aumentar a incidência das Doenças Crônicas (DC) [6,7].
Estima-se que mais de
9 milhões de brasileiros são portadores de Diabetes
Mellitus (DM) - uma DC que consiste no conjunto de distúrbios metabólicos
decorrentes da hiperglicemia por defeitos da ação e/ou secreção da insulina [8,9].
Pode ser classificado em DM tipo 1 (idiopático,
autoimune), DM tipo 2 (90 a 95% dos casos), DM gestacional e outros tipos
específicos de DM [9].
O DM é uma condição
que prejudica a qualidade de vida do indivíduo, agindo como agravante de saúde
e fator de risco para diversas comorbidades [10]. O tratamento pode ser
medicamentoso e deve englobar mudanças no estilo de vida, principalmente
relacionadas à prática de exercício físico e à qualidade da dieta [9].
Considerando que a melhora nos hábitos da dieta
representa parte fundamental no tratamento do DM [6,7], torna-se necessário buscar
alternativas que contribuam para a recuperação e manutenção da qualidade de
vida dos indivíduos em questão. A canela – especiaria amplamente utilizada na
culinária brasileira por acrescentar sabor a preparações doces e salgadas
[11-13] – possui elevada
concentração de compostos fenólicos e intensa atividade antioxidante [14].
Com isso, o objetivo desse estudo é agrupar e
avaliar dados relacionados à utilização da canela como coadjuvante no
tratamento do DM, verificando os possíveis benefícios e contraindicações,
dosagens recomendadas e forma de administração.
Material e
métodos
O presente trabalho
trata-se de uma revisão sistemática, desenvolvida com artigos originais,
publicados nos últimos 5 anos. A escolha deste recorte
temporal se deve à intenção de se realizar uma pesquisa com dados recentes e
aplicáveis, de acordo com o objetivo do estudo.
As bases eletrônicas
consultadas foram PubMed e Portal Capes. Para a busca
e seleção dos artigos, utilizaram-se palavras-chave nas
línguas português e inglês, sendo elas: diabetes mellitus, diabetes tipo 2 (type 2 diabetes), ingestão dietética (dietary intake), canela (cinnamon)
e níveis de glicose (glucose levels).
A busca se limitou aos artigos escritos em inglês e português.
Ao realizar a busca
inicial, os artigos foram selecionados sob os seguintes critérios de inclusão:
população (adultos e/ou idosos portadores de diabetes ou animais com diabetes
induzido), intervenção (administração de canela), desfecho (mensuração de
parêmetros relacionados ao DM) e tipo de estudo (experimentais). Artigos que
possuíam deficiências na descrição metodológica, que não contemplavam o objetivo
do estudo e que utilizavam a canela em conjunto com outras substâncias foram
excluídos.
Foram encontrados 22
artigos nas bases de dados: 14 na PubMed e 8 no Portal
Capes. Após eliminar as referências que se repetiam nas duas bases e aplicar os
critérios de inclusão e exclusão, 7 artigos foram
selecionados.
Após realizar a
leitura, as informações de cada artigo foram registradas em arquivos
individuais, contendo: autor, ano, local e tipo do estudo, objetivo, amostra,
intervenção, parâmetros de avaliação e resultados. Esses dados foram
apresentados no decorrer do texto e também no Quadro 1.
Resultados
e discussão
A canela (Cinnamomum
sp) é considerada uma especiaria rica em compostos
fenólicos e capaz de modular glicemia e perfil lipídico, além de possuir ação
antioxidante e antiinflamatória. Por isso tem sido amplamente utilizada em
estudos in vitro e in vivo, com o propósito de definir
dosagens seguras para sua utilização como coadjuvante no tratamento não
medicamentoso do DM tipo 2 [16,17].
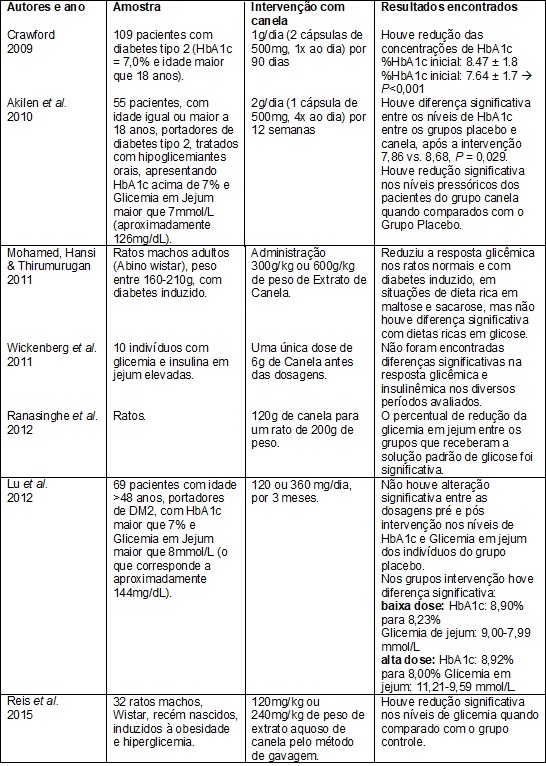
Com esse intuito, Crawford [18] realizou um estudo
com 109 pacientes com idade maior que 18 anos, portadores de DM tipo 2, com hemoglobina glicada (HbA1c) maior ou igual a 7%. Tais
pacientes foram distribuídos de maneira aleatória entre dois grupos: grupo
tratamento (n = 46) e grupo controle (n = 43). Após terem sido alocados nos
grupos, os indivíduos receberam orientações para manter o tratamento usual do
DM, sem modificações do padrão de vida. O grupo tratamento recebeu 1 g/dia de
canela em cápsula, por 90 dias, enquanto o grupo controle não recebeu nenhum
tipo de intervenção. Realizou-se dosagem sérica da HbA1c
em jeujum, em todos os pacientes, nos dias 0 e 90 e o valor considerado significativo foi a redução de pelo menos 0,5% nos
níveis de HbA1c. Ao comparar a dosagem inicial, realizada no tempo zero, com a
dosagem final, realizada no tempo 90, no grupo que recebeu a intervenção, o
autor encontrou uma redução significativa (P
< 0,001). Entretanto, não houve diferença significativa dos níveis de HbA1c entre o grupo controle e grupo intervenção.
Contrariando evidências anteriores, tal estudo verificou então que a
suplementação de canela em indivíduos portadores de DM tipo 2
parece ter efeito positivo na redução da concentração de HbA1c. Outros estudos
com dosagens semelhantes não tiveram o mesmo resultado como, por exemplo, Altschuler
[19] que ofertou uma vez ao dia, por 90 dias, 1 g de canela para adolescentes
com DM tipo 1. O próprio autor relata que a dosagem
pode ter sido insuficiente para o público em questão, já que ela havia sido
estabelecida em estudos prévios realizados exclusivamente com indivíduos portadores
de DM tipo 2. Blevins [20] também não encontrou
redução significativa nos níveis de HbA1c após a
suplementação de 500 mg de canela, duas vezes ao dia por 90 dias, em pacientes
com DM tipo 2. O autor coloca como possível justificativa o fato da dosagem ter
sido dividida ao longo do dia, reduzindo assim a concentração e
consequentemente a eficácia, visto que em estudos prévios a dosagem ofertada
havia sido maior.
No ensaio clínico randomizado, duplo cego, realizado por Akilen et al. [21], as cápsulas de canela também
foram distribuídas ao longo das refeições diárias, mas a dosagem ofertada foi
de 2 g/dia. Nesse estudo, 55 pacientes recrutados de três diferentes clínicas
do Reino Unido, especializadas em DM, com idade igual ou maior a 18 anos, portadores de DM tipo 2, tratados com
hipoglicemiantes orais, apresentando HbA1c acima de 7% e glicemia de jejum
maior que 7 mmol/l (aproximadamente 126 mg/dl), foram distribuídos de maneira
aleatória entre dois grupos (canela e placebo). Durante 12 semanas de
intervenção, todos os pacientes receberam orientações nutricionais com o
intuito de manter um padrão alimentar entre eles. Os indivíduos deveriam
ingerir 4 cápsulas de 500 mg cada (2 g/dia), de
placebo ou canela, no desjejum (500 mg), almoço (1000 mg) e jantar (500 mg).
As variáveis avaliadas nesse estudo, nos períodos pré e pós-intervenção,
foram: questionário estruturado (características sociodemográficas e de estilo
de vida – hábitos alimentares e de atividade física, tempo de diagnóstico do
DM), peso, estatura, circunferência da cintura, índice de massa corporal,
pressão arterial (PA), HbA1c, glicemia em jejum e
perfil lipídico. Ao comparar os resultados entre os grupos canela (GC) e
placebo (GP), após a intervenção, foi possível detectar diferença significativa
nos níveis de HbA1c e PA. Ao avaliar os dados basais e
pós-intervenção do GC, percebeu-se
redução significativa de peso,
CC, IMC e glicemia de jejum. Sendo assim, os autores concluíram
que a
suplementação surtiu efeito positivo e a dosagem
administrada foi bem tolerada.
Os autores reforçam que a distribuição das
cápsulas em três refeições diárias
constituiu importante estratégia antioxidante e
antiinflamatória e pode ter
sido essencial para os resultados alcançados. Entretanto, as
orientações
nutricionais realizadas com os pacientes podem ter tido
participação no
desfecho da pesquisa.
No estudo de Lu et al. [22], 66 pacientes com idade maior que 48 anos, portadores de DM2, com HbA1c maior que 7% e
glicemia de jejum maior que 8 mmol/l (o que corresponde a aproximadamente 144 mg/dl),
foram selecionados e distribuídos em 3 gupos: placebo (GP), baixa dose (BD) e
alta dose (AD). A intervenção foi realizada com tabletes de canela, contendo 60
mg cada. O GP recebia 2
tabletes com cor, tamanho e formato semelhantes aos tabletes de canela,
enquanto o BD recebia 2 tabletes de canela ao dia e o AD 6 tabletes de canela
ao dia. Os suplementos eram ingeridos imediatamente antes do café da manhã.
Todos os pacientes fizeram uso de glicazida 30 mg no
decorrer do estudo, para minimizar o erro causado por alterações relacionadas
ao tratamento medicamentoso. Os parâmetros avaliados forma HbA1c,
glicemia em jejum, colesterol total (CT), triacilgliceróis (TG), colesterol
LDL, HDL e transaminases hepáticas.
Não houve diferença significativa de sexo, idade
e dosagem medicamentosa entre os três grupos. Não houve alteração significativa
entre as dosagens pré e pós intervenção nos níveis de
HbA1c e glicemia de jejum dos indivíduos do GP. Já nos grupos intervenção (BD e
AD), houve redução significativa nos dois parâmetros conforme os valores
demonstrados no Quadro 1. Sendo assim, os dados
indicaram que a suplementação do extrato de canela, tanto em dosagens de 120 mg/dia quanto em 360 mg/dia pode reduzir significativamente
os níveis de HbA1c e glicemia de jejum nos pacientes diabéticos tipo 2. Além disso, não houve
alteração hepática nos pacientes suplementados com baixas ou altas doses,
conforme monitorado pelas dosagens de transaminases hepáticas. O desenho
metodológico do estudo foi bem elucidado e permitiu que a interpretação dos
resultados fosse condizente com a intenção de se avaliar a canela como
tratamento coadjuvante ao medicamentoso.
Em 2011, um grupo de pesquisadores da Índia
realizou um estudo experimental com ratos machos adultos do tipo Albino Wistar,
com peso entre 160-210 g, normais e com diabetes
induzido [23]. Para avaliar e comparar a resposta glicêmica
em situações diversas, o trabalho aconteceu em três etapas. Inicialmente, 18
ratos normais foram divididos em três grupos, cada um com seis animais. No
grupo 1 foi administrada uma solução de 2 g de
maltose, no grupo 2 além da mesma quantidade de maltose, administrou-se também
300 mg/kg de peso de extrato de canela e no grupo 3, a maltose foi associada a
5 mg/kg de peso de acarbose (substância hipoglicemiante). Esses
procedimentos foram repetidos da mesma maneira, substituindo-se maltose por
sacarose. Nos ratos com diabetes induzido, o procedimento foi semelhante,
entretanto, ocorreu com 24 ratos e 4 grupos (cada
grupo com 6 animais), onde o grupo adicionado recebeu 2 g de maltose ou
sacarose associada à uma dosagem de 600 mg/kg de peso de extrato de canela.
Além disso, foi realizada a administração de glicose em ratos normais e com
diabetes, associada à oferta de 300 mg/kg de peso de
extrato de canela.
Ainda sobre esse
estudo, os autores utilizaram a dosagem de glicemia como parâmetro de avaliação
em todos os grupos, nos tempos 0 (antes da
administração das substâncias), 30, 60 e 120 min (após a administração das
substâncias). Com a administração de maltose em ratos normais, os
níveis glicêmicos do grupo controle elevaram em média, 50 mg/dl
após 30 min da administração da solução. No grupo que recebeu o extrato de
canela, essa elevação foi de somente 9 mg/dl. Já nos
animais do grupo com diabetes induzido, os níveis glicêmicos aumentaram
aproximadamente 362 mg/dl do valor basal após 30
minutos da administração da maltose e decaiu logo em seguida. Entretanto, esse
aumento foi menor nos grupos que receberam o extrato de canela em diferentes
doses. Efeito similar de supressão foi observado no grupo que recebeu a
acarbose (hipoglicemiante). Comparado com o controle, a resposta glicêmica
reduziu 78,2% no grupo que recebeu 300 mg/kg de peso
do extrato, 86,3% no grupo que recebeu 600 mg/kg de peso do extrato e 54,2% no
grupo que recebeu 5 mg/kg de peso de acarbose. Os resultados também foram
significativos na resposta glicêmica estimulada pela sacarose, quando se
associou o extrato de canela (Quadro 1), mas não foi
possível detectar alterações significativas nos grupos que receberam a solução
de glicose.
Também em modelo animal, o estudo de Ranasinghe et al. [24] teve como objetivo avaliar os efeitos de curto prazo da
canela sobre a glicemia em jejum e no estado pós prandial (Fase I), bem como o
efeito de médio prazo da canela sobre o consumo de
alimentos, peso corporal, glicemia, controle glicêmico e lipídios (Fase II). Na Fase I, 32 ratos de 3 a 4 meses de idade foram divididos
em 4 grupos iguais, com 8 animais em cada um. Nos
grupos 1 e 2 avaliou-se os níveis de glicose em estado
não alimentado enquanto nos grupos 3 e 4 os níveis de glicose foram mensurados
após a ingestão oral de uma solução padrão de glicose (1,25 g/kg). Nos 4 grupos, os animais foram mantidos sem fornecimento da
dieta por 12 h no período noturno. Nos grupos 1 e 2, a
glicemia em jejum foi mensurada no momento 0 e foi administrado o extrato de
canela em um grupo e no outro, água destilada. Logo depois, realizou-se a
aferição das glicemias nos tempos 0.5, 1, 2, 4, 8, 12, e 24 h. Da mesma
maneira, as glicemias foram aferidas nos grupos 3 e 4.
Entretanto, no tempo 0 foi administrada uma solução de
glicose e no tempo 0.5, o extrato de canela em um grupo e água destilada no outro.
Em todos os grupos, os animais foram alimentados no tempo 24 e mantidos em
jejum por mais 12 h para que o ciclo se repetisse no dia anterior. Esse
protocolo foi realizado por três dias consecutivos e a média das glicemias em
jejum foram analisadas.
Na Fase II desse estudo,16 ratos Sprague-Dawley foram distribuídos em 4 grupos e
os animais foram mantidos em jejum por 12 h no período noturno e, em seguida, o
extrato de canela e a água destilada foram administrados. 30 min depois, a
dieta habitual era iniciada. Em todos os grupos, a dosagem sanguínea de
colesterol total , HDL, LDL , triglicérideos e HbA1c
foram realizada no dia 0 e no dia 30 a partir da veia da cauda dos ratos. A
glicemia de jejum e a glicemia pós prandial (2 h) foram mensuradas a partir do
dia 0, a cada cinco dias, até o dia 30. A água destilada e o extrato de canela
foram ofertados diariamente por um mês. Em relação aos resultados, entre os dois grupos que não receberam a solução de glicose, não houve
redução significativa no percentual de redução da glicemia em jejum quando se
comparava o grupo controle com o grupo intervenção. Entretanto, o percentual de
redução da glicemia em jejum entre os grupos que receberam a solução padrão de
glicose foi significativa. O grupo 4,
que recebeu o extrato de canela, sofreu um declínio mais rápido da glicemia
quando comparado com o grupo 3, que recebeu água destilada. O consumo alimentar
dos animais com diabetes induzido que participaram do grupo intervenção teve
redução significante (P < 0,001),
mas não foi possível observar esse mesmo desfecho nos animais do grupo
controle. Além disso, houve outros efeitos positivos como redução de LDL aterogênica e colesterol total.
No estudo de Reis et al. [25] 32 ratos machos,
Wistar, recém-nascidos, foram induzidos à obesidade e hiperglicemia e
posteriormente divididos aleatoriamente em quadro grupos de oito animais em
cada grupo. O estudo foi realizado por 30 dias, onde o grupo 1
(controle) recebeu água de torneira, o grupo 2 (tratamento medicamentoso) foi
tratado com metformina (500 mg/kg de peso/dia), o grupo 3 (tratamento teste 1)
teve a intervenção de 120 mg/kg de peso de extrato aquoso de canela e para o
grupo 4 (tratamento teste 2), foi ofertado 240 mg/kg de peso de extrato aquoso
de canela, pelo método de gavagem. Após a análise, foi possível notar que os
grupos 2, 3 e 4 produziram diferença significativa (p < 0,05) entre os
níveis de glicemia quando comparados ao grupo 1. Ou
seja, o tratamento com o extrato aquoso de canela evidenciou uma diminuição da
glicemia de jejum em doses de 120 mg/ml e 240 mg/ml e
esta diminuição da glicemia foi similar à provocada pelo uso de metformina, porém
o tratamento com o extrato aquoso não evidenciou um efeito do peso dos animais
induzidos à obesidade.
Diferente do contexto da ação da canela a médio
e longo prazo, um estudo cross-over
realizado por Wickenberg et al. [26], consistiu em avaliar, a curto
prazo, possíveis alterações da concentração de glicose e insulina de dez
indivíduos, antes e após a ingestão oral de uma substância padrão composta de
glicose (75 g) e de lactose (6,9 g) e do extrato de canela. Todos os indivíduos
passaram por dois momentos de intervenção, em que recebiam a solução em
conjunto com 15 cápsulas de 400 mg de canela (6 g no total)
e, em outro momento, recebiam a mesma solução em conjunto com 15 cápsulas de
placebo. Os testes eram feitos no tempo basal (antes de receber a solução e os
suplementos) e, em seguida, nos tempos de 15, 30, 45, 60, 90,
120, 150 e 180 min. Os resultados encontrados não foram favoráveis, sugerindo
que a administração da canela não promoveu resposta imediata sobre a resposta
glicêmica e insulinêmica nos indivíduos. Tal constatação contribuiu para
elucidar a melhor forma de administração dessa substância, já que, de acordo
com os demais resultados apresentados, ofereceu uma resposta favorável ao ser
utilizada de maneira frequente.
Para aprimorar os
estudos sobre essa especiaria, é necessário levar em conta as espécies e a
composição de cada uma, já que os benefícios estão associados à presença dos
compostos bioativos e, portanto, a variação deles interfere diretamente na
determinação da eficácia e da toxicidade [27,28].
Quadro 1 – Sumarização dos resultados.
Conclusão
Com base nos trabalhos encontrados, é possível
perceber que o potencial hipoglicemiante da canela está cada vez mais elucidado.
As dosagens e espécies utilizadas ainda diferem bastante em cada desenho
metodológico, mas é importante ressaltar que nenhum dos trabalhos obteve
resultados que evidenciassem sinais de toxicidade com a suplementação em
questão. Em humanos, dosagens entre 120 e 2000 g mostraram-se eficientes, desde
que ofertadas diariamente por um período de aproximadamente 90 dias. Doses
únicas não promoveram homeostase glicêmica.
Sendo assim, pode-se dizer que o uso da canela pode
contribuir para a redução de marcadores clínicos e bioquímicos de indivíduos
portadores de DM, como coadjuvante do tratamento medicamentoso e, pelo fato de
agregar sabor à arte culinária e ter custo acessível, é uma especiaria viável
de ser incluída na alimentação diária da população brasileira.
Referências
- Souza EB. Nutritional transition in Brazil:
Analysis of the main factors. Cadernos UniFOA 2010. p.
49-53. http://web.unifoa.edu.br/cadernos/edicao/13/49.pdf
- Malta DC
et al. Prevalência de fatores de risco e proteção para doenças crônicas não
transmissíveis em adultos: estudo transversal, Brasil. Epidemiol Serv Saúde 2013;22(3): 423-34. http://scielo.iec.pa.gov.br/pdf/ess/v22n3/v22n3a07.pdf
- Bielemann RM et al. Consumo de alimentos ultraprocessados e impacto na
dieta de adultos jovens. Rev Saúde Pública 2015;49:1-10. http://www.scielo.br/pdf/rsp/v49/pt_0034-8910-rsp-S0034-89102015049005572.pdf
- Polônio MLT, Peres F. Consumo de aditivos alimentares e efeitos à saúde:
desafios para a saúde pública brasileira. Cad Saúde Pública 2009;25(8):1653-66. http://www.scielo.br/pdf/csp/v25n8/02.pdf
- Albuquerque MV et al. Educação alimentar: uma proposta de redução do
consumo de aditivos alimentares. Química nova na escola
2012;34(2):51-7. http://qnesc.sbq.org.br/online/qnesc34_2/02-QS-33-11.pdf
- Malta DC
et al. Mortalidade por doenças crônicas não
transmissíveis no Brasil e suas regiões, 2000 a 2011. Epidemiologia
e Serviços de Saúde 2014;23(4):599-608. http://www.scielosp.org/pdf/ress/v23n4/2237-9622-ress-23-04-00599.pdf
- Silva JVF
et al. A relação entre o envelhecimento populacional e as doenças crônicas não
transmissíveis: sério desafio de saúde pública. Ciênc Biol e da Saúde 2015; 2,
n.3: p. 91-100. https://periodicos.set.edu.br/index.php/fitsbiosaude/article/viewFile/2079/1268
- Iser
BPM et al . Prevalência de diabetes autorreferido no Brasil: resultados da
Pesquisa Nacional de Saúde 2013. Epidemiol Serv Saúde 2015;24(2):305-14.
http://www.scielosp.org/pdf/ress/v24n2/2237-9622-ress-24-02-00305.pdf
- Sociedade Brasileira de Diabetes. Diretrizes da Sociedade
Brasileira de diabetes 2015/2016. http://www.diabetes.org.br/sbdonline/images/docs/DIRETRIZES-SBD-2015-2016.pdf
- Zulian LR
et al. Qualidade de vida de pacientes com diabetes utilizando o instrumento
Diabetes 39 (D-39). Rev Gaúcha Enferm 2013;34(3):138-46. http://www.scielo.br/pdf/rgenf/v34n3/a18v34n3.pdf
- Gruenwald J, Freder J, Armbruester N. Cinnamon and Health. Food Sci Nutr
2010;50(9):822-834. https://www.ncbi.nlm.nih.gov/pubmed/20924865
- Jakhetia V et al. Cinnamon: a pharmacological review. J Adv Sci Res 2010;19-23. http://www.sciensage.info/journal/1310494005JASR_1008103.pdf
- Riche DM, Pharm D. Impracticality of cinnamon supplements in diabetes.
Pharmacotherapy 2007;27:48-50. https://www.ncbi.nlm.nih.gov/pubmed/17381386
- Shan B et al. Antioxidant capacity of 26 spice exctract and
characterization of their phenolic constituents. J Agric Food Chem
2005;53:7749-7759. https://www.ncbi.nlm.nih.gov/pubmed/16190627
- INSA.
Tabela de Composição de Alimentos Portuguesa 1 ed.2006.
- Moreira AVB, Mancini Filho J.
Antioxidant activity of mustar d, cinnamon and anise in lipidic and aqueous
systems. Nutrire: 2003;25:31-46. http://sban.cloudpainel.com.br/files/revistas_publicacoes/53.pdf
- Leach MJ, Kumar S. Cinnamon for diabetes
mellitus. The Cochrane Library 2012. https://www.ncbi.nlm.nih.gov/pubmed/22972104
- Crawford P. Effectiveness of cinnamon for
lowering hemoglobin A1C in patients with type 2 diabetes: a randomized,
controlled trial. J. Am Board Fam Med 2009;22:507-12.
http://www.jabfm.org/content/22/5/507.long
- Altschuler JA et al. The effect of cinnamon on A1C among adolescents
with type 1 diabetes. Diabetes Care 2007;30:813-6. http://care.diabetesjournals.org/content/31/1/41
- Blevins SM et al. Effect of cinnamon on glucose and lipid levels in non
insulin-dependent type 2 diabetes. Diabetes Care 2007;30:2236-7. https://www.ncbi.nlm.nih.gov/pubmed/17563345
- Akilen R et al. Glycated haemoglobin and blood pressure-lowering effect
of cinnamon in multi-ethnic type 2 diabetic patients in the UK: a randomized,
placebo-controlled, double-blind clinical trial. Diabet Med 2010;27:1159-67. https://www.ncbi.nlm.nih.gov/pubmed/20854384
- Lu T et al. Cinnamon extract improves fasting blood glucose and
glycosylated hemoglobin level in Chinese patients with type 2 diabetes. Nutr
Res 2012;32:408-12. https://www.ncbi.nlm.nih.gov/pubmed/22749176
- Mohamed SSH, Hansi PD, Thirumurugan K. Cinnamon extract inhibits
α-glucosidase activity and dampens postprandial glucose excursion in diabetic
rats. Nutr Metab 2011;8. https://www.ncbi.nlm.nih.gov/pubmed/21711570
- Ranasinghe P et al. Effects of Cinnamomum zeylanicum (Ceylon cinnamon)
on blood glucose and lipids in a diabetic and healthy rat model. Pharmacognosy
Res 2012473-9. https://www.ncbi.nlm.nih.gov/pubmed/22518078
- Reis FOV,
Tourino JG, Ferreira G. Efeito do tratamento crônico com extrato aquoso de
cinnamomum zeylanicum em ratos induzidos à obesidade e hiperglicemia. Rev
Ciências em Saúde 2015;5. http://200.216.240.50:8484/rcsfmit/ojs-2.3.3-3/index.php/rcsfmit_zero/article/view/335/257
- Wickenberg J et al. Ceylon cinnamon does not
affect postprandial plasma glucose or insulin in subjects with impaired glucose
tolerance. Br J Nutr 2012;107(12):1845-9.
https://www.ncbi.nlm.nih.gov/pubmed/21929834
- Prasad KN et al. Flavonoid contents and antioxidant activities from
Cinnamomum species. Innov Food Sci Emerg
Technol 2009;10:627-32. http://www.sciencedirect.com/science/article/pii/S1466856409000605
- Wang R, Wang R, Yang B. Extraction of essential oils from five cinnamon leaves and
identification of their volatile compound compositions. Innov Food Sci Emerg Technol 2009;10:289-92. http://www.sciencedirect.com/science/article/pii/S1466856408001240