REVISÃO
A
obesidade e a ação dos prebióticos, probióticos e simbióticos na microbiota intestinal
The obesity and the action of prebiotics, probiotics and symbiotics in intestinal microbiota
Michely Lopes Nunes*, Marilene Porawski**
*Nutricionista,
Doutoranda do Curso de Pós Graduação Medicina: Hepatologia da Universidade
Federal de Ciências da Saúde UFCSPA, Porto Alegre/RS, **Professora adjunta de
Fisiologia do Departamento de Ciências Básicas da Saúde e orientadora do PPG
Medicina, Hepatologia e do PPG Biociências da Universidade Federal de Ciências
da Saúde de Porto Alegre (UFCSPA), Porto Alegre/RS
Recebido 14 de maio
de 2017; aceito 15 de setembro de 2017
Endereço
para correspondência:
Michely Lopes Nunes, Rua Sarmento Leite, 245, 90050-350 Porto Alegre RS,
E-mail: mednutry@gmail.com, Marilene Porawski: marilenep@ufcspa.edu.br
Resumo
A crescente
prevalência da obesidade e suas comorbidades apresenta-se como um dos principais problemas de saúde pública atualmente. O
intestino é um órgão complexo que tem sido cada vez mais estudado na obesidade
devido à sua capacidade para sinalizar vias envolvidas na fisiopatologia da
doença. Objetivo: Esclarecer os
principais efeitos de prebióticos e probióticos nas alterações metabólicas e da
microbiota intestinal na obesidade. A microbiota intestinal pode ser modulada
pela dieta e atuar no controle da ingestão alimentar interagindo com receptores
e enzimas que interferem nas alterações metabólicas decorrentes da obesidade e
na modulação da resposta inflamatória. Pesquisas com animais mostraram
resultados positivos do uso de prebióticos e probióticos como coadjuvantes no
tratamento da obesidade, contudo, os resultados com humanos ainda apresentam
dados controversos. Portanto a implementação de tal estratégia provavelmente
vai abrir o caminho para alimentação personalizada e/ou estratégias
terapêuticas inteligentes (incluindo a manipulação da
microbiota intestinal através da concepção de novos probióticos, prebióticos e
simbióticos para reverter problemas causados pela obesidade.
Palavras-chave: prebioticos,
probioticos, obesidade, microbiota intestinal.
Abstract
The growing prevalence of obesity and its comorbidities is currently one
of the major public health problems. The intestine is a complex organ that has
been increasingly studied in obesity because of its ability to signal pathways
involved in the pathophysiology of the disease. Objective: to clarify the main effects of prebiotics and probiotics
on intestinal microbiota and metabolic changes in obesity. Animal studies
showed positive results in the use of prebiotics and probiotics as complement
in the treatment of obesity, however, the results with humans still feature
controversial data. Therefore implementing such strategies will probably open
the way for personalized nutrition and/or clever therapeutic strategies
(including manipulation of the intestinal microbiota through the design of new
probiotics, prebiotics and symbiotics to reverse
problems caused by obesity.
Key-words: prebiotics,
probiotics, obesity, intestinal microbiota.
Introdução
A Organização Mundial
de Saúde aponta a obesidade como um dos maiores problemas de saúde pública no
mundo. A projeção é que, em 2025, cerca de 2,3 bilhões de adultos estejam com
sobrepeso e mais de 700 milhões, obesos [1]. A obesidade é causa de
incapacidade funcional, de redução da qualidade de vida, redução da expectativa
de vida e aumento da mortalidade. Condições crônicas, como doença renal,
osteoartrose, câncer, diabetes tipo 2, apneia do sono,
doença hepática gordurosa não alcoólica (DHGNA), hipertensão arterial e doenças
cardiovasculares estão diretamente relacionadas com incapacidade funcional
e com a obesidade [2].
De acordo com
Pistelli e Costa [3], o desenvolvimento da obesidade nos seres humanos pode ser
influenciado pelas proporções relativas de dois filos principais de bactérias
da microbiota intestinal, os bacteroidetes e os firmicutes, sugerindo que a
atividade metabólica deles pode facilitar a extração e estocagem das calorias ingeridas.
A proporção de bacteroidetes é menor em indivíduos obesos do que em magros.
Estudos com o uso de
animais livres de germes e o transplante de microbiota mostraram que a
microbiota intestinal pode desempenhar um papel importante no desenvolvimento
da obesidade e distúrbios metabólicos associados. Nos seres humanos, observa-se diferenças na composição da microbiota
correlacionadas com mudanças na atividade metabólica e na expressão de genes
entre indivíduos obesos e magros, sugerindo uma contribuição da microbiota
intestinal para esses fenótipos [4]. Estudos observacionais e retrospectivos
enfatizam que a microbiota intestinal e seus metabólitos estão alterados no
estado de obesidade [5]. microbiota intestinal é
complexa e parece afetar o equilíbrio metabólico do hospedeiro, modulando a
absorção de energia, a motilidade intestinal, o apetite, o metabolismo da
glicose e dos lipídeos, bem como o armazenamento de gordura hepática. Um
comprometimento do equilíbrio delicado entre a microbiota intestinal e o
sistema imunológico do hospedeiro pode provocar a translocação bacteriana e o
desenvolvimento de endotoxemia metabólica, levando à inflamação sistêmica e à
resistência à insulina [6].
Pesquisa de Jumpertz et al. [7] mostrou que a disponibilidade
de diferentes nutrientes provoca mudanças na composição da microbiota
intestinal no mecanismo de absorção dos nutrientes Nesse sentido, a microbiota
tanto de humanos como de animais, pode ser modificada através da dieta, de modo
que a ingestão de calorias em excesso promove a proliferação de bactérias do
filo firmicutes, os quais permitem a extração de nutrientes com maior
eficiência. Outro estudo mostrou que uma dieta hiperlipídica e pobre em fibras
está associada a alterações na microbiota do intestino
distal de camundongos, sugerindo que a atividade metabólica dos
micro-organismos intestinais pode gerar derivados lipopolissacarídeos que
atuariam como um gatilho no desencadeamento da resposta inflamatória, contudo
essas alterações metabólicas podem ser reversíveis [8].
Diante das alterações
metabólicas e das modificações na microbiota intestinal que ocorrem em
indivíduos obesos, a utilização de probióticos pode
ser uma estratégia coadjuvante na prevenção e tratamento da obesidade [9]. Os
probióticos são definidos como micro‑organismos vivos que, quando
ingeridos em quantidades adequadas, exercem efeitos benéficos ao organismo. Os
gêneros Lactobacillus e Bifidobacterium são os mais utilizados
na elaboração de probióticos. Eles são indicados para o tratamento de diversas
doenças, como inflamações, desordens alérgicas e diarreia [10].
Os probióticos agem
no intestino e estimulam o sistema imunológico o que leva a uma redução nos
organismos patogênicos presente na microbiota. Esse fenômeno traz benefícios
para o ecossistema intestinal porque reduz a incidência e a gravidade da
diarreia. O uso de probióticos reduz o risco de câncer de cólon em modelos
animais, provavelmente por sua capacidade de suprimir a atividade de certas
enzimas bacterianas que podem aumentar os níveis de pró-carcinógenos, mas isto
não foi provado em humanos [11].
Animais obesos,
induzidos por dieta e tratados com probióticos mostraram redução do ganho de
peso e na acumulação de gordura corporal, bem como diminuição da insulina
plasmática, leptina, colesterol total e biomarcadores de toxicidade hepática. Observou-se alterações transcricionais no tecido adiposo e
no fígado. No tecido adiposo, a expressão dos genes pró-inflamatórios (TNFα,
IL6, IL1β e MCP1) foi diminuida em ratos que receberam tratamento
probiótico. No fígado, a expressão dos genes relacionados com a oxidação de
ácidos graxos (PGC1a, CPT1, CPT2 e ACOX1) foi
aumentada em animais que receberam tratamento probiótico. A microbiota
intestinal de animais obesos induzidos pela dieta parece ser modulada em ratos
que recebem tratamento probiótico [12].
Microbiota,
obesidade e modulação da resposta imune inflamatória
Estudos recentes têm
associado a microbiota intestinal ao estado
inflamatório que ocorre na obesidade, sugerindo que alterações na sua
composição e na sua diversidade em obesos podem desempenhar papel importante no
desenvolvimento de desordens metabólicas [13].
A absorção de
nutrientes é diferente para cada pessoa, dependendo da sua microbiota
intestinal, este mecanismo de absorção e armazenamento determina a quantidade
de calorias armazenadas pelos indivíduos, pois a microbiota está envolvida no
aumento da taxa metabólica, modulação da lipogênese e no aumento da captação de
monossacarídeos [14].
O termo disbiose
descreve qualquer desequilíbrio significativo no ecossistema microbiano
intestinal, isto inclui o crescimento excessivo ou o esgotamento de uma espécie
comensal particular, a família ou o filo de bactérias, ou um deslocamento
geográfico de uma ou mais espécies (isto é, bactérias do cólon que colonizam o
intestino delgado) [15]. A disbiose do intestino pode ser um dos principais desencadeadores
de uma ampla gama de distúrbios gastrointestinais e sistêmicos, isso ocorre
quando os adipócitos liberam citocinas pró-inflamatórias, entre elas,
interleucinas (IL-1, IL-6) e fator de necrose tumoral alfa (TNF-α), sendo
que a expressão gênica aumenta conforme ocorre hipertrofia das células
epiteliais. A gordura saturada induz a liberação de prostaglandinas,
principalmente de série par como a PGE2, oriundas da biossíntese do ômega. O
excesso do consumo de ômega-6 também está associado à resposta imune através
dos efeitos sobre o receptor do tipo toll
like, os TLR-4, que ao ser ativado induz a sinalização das proteínas da via
das MAP quinases e, por fim, pode ativar o fator de transcrição NF-kB,
relacionado com a expressão de mais de 200 genes [16].
Recentes estudos têm
demonstrado a participação de receptores de interleucina 1/TLR, como o receptor
TLR5, na inflamação [17]. O TLR5 é uma proteína que atua na resposta
imunológica através do reconhecimento de patógenos associados a bactérias. A interação
entre microbiota e TLR5 é fundamental para a homeostase intestinal, pois a
maioria dos micro-organismos do intestino tem alta afinidade com o TLR5 e essa
reação emite sinais que regulam o funcionamento intestinal, portanto
deficiências nesse receptor levam ao início da cascata inflamatória, com
transcrição de citocinas e mediadores inflamatórios como o NF-kB
[18].
Estudos, mostram que
camundongos geneticamente deficientes em toll-like receptor 5
(TLR5) exibem hiperfagia e desenvolvem características da síndrome metabólica,
incluindo hiperlipidemia, hipertensão, resistência à insulina e aumento da
adiposidade. A restrição alimentar impediu a obesidade, mas não a resistência à
insulina, nos camundongos deficientes em TLR5. Estes resultados suportam a
visão emergente de que a microbiota intestinal contribui para a doença
metabólica e sugerem que o mau funcionamento do sistema imune inato pode
promover o desenvolvimento da síndrome metabólica [18,19].
O que
são prebióticos e probióticos?
O termo prebiótico
foi empregado em 1995, para designar ingredientes nutricionais não digeríveis
que afetam o hospedeiro estimulando seletivamente o crescimento e a atividade
de uma ou mais bactérias benéficas do cólon, melhorando a saúde do seu hospedeiro
[20].
Os prebióticos não
são metabolizados ou absorvidos durante a sua passagem pelo trato digestivo
superior; devem servir como substrato a uma ou mais bactérias intestinais
benéficas (algumas espécies de Lactobacillus
e Bifidobacterium) e, desta maneira,
reduzem a quantidade de outras bactérias como Bacteroides, Clostridium e
Coliformes [21]. Possuem a capacidade de alterar a microbiota intestinal de
maneira favorável à saúde do hospedeiro [22].
Alguns açúcares
absorvíveis ou não, fibras, álcoois de açúcares e oligossacarídeos estão dentro
deste conceito de prebióticos. Destes, os oligossacarídeos - cadeias curtas de
polissacarídeos compostos de 3 a 10 açúcares simples ligados entre si, têm recebido mais atenção pelas inúmeras propriedades
prebióticas atribuídas a eles. Os frutooligossacarídeos são polissacarídeos que
têm demonstrado bons efeitos prebióticos, podem ser obtidos
na forma natural em sementes e raízes de alguns vegetais como a chicória,
cebola, alho, alcachofra, aspargo, cevada, centeio, nas leguminosas
como: grãos de soja, grão-de-bico, feijões, lentilha, ervilha. Também, podem
ser extraídos por cozimento ou através de ação enzimática ou alcoólica. Há,
também, os oligossacarídeos sintéticos obtidos através da polimerização direta
de alguns dissacarídeos da parede celular de leveduras ou fermentação de
polissacarídeos. Estudos mostram que os oligossacarídeos sintéticos têm
apresentado melhores resultados como prebióticos e menos efeitos colaterais
[6,23].
Desta maneira, os
prebióticos agem intimamente relacionados aos probióticos, constituem o
"alimento" das bactérias. O uso de prebióticos em associação como os
probióticos apresentam ações benéficas superiores aos antibióticos. São
promotores de crescimento, não deixam resíduos nos produtos de origem animal e
não induzem o desenvolvimento de resistência às drogas, por serem produtos
essencialmente naturais [24].
Como já mencionado,
as substâncias prebióticos agem alimentando e estimulando o crescimento de
diversas bactérias intestinais benéficas, cujos metabólitos atuam também
reduzindo o pH através do aumento da quantidade de
ácidos orgânicos, presentes no ceco. Por outro lado, atuam bloqueando os sítios
de aderência principalmente a D-manose imobilizando e reduzindo a capacidade de
fixação de algumas bactérias patogênicas na mucosa intestinal [25]. Especula-se
que os oligossacarídeos possam atuar também estimulando o sistema imune,
através da redução indireta da translocação bacteriana [26].
Probióticos
O termo probiótico
foi proposto pela primeira vez em 1965. Atualmente utiliza-se o termo
probiótico para designar suplemento alimentar composto de cultura pura ou
composta de microorganismos vivos, com a capacidade de se instalar e proliferar
no trato intestinal, com a ação de promotores de crescimento, beneficiando a
saúde do hospedeiro pelo estímulo das propriedades existente na microflora
intestinal [27]. Segundo a Organização de Alimentação e Agricultura das Nações
Unidas e a Organização Mundial de Saúde, probióticos são microrganismos vivos
que, quando administrados em quantidades adequadas conferem um benefício à
saúde do hospedeiro [28].
Existe uma variedade
de microrganismos utilizados como probióticos, que podem ser classificados da
seguinte forma: probióticos bacterianos e não bacterianos. Com a exceção de
certas leveduras e probióticos fúngicos, a maioria dos microrganismos
utilizados são bactérias. Exemplos de probióticos bacterianos são várias
espécies de Lactobacillus [29], Bifidobacterium [30,31], Bacillus [32] e
Enterococcus [33]. Os probióticos não bacterianos (levedura ou fungos) incluem Aspergillus oryzae [34], Candida pintolopesii [35], Saccharomyces bourlardii [36], e Saccharomyces cerevisiae [37].
Os probióticos podem
conter bactérias totalmente conhecidas e quantificadas ou, culturas bacterianas
não definidas. Enterococcus, Bacteroides, Eubacterium e especialmente Lactobacillus
e Bifidobacterium estão presentes em
todas as culturas. Por outro lado, não se conhece ainda a composição ideal que
melhor estimula as propriedades probióticas in vivo. Produtos com culturas não
definidas têm melhor ação probiótica que as culturas definidas [38].
Os lactobacilos são
bactérias gram-positivas e anaeróbicas facultativas, predominantes no intestino
delgado. Entre suas espécies pode-se citar os Lactobacillus casei, Lactobacillus
rhamnosus, Lactobacillus acidophilus. Os lactobacilos inibem a proliferação
de microrganismos patogênicos, pela competição com locais de ligação de
nutrientes e produzem ácidos orgânicos, que reduzem o pH
intestinal, retardando o crescimento de bactérias patogênicas [36].
Os probióticos fazem
parte dos chamados Alimentos Funcionais, cujo principal alvo é a mucosa
intestinal [40]. Diferentes probióticos são capazes de induzir respostas
pró-inflamatórias, anti-inflamatórias ou secretórias que podem inibir a
carcinogênese. Vários estudos têm comprovado a eficácia dos probióticos na
prevenção e tratamento de diarréia associada aos antibióticos [43].
Qual é
a quantidade recomendada de probióticos?
O Grupo de Trabalho
Conjunto da Organização das Nações Unidas para a Alimentação e Agricultura
(FAO) e da Organização Mundial de Saúde (OMS) definiu os probióticos como
microrganismos vivos que, quando administrados em quantidades adequadas,
conferem um benefício para a saúde do hospedeiro [40]. Esta definição é
amplamente aceita e adotada pela Associação Científica Internacional de
Probióticos e Prebióticos [41]. Os diferentes probióticos são estudados e comercializados
na forma de preparações contendo um único ou uma combinação de microrganismos.
O probiótico deve se apresentar viável na preparação e manter essa viabilidade
no ecossistema digestivo, condição indispensável para a sua atuação [42].
A Legislação
Brasileira define que a quantidade mínima viável para o probiótico deve estar
situada na faixa de 108 a 109 UFC (unidades formadoras de
colônias) na porção diária do alimento para ser de importância fisiológica para
o consumidor [41]. O consumo de quantidades adequadas dos microrganismos
probióticos desejados nos bioprodutos (109 a 1010
UFC/100g de produto) é suficiente para a manutenção das concentrações ativas
fisiologicamente (quantidade intestinal de 106 a 107
UFC/g) in vivo [41]. Para um produto ser considerado como probiótico é
necessário conter uma quantidade mínima de 108
unidade formadora de colônia (UFC) que cheguem vivas até o intestino.
Vale ressaltar que tudo que consumimos tem que passar pela boca, esôfago e
estômago para chegar até o intestino, e lembre-se também que o nosso estômago
tem o pH ácido, fator limitante para a chegada dos
microorganismos vivos até o intestino. Considerando isso, a
quantidade de microorganismos nos produtos têm que ser superior a 1x108
= 100.000.000 UFC, pois alguns não resistiram ao pH ácido do estômago. Para
proteger os microorganismos da ação ácida do estomago é usado um carboidrato,
que pode ser açúcares ou fibras, chamados de prebióticos, para envolver essas
bactérias e impedir que o ácido clorídrico do estômago degrade as.
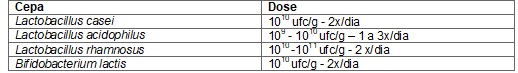
Cepa por
dose para indivíduo saudável
Quadro
1 - Probióticos mais utilizados conforme
(ANVISA/OMS).
A imunorregulação
induzida pelos probióticos pode atuar a nível local e sistêmico. A nível local,
promove a inibição da adesão de microrganismos patogênicos, a atividade anti-microbiana, a produção de mucinas, o reforço da função
de barreira intestinal e a produção de citocinas pró-inflamatórias. A nível
sistêmico, regula a proliferação de linfócitos B e
linfócitos T e a produção de imunoglobulinas. Sugerem um efeito positivo na
modulação da microbiota intestinal na prevenção e no tratamento de doenças
metabólicas relacionadas com a obesidade [48]. Nesse contexto, Aguilar, Esparza
e Fragoso [43] encontraram redução nos níveis de coliformes totais e aumento
nos níveis de lactobacilos no trato gastrointestinal de ratos Zucker obesos
após suplementação com o probiótico BIO-L6®, que continha 10 cepas do gênero
Lactobacillus, durante nove semanas, mostrando a capacidade de modulação
benéfica da microbiota intestinal. Além disso, encontraram redução de
marcadores inflamatórios como fator de necrose tumoral α (TNF-α) e
interleucinas 4, 10 e 11. Esse mecanismo pode configurar-se efeito benéfico ao
combater o estado de inflamação associado à obesidade.
Kadooka et al. [44], utilizando Lactobacillus casseri LG2055 com
aproximadamente 5x1010 CFU/100g/dia via oral em indivíduos obesos,
verificaram que os probióticos comparados ao placebo, determinaram redução de
adiposidade visceral, além de redução de peso corporal e circunferência da
cintura [50].
Neste estudo com
ratos obesos e diabéticos induzidos por dieta (Ob/ob) alimentados com dieta
hiperlipidica e suplementada com oligofrutose (0,3 g/rato/dia) adicionada em
água, a suplementação prebiótica diminuiu filos
Firmicutes e aumentou Bacteroidetes. Além disso, os prebióticos melhoraram a
tolerância à glicose, aumentaram o número de células L e os parâmetros
associados (expressão do ARNm do proglucagon
intestinal e níveis plasmáticos de peptídeo-1 semelhante ao glucagon) e
reduziram o desenvolvimento de massa gorda, estresse oxidativo e inflamação de
baixo grau. Em ratos alimentados com dieta hiperlipidica, o tratamento
prebiótico melhorou a sensibilidade à leptina, assim como os parâmetros
metabólicos [45].
Nguyen et al. [46] utilizaram um suplemento de
plantarum PH04 em ratos hipercolesterolêmicos na quantidade de 107
UFC/g/rato/dia, durante 14 dias. Comparado com um grupo controle, o colesterol
sérico e os triglicerídeos foram respectivamente 7 e
10% menores no grupo alimentado com L.
plantarum PH04 sem diferenças significativas no peso corporal, no índice de
peso visceral e translocação bacteriana entre dois grupos. Os resultados
indicaram que L. plantarum PH04
poderia ser eficaz como um probiótico com atividades de redução do colesterol.
Em outro estudo [47]
com ratos alimentados com dieta hiperlipidica e suplementaram Lactobacillus plantarum LS/07 e
Lactobacillus plantarum Biocenol LP96, as cepas probióticas foram
proporcionadas em dose 3 × 109 CFU de cepas/1 ml, e
cada rato recebeu aproximadamente 1,5 x 109 CFU de lactobacilos via
oral. Os resultados mostram que Lactobacillus
plantarum LS/07 reduziu o colesterol sérico e o colesterol LDL, mas o Lactobacillus plantarum Biocenol LP96
diminuiu os triglicéridos e VLDL. Ambas as cepas probióticas reduziram os
ácidos biliares totais no soro [47].
Assim a definição do
efeito dos prebióticos ainda é algo a ser explorado, visto que a maioria dos
estudos existentes apresenta fatores de confusão e/ou baixa comparabilidade por
lançarem mão de diferentes modelos experimentais, e diferentes métodos de
análise, espécie estudada (maioria dos estudos feitos em animais), falta de
padronização dos graus de adiposidade corporal, da idade dos participantes e da
dieta empregada.
Conclusão
A administração de
probióticos e prebióticos tem sido amplamente utilizada para manipular a
microbiota intestinal. No entanto, apesar de vários estudos relatarem
resultados promissores, ainda não há evidência clínica sólida recomendando seu
uso terapêutico para doenças metabólicas. Também faltam estudos clínicos de longo
prazo. Portanto, estudos adicionais e ensaios clínicos randomizados, usando
probióticos e prebióticos, são necessários para entender melhor seu impacto na
manipulação da microbiota intestinal. Os estudos sobre a influência de
nutrientes específicos e/ou alimentos funcionais para tratar a obesidade estão
no início e ainda são inconclusivos para que se possa
identificar estratégias nutricionais capazes de promover modulação da
microbiota intestinal e minimizar as complicações da obesidade. A partir da
determinação de estratégias eficazes para a combinação de dietas com utilização
de prebióticos e/ou probióticos será possível estabelecer uma forma de
alimentação personalizada e/ou estratégias terapêuticas para a manipulação da
microbiota intestinal a favor da manutenção da saúde dos indivíduos.
Refêrencias
- World Health Organization (WHO). Obesity and overweight. Fact sheet no. 311. WHO Media Center.
[citado 2016 ago 26]. Disponível em:
http://www.who.int/mediacentre/factsheets/fs311/en/.
- ABESO - Associação Brasileira
para Estudo da Obesidade. [citado 2016 ago 25]. Disponível em:
www.abeso.org.br/noticia/dia-nacional-de-prevencao-da-obesidade.
- Pistelli GC, Costa
CEM. Bactérias intestinais e obesidade. Revista Saúde e Pesquisa 2010;3(1):115-6.
- Gerard P. Gut microbiota
and obesity. Cell Mol Life Sci 2016;73(1):147-62.
- Graham C, Mullen A, Whelan K. Obesity and the gastrointestinal
microbiota: A review of associations and mechanisms. Nutr Rev 2015; 73:376-85.
- Festi D, Schiumerini
R, Eusebi LH, Marasco G, Taddia M, Colecchia A. Gut microbiota and metabolic
syndrome. World J Gastroenterol 2014;20(43):16079-94.
- Jumpertz RDS, Turnbaugh PJ, Trinidad C, Bogardus
C, Gordon JI et al. Energy-balance studies reveal associations between gut
microbes, caloric load and nutrient absorption in humans. Am J Clin Nutr 2011;94(1):58-65.
- DiBaise JK, Zhang H, Crowell
MD, Krajmalnik-Brown R, Decker GA, Rittmann BE. Gut microbiota and its possible relationship
with obesity. Mayo Clin Proc 2008;83(4):460-9.
- Petschow B, Doré J, Hibberd P, Dinan T, Reid
G, Blaser M et al. Probiotics, prebiotics, and the
microbiome: the science of translation. Ann N Y Acad Sci 2013;1306:1-17. doi: 10.1111/nyas.12303
- Quigley EMM. Prebiotics and probiotics; modifying and
mining the microbiota. Pharmacol Res 2010;61(3):2138.
- Park DY, Ahn YT; Park SE, Huh CS, Yoo SR, Yu R, Sung MK, McGregor RA, Choi MS.
Supplementation of Lactobacillus curvatus HY7601 and
Lactobacillus plantarum KY1032 in diet-induced obese
mice is associated with gut microbial changes and reduction in obesity. PLoS
One 2013;8(3):e59470. doi:
10.1371/journal.pone.0059470
- Rodrigues A.
Microbiota intestinal e sua possível relação com a obesidade. ABESO 2011;53(5).
- Gerritsen J, Smidt H,
Rijkers Ger T, de Vos WM. Intestinal microbiota
in human health and disease: the impact of probiotics Genes Nutr
2011;6(3):209-40.
- Fibali L, Henderson B, Sadiq ST, Donos N. Genetic dysbiosis: the role of microbial insults in chronic inflammatory
diseases. J Oral Microbiol 2014;25(6).
- Myles IA. Fast food fever: reviewing the impacts of the Western diet on
immunity. Nutr J 2014;13:61.
- Dasu MR, Ramirez S, Isseroff RR. Toll-like receptors and diabetes: a
therapeutic perspective. Clin Sci
(Lond) 2012;122(5):203-14.
- Shen J, Obin MS, Zhao L. The gut microbiota, obesity and insulin resistance. Mol
Aspects Med 2013;34(1):39-58.
- Vijay-Kumar M, Aitken JD, Carvalho FA, Cullender TC, Mwangi S,
Srinivasan S et al. Metabolic syndrome and altered gut microbiota in mice
lacking Toll-like receptor 5. Science 2010;328(5975):228-31.
- Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the
concept of prebiotics. J Nutr 1995;125(6):1401-12.
- Flesch AG, Poziomyck AK, Damin
DC. The therapeutic use of symbiotics. Arq Bras Cir Dig
2014;27(3):206-9.
- Denipote FG, Trindade
EB, Burini RC. Probiotics and
prebiotics in primary care for colon cancer. Arq Gastroenterol
2010;47(1):93-8.
- Horvat M, Krebs B, Potrc
S, Ivanecz A, Kompan L.
Preoperative synbiotic bowel conditioning for
elective colorectal surgery. Wien Klin Wochenschr 2010;122(Suppl2):26-30.
- Organização Mundial
de Gastroenterologia (OMGE). Guias práticos: probióticos e prebióticos; 2011. Disponível em: http://www. worldgastroenterology.org/assets/export/userfiles/Probiotics_FINAL_pt_2012.pdf.
- Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, Morelli L, Canani
RB, Flint HJ, Salminen S, Calder PC, Sanders ME. The
International Scientific Association for Probiotics and Prebiotics consensus
statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol 2014;11(8):506-14. doi:
10.1038/nrgastro.2014.66.
- Salminen S, Loveren H. Probiotics and prebiotics: health claim
substantiation. Microb Ecol
Health Dis 2012;23: 10.3402/mehd.v23i0.18568.
- Hutkins RW, Krumbeck JA, Bindels LB, Cani PD, Fahey G Jr, Goh YJ, Hamaker
B, Martens EC, Mills DA, Rastal RA, Vaughan E,
Sanders ME. Prebiotics: why definitions matter. Curr Opin Biotechnol 2016.;37:1-7.
- European Food Safety Authority. Reasoned opinion on the modification of the existing
maximum residue levels (MRLs) for dazomet in several
vegetables. EFSA Journal 2015;13(3):4049.
- Mookiah S, Sieo CC, Ramasamy K, Abdullah N,
Ho YW. Effects of dietary prebiotics, probiotic and synbiotics on performance, caecal
bacterial populations and caecal fermentation
concentrations of broiler chickens. J Sci Food Agric 2014;94(2):341-8.
- Khaksar V, Golian A, Kermanshahi H. Immune
response and ileal microflora in broilers fed
wheat-based diet with or without enzyme Endofeed W
and supplementation of thyme essential oil or probiotic PrimaLac.
African Journal of Biotechnology 2012;11(81):14716-23.
- Pedroso AA, Hurley-Bacon AL, Zedek AS, Kwan TW,
Jordan APO, Avellaneda G, Hofacre CL, Oakley BB, Collett SR, Maurer JJ, Lee MD. Can probiotics improve the environmental microbiome and resistome of commercial poultry production? Int J Environ Res Public Health 2013;10(10):4534-59.
- Abdelqader A, Irshaid R, Al-Fataftah AR.
Effects of dietary probiotic inclusion on performance, eggshell quality, cecal microflora composition, and tibia traits of laying
hens in the late phase of production. Trop Anim Health Prod
2013;45(4):1017-24.
- Mountzouris K, Tsitrsikos P, Palamidi I, Arvaniti A, Mohnl M, Schatzmayr G, Fegeros K. Effects
of probiotic inclusion levels in broiler nutrition on growth perfor-mance, nutrient digestibility, plasma
immunoglobulins and cecal microflora composition. Poult Sci 2010;89(1):58-67.
- Daskiran M, Onol AG, Cengiz O, Unsal H, Turkyilmaz S, Tatli O, Sevim O. Influence of
dietary probiotic inclusion on growth performance, blood parameters, and
intestinal microflora of male broiler chickens exposed to posthatch
holding time. J Appl Poult
Res 2012;21(3):612-22.
- Rahman M, Mustari A, Salauddin
M, Rahman M. Effects of probiotics and enzymes on growth performance and haematobiochemical parameters in broilers. Journal of the
Bangladesh Agricultural University 2013;11(1):111-8.
- Bai S, Wu A, Ding X, Lei Y, Bai J, Zhang K, Chio
J. Effects of probiotic-supplemented diets on growth performance and intestinal
immune characteristics of broiler chickens. Poult Sci 2013;92(3):663-70.
- Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics
consensus statement on the scope and appropriate use of the term probiotic. Nat
Rev Gastroenterol Hepatol
2014;11:506-14.
- Bindels LB, Neyrinck AM, Claus SP, Roy CI, Grangette
C, Pot B, Martinez I, Walter JD, Cani P, Delzenne NM. Synbiotic approach
restores intestinal homeostasis and prolongs survival in leukaemic
mice with cachexia. ISME
Journal 2016;10:1456-70.
- Varavallo MA, Santos
TT. A importância de probióticos para o controle e/ou reestruturação da
microbiota intestinal. Revista Itpac
2011;4(1).
- Verspreet J, Damen B, Broekaert WF, Verbeke K, Delcour JA, Courtin CM. A critical look at prebiotics within the dietary fiber concept.
Annu Rev Food Sci
Technol 2016;7:167-90.
- FAO/WHO. Health and nutritional
properties of probiotics in food including powder milk with live lactic acid
bacteria. Food and Agriculture Organization of the United Nations; 2001 Acessado: 19/Abril/2017.
- Brasil. Agência
Nacional de Vigilância Sanitária (ANVISA). Alimentos. Comissões e Grupos de
Trabalho. Comissão Tecnocientífica de Assessoramento em Alimentos Funcionais e
Novos Alimentos. Alimentos com Alegações de Propriedades Funcionais e ou de
Saúde, Novos Alimentos/ Ingredientes, Substâncias Bioativas e Probióticos.
[citado 2017 mar 14]. Disponível em:
http://www.anvisa.gov.br/alimentos/comissoes/tecno_lista_alega.htm.
- SPED - Sociedade
Portuguesa de Endoscopia Digestiva; 2009. [citado 2017 mar 16]. Disponível em: www.sped.pt/index.php?option=com_k2
- Aguilar LT, Esparza
JRE, Fragoso LR. Effect of probiotic BIO-L6® on
intestinal morphology, microbiota and serum cytokines in obese Zucker rats. FASEB J 2014;28(1):633-47.
- Kadooka Y, Sato M, Imaizumi K, Ogawa A, Ikuyama K,
Akai Y et al. Regulation of abdominal adiposity by probiotics (Lactobacillus gasseri SBT2055) in adults with obese tendencies in a
randomized controlled trial. Eur J Clin Nutr 2010;64(6):636-43.
- Everard A, Lazarevic V, Derrien M, Girard M, Muccioli GG,
Muccioli GM et al. Responses of gut microbiota and
glucose and lipid metabolism to prebiotics in genetic obese and diet-induced
leptin-resistant mice. Diabetes 2011;60(11):2775-86.
- Nguyen TD, Kang JH, Lee MS. Characterization of lactobacillus plantarum PH04, a potential probiotic bacterium with
cholesterol-lowering effects. Int J Food Microbiol 2007;113:358-61.
- Salaj R, Štofilová
J, Šoltesová A,
Hertelyová Z, Hijová
E, Bertková
I, Strojný
L, Kružliak P,
Bomba A. The effects of two
Lactobacillus plantarum strains on rat lipid
metabolism receiving a high fat diet. ScientificWorldJournal 2013: 135142.