ARTIGO ORIGINAL
Diferentes modalidades
de exercício não influenciam a sensação de fome, consumo calórico e de
macronutrientes em mulheres pós-menopáusicas
Different exercise modalities do not influence hunger, macronutrients and
caloric intake in postmenopausal women
Randhall Bruce Carteri1,2,3,
Renata Lopes Krueger1, Júlia Silveira Gross1, Álvaro
Reischak-Oliveira1, André Luiz Lopes1,2
1Laboratório de Pesquisa
do Exercício (LAPEX), Escola de Educação Física (ESEF), Universidade Federal do
Rio Grande do Sul (UFRGS), Porto Alegre/RS, 2Centro Universitário
Metodista – Instituto Porto Alegre (IPA), Porto Alegre/RS, 3Instituto
Sul-Brasileiro de Cursos e Qualificações ISulbra/Faculdades
QI, Porto Alegre/RS
Recebido 13 de janeiro
de 2020; aceito 30 de janeiro de 2020
Correspondência: Randhall
Bruce Carteri, Laboratório de Pesquisa do Exercício –
LAPEX, Escola de Educação Física (ESEF), Universidade Federal do Rio Grande do
Sul, Rua Felizardo, 750, 90690-200 Porto Alegre RS
Randhall Bruce Carteri: randhallcarteri@hotmail.com
Renata Lopes Krueger: renatalkruger@gmail.com
Júlia Silveira Gross: juliasgross@hotmail.com
Álvaro Reischak-Oliveira: alvaro.oliveira@ufrgs.br
André Luiz Lopes: andregym23@gmail.com
Resumo
Durante a menopausa
ocorre ganho de peso e massa adiposa. Paralelamente, ocorre uma diminuição da
ingestão calórica, acompanhada por aumento da sensação de fome, uma
consequência natural do envelhecimento. Considerando que exercícios são
importantes para a promoção de saúde e podem influenciar no balanço energético,
o objetivo do presente estudo foi avaliar se a ingestão calórica e de
macronutrientes é influenciada agudamente por diferentes modalidades de
exercício em mulheres pós-menopáusicas. Nove mulheres pós-menopáusicas, com
idade entre 52 e 64 anos, com IMC entre 20 kg/m2 e < 30 kg/m2
participaram do estudo. Foi realizada avaliação antropométrica e de capacidade
de exercício aeróbico. As sessões de teste foram compostas de: descanso na
posição supino por 30 minutos (sessão controle), exercício aeróbico realizado
durante 30 minutos de exercício em cicloergômetro com
intensidade de 60% do VO2pico (exercício aeróbico) ou exercício de
força realizando sete exercícios de força com 3 séries de 15 RM e intervalo
entre séries de um minuto (exercício de força). Nossos resultados mostram que
não houve influência do exercício na sensação de fome, densidade calórica,
composição de macronutrientes em uma refeição livre. De uma maneira geral,
nossos achados estão de acordo com a literatura indicando que não há aumento
compensatório aguda da fome ou da ingestão de alimentos após exercício.
Palavras-chave: menopausa, apetite,
saúde.
Abstract
During
menopause there is weight gain and fat mass. At the same time, there is a
decrease in caloric intake, accompanied by an increased feeling of hunger, a
natural consequence of aging. Whilst exercises are important for health
promotion and can influence energy balance, the aim of the present study was to
evaluate whether caloric and macronutrient intake is acutely influenced by
different exercise modalities in postmenopausal women. Nine postmenopausal
women, aged 52 to 64 years, with a BMI between 20 kg/m2 and <30
kg/m2 participated in the study. Anthropometric and aerobic exercise
capacity assessments were performed. Test sessions were composed of a 30-minute
supine position (control session); aerobic cycle ergometer exercise at 60% of
VO2peak performed for 30 minutes (aerobic session) of strength
exercise, performing seven strength exercises with 3 sets of 15 RM and interval
between sets of one minute (strength session). Our results showed that there
was no influence of exercise on hunger sensation, caloric density,
macronutrient composition of the self-selected meal. Overall, our findings are
consistent with literature indicating that there is no acute compensatory
increase in hunger or food intake after exercise.
Key-words: menopause, appetite,
health.
Introdução
O envelhecimento gera
alterações fisiológicas na mulher, ocorrendo um aumento na incidência de
doenças cardiovasculares em comparação com mulheres ainda férteis [1]. Pode-se
afirmar que a perimenopausa inicia com a primeira
irregularidade menstrual e termina 12 meses após a última menstruação, dando
início a menopausa [2]. A menopausa é definida como o encerramento dos ciclos
menstruais e ovulatórios da mulher, ocorrendo em uma
média de 47-54 anos de idade [3], ocorrendo depleção dos folículos ovários,
associada a aumento do índice de massa corporal (IMC), diminuição da atividade
física, diminuição da densidade mineral óssea, diminuição do metabolismo basal,
dislipidemia, diminuição de massa muscular e maior risco para doenças
cardiovasculares [4].
A nutrição também é
fundamental para saúde na menopausa, considerando o aumento do índice de massa
corporal (IMC), diminuição da atividade física, diminuição da densidade mineral
óssea [5], diminuição do metabolismo basal [6], maiores concentrações de
triglicerídeos e lipoproteína de baixa densidade (LDL), além de maior densidade
de partículas de LDL e menor concentração de lipoproteína de alta densidade
(HDL) [7], aumento de marcadores inflamatórios [8,9] e maior estresse oxidativo
[10]. Adicionalmente, a ingestão calórica durante a menopausa diminui da ingestão
calórica, em consequência de alterações na sensação de fome influenciando no
sucesso da prescrição nutricional para a saúde [11]. Ainda, se a estratégia de
saúde incluir o exercício físico regular, é importante explorar como diferentes
modalidades podem resultar em a variação nas sensações de fome e no consumo de
macronutrientes. O exercício é um dos mais importantes fatores no manejo da
menopausa, devido aos diversos benefícios metabólicos que ele proporciona [12].
Nesse sentido, embora o
gasto energético seja menor em exercício de força quando comparado ao exercício
aeróbico [13], essa variável pode ser equalizada entre ambas as modalidades, de
acordo com a manipulação de diferentes variáveis [14]. Portanto, a inclusão de
diferentes modalidades de exercício é importante para a saúde global nessa
população, tal como a combinação de exercícios regulares associada com o
acompanhamento nutricional [14,15]. Assim, o objetivo desse trabalho foi
avaliar a ingestão calórica e de macronutrientes é influenciada por diferentes
modalidades de exercício em mulheres pós-menopáusicas
Material e métodos
Sujeitos
Nove mulheres
pós-menopáusicas, com idade entre 52 e 64 anos, com IMC entre 20 kg/m2
e < 30 kg/m2, com no mínimo dois anos na menopausa, aparentemente
saudáveis, não praticantes de exercícios físicos por pelo menos seis meses
anteriores ao estudo. Foram excluídas voluntárias com histórico de diabetes
tipo 1 e 2, doenças graves cardiovasculares (a exceção de hipertensão
controlada), endócrinas, metabólicas como dislipidemia e neurológicas como
demência, doença de Alzheimer e Parkinson, além de voluntarias que estivessem
sob uso de qualquer medicamento com influência no metabolismo endócrino ou
neuromuscular, como tratamento de reposição hormonal. As voluntárias assinaram
um termo de consentimento livre e esclarecido, e esse estudo foi aprovado pelo
Comitê de Ética em Pesquisa da Universidade Federal do Rio Grande do Sul
(Parecer número 75681).
Procedimentos de teste
O experimento foi
composto por cinco visitas ao laboratório, separadas por pelo menos 2 dias.
Foram realizadas avaliações morfológicas e metabólicas para caraterização da
amostra; Na primeira visita (V1) as voluntárias receberam as instruções sobre
cada etapa do estudo, assinaram o termo de consentimento livre e esclarecido
(TCLE), realizaram a avaliação antropométrica e de capacidade de exercício
aeróbico, foram instruídas no preenchimento do recordatório alimentar e tiveram
acesso à refeição livre. Na segunda visita (V2), as voluntárias foram
orientadas a repetir a alimentação reportada anteriormente para realizar os
testes de força (repetição máxima). Para todas as visitas subsequentes, as
voluntárias foram orientadas a repetir a alimentação reportada anteriormente e também não consumir cafeína e álcool ou realizar atividade
física vigorosa nas 48 horas antecedentes e realizar jejum de 12 horas. Na
terceira visita as participantes tiveram acesso à refeição livre após 30
minutos em repouso (CT). Nas visitas quatro (V3) e cinco (V4), foram realizadas
as sessões de exercício aeróbico (AERO) ou de força (EF).
Avaliação da composição
corporal
As dobras cutâneas
foram medidas utilizando um plicômetro (Modelo Harpenden Científico, Marca Cescorf,
Porto Alegre, Brasil), diâmetros ósseos por paquímetro e antropômetro
(Cescorf, Porto Alegre, Brasil), perímetros foram
medidos usando fita métrica (Sanny, São Bernardo do
Campo, São Paulo), massa e estatura medidas por meio de balança e estadiômetro (modelo OS-180 da marca Urano, RS/Brasil). As
marcações dos locais e a técnica de tomada das dobras cutâneas seguiram os
padrões da Sociedade Internacional para o Avanço da Cineantropometria (ISAK) e
os cálculos da composição corporal foram realizados usando a metodologia de
cinco componentes [16].
Teste de pico de
consumo de oxigênio
O pico de consumo de
oxigênio (VO2pico) foi determinado usando um sistema de ergoespirometria de circuito aberto (MedGraphics
Cardiorespiratory Diagnostic
Systems, modelo CPX-D). O analisador de gases foi ligado uma hora antes do
primeiro teste para estabilização. Em seguida foi realizada a calibração por
meio de gases com concentrações conhecidas. Os testes de carga progressiva, em cicloergômetro (The Bike, Cibex,
USA), foram realizados com protocolo em rampa. A intensidade inicial
estabelecida foi de 25W, com aumento de 25W a cada três minutos, mantendo uma
cadência de pedalada entre 60 e 80 rotações por minuto (rpm). Uma faixa
telemétrica foi posicionada para monitorar continuamente a Frequência Cardíaca
(FC) dos participantes (S610, Polar Electro Oy, Finland). As participantes foram verbalmente estimuladas
para realizar esforço máximo durante o teste. O teste seguiu as recomendações
do American College of
Sports Medicine [14] e foi encerrado sempre que as participantes atingiram
um dos seguintes critérios: a) Platô no consumo de oxigênio; b) Frequência
cardíaca ≥ predita para idade; c) Valor de taxa de troca respiratória
> 1,15; d) percepção subjetiva de esforço > 18 ou quando a participante
voluntariamente interrompia o teste.
Teste de Repetição Máxima
(1RM)
O teste de repetição
máxima foi realizado na primeira visita ao laboratório, junto com a avaliação
antropométrica. O Teste de repetições máximas consistiu em solicitar às
voluntárias que realizassem o maior número de repetições possíveis em cada
exercício com uma carga determinada de acordo com o peso corporal. A carga era
ajustada de acordo com valores para correção [17] para estimar a carga
correspondente a 15RM. O teste era repetido para a verificação da carga e
quando não correspondia ao máximo da voluntária, o mesmo procedimento era
repetido até que fosse encontrado o valor apropriado, limitando a cinco
tentativas. Entre cada tentativa, foi permitido intervalo de 3 minutos, tempo
adequado de recuperação.
Sessões de exercício
aeróbico e de força
O exercício aeróbico
(AERO) foi realizado durante 30 minutos de exercício em cicloergômetro
com intensidade de 60% do VO2pico. O exercício de força (EF) consistiu de sete exercícios realizados em três séries de 15 RM, com
intervalo entre séries e exercícios de um minuto. Os exercícios foram
realizados na seguinte ordem: 1- Leg Press; 2- Supino
com halteres; 3- Remada Unilateral; 4- Extensão de joelhos; 5- Flexão de
cotovelos; 6- Flexão de joelhos; 7- Tríceps com halteres.
Controle dietético,
sensação de fome e refeição padrão
Para realizar a
avaliação do consumo alimentar foi utilizado o Registro Alimentar de vinte e
quatro horas (R24), preenchido pela participante no dia anterior de cada sessão
de exercício. As refeições foram descritas com os horários, as quantidades em
medidas caseiras e, quando possível, a marca do produto alimentício. Para
minimizar erros na descrição das porções dos alimentos foi utilizado um
material de suporte com fotos para que os registros fossem os mais detalhados e
padronizados possíveis. Os dados foram posteriormente calculados utilizando a
tabela brasileira de composição de alimentos [18] e as informações nutricionais
específicas de cada produto quando indicado. As participantes foram orientadas
a seguir a alimentação relatada no dia anterior do primeiro R24 para as visitas
subsequentes.
Para avaliação da
sensação de fome antes, após o exercício e após a refeição livre, foi utilizada
uma escala visual analógica adaptada de acordo com estudos anteriores [19]. A
refeição padronizada foi oferecida ad libitum consistia em pão branco, pão
integral, bolachas salgadas, margarina, requeijão, banana, maçã, leite, suco de
laranja, suco de uva, presunto e queijo. Os participantes consumiram as
refeições isoladamente durante 30 minutos, para não ocorrer influência social
na seleção de alimentos. Ainda, foram orientadas a comer até ficarem
"confortavelmente cheios" e que alimentos adicionais estavam
disponíveis, se desejado. As sobras foram pesadas e o consumo de alimentos foi
determinado como a diferença ponderada de itens da refeição antes e após cada
refeição.
Análise estatística
Foi utilizada
estatística descritiva com exposição de médias ± desvio padrão (X±DP). Para
verificar a normalidade das variáveis foi utilizado o Teste de Kolmogorov-Smirnov. Para as demais comparações foi
utilizada a análise de variância (ANOVA) de uma ou duas vias quando apropriado,
com post hoc de Tukey. O nível de significância
assumido foi de p < 0,05. Para a execução dos procedimentos estatísticos foi
utilizado o pacote estatístico SPSS (Statistical Package for the Social Sciences) versão 21.0.
Resultados
A tabela I apresenta os
dados de caracterização da amostra. A média de idade da amostra avaliada foi
58,94 ± 5,25 anos e o IMC foi de 25,29±3,94 kg/m2. Os valores dos
cinco componentes da massa corporal estão apresentados em quilogramas (kg). A
média do pico de consumo de oxigênio obtido no teste foi de 18,27 ± 2,37 ml.kg-1.min-1.
Tabela I - Dados de
caracterização da amostra (n = 9).
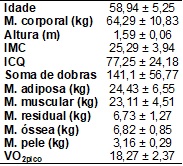
Dados apresentados em
média ± desvio padrão
Não houve influência da
modalidade do exercício sobre a sensação de fome após o exercício (p = 0,77,
0,61 e 0,90 para CT, EF e AERO, respectivamente). Entretanto, na comparação intra grupo indicou diminuição na fome após a refeição,
quando comparada com o momento pós exercício (p < 0,001).
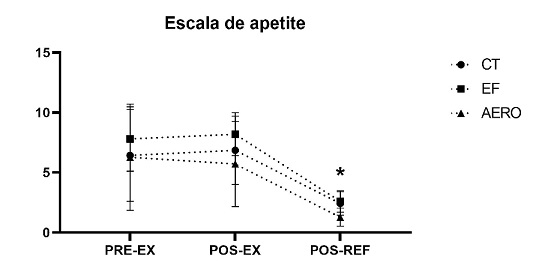
*indica diferença
significativa para comparação do momento pós refeição (POS-REF) com os momentos
pré-exercício (PRE-EX) e pós exercício (POS-EX) para
todos os grupos.
Figura 1 - Sensação de fome
antes, após o exercício e após a refeição livre.
A tabela II apresenta
os dados de densidade calórica, consumo de carboidratos, lipídios ou proteínas
na refeição livre. Não houve influência da modalidade do exercício sobre nenhum
dos parâmetros avaliados.
Tabela II - Densidade
calórica, total de carboidratos, lipídios e proteínas consumidos na refeição
livre.
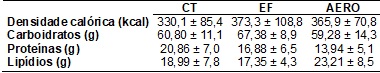
Dados apresentados em
média ± desvio padrão
Discussão
O presente estudo
buscou avaliar se a ingestão calórica e de macronutrientes é influenciada
agudamente por diferentes modalidades de exercício em mulheres
pós-menopáusicas. Nossos resultados mostram que não houve influência do
exercício na sensação de fome, densidade calórica, composição de
macronutrientes em uma refeição livre. Durante a menopausa ocorre ganho de peso
e massa adiposa [20,21]. Paralelamente, ocorre uma diminuição da ingestão
calórica, acompanhada por aumento da sensação de fome, uma consequência natural
do envelhecimento [11]. De uma maneira geral, nossos achados estão de acordo
com a literatura indicando que não há aumento compensatório aguda da fome ou da
ingestão de alimentos após exercício [22,23].
A influência do
exercício na sensação de fome ainda é um tópico controverso na literatura.
Diferentes peptídeos atuam no hipotálamo e regulam agudamente o apetite, tais
como a grelina acilada, polipeptídeo YY (PYY) e o peptídeo semelhante ao glucagon-1
(GLP-1) [24,25]. Quanto aos efeitos do exercício, a maioria dos estudos relatou
supressão aguda do apetite, embora ainda não sejam claras as respostas de
hormônios e peptídeos relacionados à fome, apetite e ingestão de energia
[23,26]. Entretanto a literatura atual investiga majoritariamente indivíduos
jovens e devemos considerar que a menopausa prejudica a ação dos peptídeos
reguladores do apetite, o que pode explicar as alterações de composição
corporal nessa população [11,27,28]. Em mulheres pós-menopáusicas, foi
recentemente demonstrado que a grelina acilada, principal peptídeo orexígeno,
não é influenciada por exercício aeróbico ou de força [29].
Vários estudos indicam
supressão do apetite após sessões agudas de pelo menos 30 minutos de exercício
aeróbico contínuo com intensidade igual ou superior a 60% do consumo de
oxigênio de pico [30-35] ou também após o exercício de força [32,35].
Novamente, a vasta maioria dos estudos avaliou jovens saudáveis, diferente do
presente estudo, o que pode explicar a diferença no resultado. Portanto,
diversos trabalhos indicam que ambas as modalidades de exercício não induzem
aumento na ingestão de energia compensatória e também
não influenciam na escolha de macronutrientes [35-37]. Esses resultados são
diferentes dos reportados anteriormente indicando que exercício aeróbico ou de
força podem estimular o apetite e aumentar a ingestão energética [38].
Adicionalmente, se a refeição oferecida após exercício for isocalórica,
a resposta de escolha de composição nutricional pode ser influenciada, onde
ambas modalidades do exercício parecem exercer diminuições na preferência
relativa por alimentos ricos em gordura, independente de alterações na ingestão
de energia [39]. De maneira geral, nossos resultados indicam que, como
frequentemente observado em jovens do sexo masculino, não há aumento
compensatório da ingestão de energia ou preferências específicas de
macronutrientes induzidas pelo exercício agudo em mulheres na pós-menopausa.
Nossos dados em relação
a densidade calórica corroboram achados anteriores, indicando que mesmo com
alto volume de exercício, não há aumento compensatório automático da fome e
ingestão calórica [22,23]. Assim o exercício é uma estratégia viável para
promover perda de peso nessa população, gerando um déficit calórico sem gerar
uma resposta compensatória natural na ingestão calórica, diferentemente do que
a literatura relata para déficit calórico gerado por diminuição na ingestão
energética [40,41]. Esses resultados são importantes para promoção de
estratégias de saúde em longo prazo, onde no geral, a combinação de intervenção
nutricional com exercício físico resulta em maiores benefícios para a saúde
obtidos em um menor prazo [42].
O presente estudo
apresenta algumas limitações. Não necessariamente respostas agudas podem se
relacionar com as respostas de ingestão energética e o balanço energético de
longo prazo. Embora a refeição oferecida tenha contemplado itens comumente
consumidos na primeira refeição do dia, não mensuramos o gasto energético
durante o exercício para verificar se a quantidade calórica ingerida consumida
compensou o gasto do exercício. Como não encontramos diferenças no consumo
energético após o exercício em comparação com o grupo controle, podemos hipotetizar que ocorreu déficit calórico, o que pode
beneficiar essa população no longo prazo. Ainda, a mensuração da resposta de
diferentes peptídeos nos diferentes momentos pode auxiliar a desvendar
mecanismos associados com as respostas encontradas.
Conclusão
Os achados do presente
estudo estão de acordo com a literatura indicando que não há aumento
compensatório aguda da fome ou da ingestão de alimentos após exercício aeróbico
ou de força. Futuros estudos avaliando a resposta de peptídeos relacionados com
a ingestão energética ou avaliando o consumo em refeições subsequentes podem
expandir a literatura. Esses achados são importantes para a orientação de
estratégias visando a saúde dessa população.
Referências
- Gordon T, Kannel WB, Hjortland MC, McNamara PM. Menopause and coronary
heart disease. The Framingham Study. Ann Intern med 1978;89(2):157-61.
- Soules
MR, Sherman S, Parrott E, Rebar R, Santoro N, Utian W
et al. Executive summary: Stages of Reproductive Aging Workshop (STRAW).
Climacteric 2001;4(4):267-72. https://doi.org/10.1080/cmt.4.4.267.272
- Nedrow A, Miller J, Walker M, Nygren P,
Huffman LH, Nelson HD. Complementary and alternative therapies for the
management of menopause-related symptoms: a systematic evidence review. Arch
Intern Med 2006;166(14):1453-65.
https://doi.org/10.1001/archinte.166.14.1453
- Messier
V, Rabasa-Lhoret R, Barbat-Artigas
S, Elisha B, Karelis AD, Aubertin-Leheudre M.
Menopause and sarcopenia: A potential role for sex hormones. Maturitas 2011;68(4):331-6.
https://doi.org/10.1016/j.maturitas.2011.01.014
- Kemmler
W, Lauber D, Weineck J, Hensen
J, Kalender W, Engelke K.
Benefits of 2 years of intense exercise on bone density, physical fitness, and
blood lipids in early postmenopausal osteopenic
women: results of the Erlangen Fitness Osteoporosis Prevention Study (EFOPS).
Arch Intern Med 2004;164(10):1084-91.
https://doi.org/10.1001/archinte.164.10.1084
- Poehlman ET, Toth MJ, Gardner
AW. Changes in energy balance and body composition at menopause: a controlled
longitudinal study. Ann Intern Med 1995;123(9):673-5.
- Campos
H, McNamara JR, Wilson PW, Ordovas JM, Schaefer EJ.
Differences in low density lipoprotein subfractions and apolipoproteins in
premenopausal and postmenopausal women. J Clin Endocrinol
Metab 1988;67(1):30-5. https://doi.org/10.1210/jcem-67-1-30
- Kim
OY, Chae JS, Paik JK, Seo HS, Jang Y, Cavaillon JM, et al. Effects of aging and menopause on serum interleukin-6 levels and
peripheral blood mononuclear cell cytokine production in healthy nonobese
women. Age 2012;34(2):415-25. https://doi.org/10.1007/s11357-011-9244-2
- Perry
CD, Alekel DL, Ritland LM, Bhupathiraju
SN, Stewart JW, Hanson LN, et al. Centrally located body fat is related to
inflammatory markers in healthy postmenopausal women. Menopause
2008;15(4Pt1):619-27. https://doi.org/10.1097/gme.0b013e318159f1a2
- Zitnanova I, Rakovan
M, Paduchova Z, Dvorakova
M, Andrezalova L, Muchova J
et al. Oxidative stress in women with perimenopausal symptoms. Menopause
2011;18(11):1249-55. https://doi.org/10.1097/gme.0b013e318224fa3d
- McNeil
J, Prud'homme D, Strychar I, Rabasa-Lhoret R, Brochu M, Lavoie JM et al. Satiety quotient linked to food intake and changes in anthropometry
during menopause: a MONET Study. Climacteric 2014;17(4):449-55.
https://doi.org/10.3109/13697137.2014.895320
- Pines
A. Lifestyle and diet in postmenopausal women. Climacteric 2009;12(Suppl
1):62-5. https://doi.org/10.1080/13697130902785449
- Bloomer
RJ. Energy cost of moderate-duration resistance and aerobic exercise.
J Strength Cond Res 2005;19(4):878-82. https://doi.org/10.1519/00124278-200511000-00026
- American
College of Sports Medicine. Riebe D, Ehrman JK,
Liguori G, Magal M. ACSM's Guidelines for exercise
testing and prescription 2018.
- Chodzko-Zajko WJ, Proctor DN, Fiatarone Singh MA, Minson CT, Nigg CR, Salem GJ et al. Exercise and physical activity for
older adults. Med Sci Sports Exerc
2009;41(7):1510-30. https://doi.org/10.1249/mss.0b013e3181a0c95c
- Marfell-Jones M, Olds T, Stewart A, Carter JEL. International standards for
anthropometric assessment. Potchefstroom: North-West University; 2006.
- Lombardi
VP. Beginning weight training: the safe and effective way. Dubuque, Iowa: WC Brown; 1989.
- UNICAMP. UEDC. Tabela
brasileira de composição de alimentos - TACO. 4th ed. Campinas:
UNICAMP/NEPA.
- Flint
A, Raben A, Blundell JE, Astrup
A. Reproducibility, power and validity of visual analogue scales in assessment
of appetite sensations in single test meal studies. Int
J Obes 2000;24(1):38-48. https://doi.org/10.1038/sj.ijo.0801083
- Guthrie
JR, Dennerstein L, Dudley EC. Weight gain and the menopause:
a 5-year prospective study. Climacteric 1999;2(3):205-11.
https://doi.org/10.3109/13697139909038063
- Abdulnour J, Doucet E, Brochu M, Lavoie JM, Strychar I, Rabasa-Lhoret R et al. The effect of the menopausal
transition on body composition and cardiometabolic risk factors: a
Montreal-Ottawa New Emerging Team group study. Menopause 2012;19(7):760-7.
https://doi.org/10.1097/gme.0b013e318240f6f3
- Blundell
JE, Stubbs RJ, Hughes DA, Whybrow S, King NA. Cross talk between physical
activity and appetite control: does physical activity stimulate appetite? Proc Nutr Soc 2007;62(3):651-61.
https://doi.org/10.1079/pns2003286
- Dorling
J, Broom DR, Burns SF, Clayton DJ, Deighton K, James LJ et al. Acute and
chronic effects of exercise on appetite, energy intake, and appetite-related
hormones: the modulating effect of adiposity, sex, and habitual physical
activity. Nutrients 2018;10(9):1140. https://doi.org/10.3390/nu10091140
- Klok MD, Jakobsdottir
S, Drent ML. The role of leptin and ghrelin in the
regulation of food intake and body weight in humans: a review. Obes Rev 2007;8(1):21-34.
https://doi.org/10.1111/j.1467-789x.2006.00270.x
- Carteri RB, Genario R. Influence of the environment and temperature in
acute exercise-induced appetite regulation. In: Hertz D, ed. Ghrelin: function,
mechanism of action and role in health and disease. 1. Hauppauge/NY: Nova
Science; 2019. p.160.
- Stensel D. Exercise, appetite
and appetite-regulating hormones: implications for food intake and weight
control. Ann Nutr Metab
2010;57(Suppl2):36-42. https://doi.org/10.1159/000322702
- Duval
K, Prud'homme D, Rabasa-Lhoret
R, Strychar I, Brochu M,
Lavoie JM, et al. Effects of the menopausal transition on dietary intake and
appetite: a MONET Group Study. Eur J Clin Nutr
2014;68(2):271-6. https://doi.org/10.1038/ejcn.2013.171
- Hirschberg
AL. Sex hormones, appetite and eating behaviour
in women. Maturitas 2012;71(3):248-56.
- Carteri RB, Lopes AL, Scholer CM, Correa CS, Macedo RC, Gross JS et al. Acylated
ghrelin and circulatory oxidative stress markers responses to acute resistance
and aerobic exercise in postmenopausal women. J Phys Activ Health
2016;13(6):632-9. https://doi.org/10.1123/jpah.2015-0413
- King
JA, Wasse LK, Ewens J, Crystallis K, Emmanuel J, Batterham
RL et al. Differential acylated ghrelin, peptide YY3-36, appetite, and food
intake responses to equivalent energy deficits created by exercise and food
restriction. J Clin Endocrinol Metab
2011;96(4):1114-21. https://doi.org/10.1210/jc.2010-2735
- King
JA, Miyashita M, Wasse LK, Stensel
DJ. Influence of prolonged treadmill running on appetite, energy intake and
circulating concentrations of acylated ghrelin. Appetite 2010;54(3):492-8.
https://doi.org/10.1016/j.appet.2010.02.002
- Broom
DR, Batterham RL, King JA, Stensel
DJ. Influence of resistance and aerobic exercise on hunger, circulating levels
of acylated ghrelin, and peptide YY in healthy males. Am J Physiol
Regul Integr Comp Physiol 2009;296(1):R29-35.
https://doi.org/10.1152/ajpregu.90706.2008
- Douglas
JA, King JA, Clayton DJ, Jackson AP, Sargeant JA, Thackray AE et al. Acute effects of exercise on appetite,
ad libitum energy intake and appetite-regulatory hormones in lean and
overweight/obese men and women. Int J Obes
2017;41(12):1737-44. https://doi.org/10.1038/ijo.2017.181
- Alajmi N, Deighton K, King JA, Reischak-Oliveira A, Wasse LK,
Jones J et al. Appetite and energy intake responses to acute energy deficits in
females versus males. Med Sci Sports Exerc
2016;48(3):412-20. https://doi.org/10.1249/mss.0000000000000793
- Balaguera-Cortes L, Wallman KE, Fairchild TJ, Guelfi
KJ. Energy intake and appetite-related hormones following acute aerobic and
resistance exercise. Appl Physiol Nutr Metab 2011;36(6):958-66.
https://doi.org/10.1139/h11-121
- Jokisch E, Coletta
A, Raynor HA. Acute
energy compensation and macronutrient intake following exercise in active and
inactive males who are normal weight. Appetite 2012;58(2):722-9.
https://doi.org/10.1016/j.appet.2011.11.024
- Cadieux
S, McNeil J, Lapierre MP, Riou ME, Doucet E.
Resistance and aerobic exercises do not affect post-exercise energy
compensation in normal weight men and women. Physiol Behav
2014;130:113-9.
https://doi.org/10.1016/j.physbeh.2014.03.031
- Laan DJ, Leidy HJ, Lim E, Campbell WW. Effects and reproducibility of aerobic and resistance exercise on
appetite and energy intake in young, physically active adults. Appl Physiol Nutr Metab
2010;35(6):842-7. https://doi.org/10.1139/h10-072
- McNeil
J, Cadieux S, Finlayson G, Blundell JE, Doucet E. The effects of a single bout
of aerobic or resistance exercise on food reward. Appetite 2015;84:264-70.
https://doi.org/10.1016/j.appet.2014.10.018
- Hubert
P, King NA, Blundell JE. Uncoupling the effects of energy expenditure and
energy intake: appetite response to short-term energy deficit induced by meal
omission and physical activity. Appetite 1998;31(1):9-19.
https://doi.org/10.1006/appe.1997.0148
- Lawton
CL, Burley VJ, Wales JK, Blundell JE. Dietary fat and appetite control in obese
subjects: weak effects on satiation and satiety. Int J Obes Relat Metab Disord 1993;17(7):409-16.
- Lopes
AL, T Fayh AP, de Souza Campos LG, Teixeira BC, Kreismann Carteri RB, Ribeiro JL
et al. The effects of diet- and diet plus exercise-induced weight loss on basal
metabolic rate and acylated ghrelin in grade 1 obese subjects. Diabetes Metab Syndr Obes
2013;6:469-75.
https://doi.org/10.2147/dmso.s53501