REVISÃO
Produtos
de glicação avançada e desenvolvimento da aterosclerose
Advanced glycation end products and development of atherosclerosis
Elisa Batista Oliveira
e Silva, M.Sc.*, Luci Tojal e Seara, M.Sc.**, Rose Carolinne
Correia da Silva, M.Sc.*
*Nutricionista,
Mestra em Nutrição, subárea de Nutrição e Desenvolvimento Fisiológico, Universidade
Federal de Alagoas (UFAL), **Nutricionista, Mestra em Ciências dos Alimentos, Faculdade
de Nutrição da Universidade Federal de Alagoas (UFAL), Trabalho desenvolvido na
Universidade Federal de Alagoas Maceió/ AL (UFAL) para obtenção do grau de Nutricionista
Recebido 19 de novembro
de 2015; aceito 15 de março de 2016
Endereço
para correspondência:
Elisa Batista Oliveira e Silva, Universidade Federal do Alagoas (UFAL)/ Faculdade de Nutrição, Campus A. C. Simões - Av. Lourival
Melo Mota, s/n, 104 Norte, Km 97, Cidade Universitária Tabuleiro do Martins 57072-970
Maceió AL, E-mail: Elisa Batista Oliveira e Silva: elisanut@gmail.com, Luci Tojal
e Seara: lucitojal@gmail.com, Rose Carolinne Correia da Silva: carolinne_correia@hotmail.com
Resumo
Objetivo: Esta revisão objetiva
investigar a contribuição dos Produtos de Glicação Avançada (AGEs)
dietéticos na aterosclerose para a otimização da dietoterapia. Metodologia: O presente estudo realizou um
levantamento bibliográfico sobre estudos publicados nos bancos de dados Medline,
PUBMed, Periódicos CAPES, ScienceDirect e SciELO no período
de 1997 a 2015. Síntese dos dados: Os
AGEs dietéticos são absorvidos
e se juntam aos AGEs endógenos,
exercendo atividades pró-oxidantes e
pró-inflamatórias, concorrendo para a
inflamação,
o estresse oxidativo e a lesão vascular, através do
aumento da glicação de proteínas
e da interação AGE-receptor. A glicação de
lipoproteínas, ligações cruzadas entre
AGEs e proteínas da parede dos vasos e o aumento da vasoconstrição
estimulam o desenvolvimento da aterosclerose. Conclusão: A glicação de proteínas e seus produtos atuam claramente
no desenvolvimento da aterosclerose. A ingestão dos AGEs
dietéticos deve ser reduzida na abordagem terapêutica da aterosclerose. Alimentos
submetidos a técnicas culinárias como ferver, cozinhar e ensopar devem ser preferencialmente
ingeridos. Alimentos fontes de lipídeos e proteínas processados a altas temperaturas
são fontes de AGEs e devem ser evitados. Juntas, essas
estratégias contribuem para a redução do pool de AGEs no
organismo.
Palavras-chave: produtos finais de glicosilação,
dieta, aterosclerose, doenças cardiovasculares.
Abstract
Objective: This review aims
to investigate the contribution of dietary Advanced glycation
end products (AGEs) to atherosclerosis and their role in the optimization of dietotherapy.
Methodology: The present study performed
a literature review in databases Medline, PUBMed, Periódicos CAPES, ScienceDirect
e SciELO in the period 1997-2015. Data synthesis:
Dietary AGEs are absorbed and join the endogenous AGEs, exerting pro-oxidant and
pro-inflammatory activities, competing to inflammation, oxidative stress and vascular
injury by increasing glycation of proteins and AGE-receptor interaction. Lipoproteins's
glycation, cross-links between AGEs and proteins from the vessel wall and increased
vasoconstriction stimulate the development of atherosclerosis. Conclusion: Glycation of proteins and its
products contribute in a clear way to the development of atherosclerosis. The intake
of dietary AGEs must be reduced in the atherosclerosis’s therapeutic approach. Therefore,
food subjected to cooking techniques such as boiling, steaming and soaking should
be preferred. Food sources of lipids and proteins, processed at high temperatures,
considered sources of AGEs, should be avoided. Together, these strategies help to
reduce the pool of AGEs in the body.
Key-words: glycosylation
end products, advanced; diet, atherosclerosis, cardiovascular diseases.
Introdução
No Brasil, as doenças
cardiovasculares (DCV) são as principais causas de morte, destacando-se as atribuíveis
à aterosclerose. A aterosclerose é uma doença inflamatória crônica de origem multifatorial,
inicia-se pela agressão ao endotélio vascular, ocorrendo disfunção endotelial e
predisposição ao infarto do miocárdio, acidente vascular encefálico e doenças vasculares
periféricas [1,2].
O processo de transição
nutricional brasileiro é um dos determinantes desse panorama, pelo aumento do consumo
de gorduras saturadas, trans e açúcar em detrimento do consumo de alimentos fontes
de fibras [3]. A dieta é a principal fonte exógena dos compostos denominados glicotoxinas
(AGEs,
Advanced Glycation Endproducts), formados através
de reações não enzimáticas, a partir de
interações aminocarbonílicas, entre dicarbonilas
de açúcares redutores, produtos de oxidação
de carboidratos, aminoácidos, lipídeos
e ácido ascórbico, com aminas de aminoácidos,
proteínas, aminofosfolipídeos ou ácidos
nucléicos [4].
Os Produtos de Glicação
Avançada (AGEs) são formados principalmente no organismo,
através de precursores dicarbonílicos – glioxal (G), metilglioxal (MG) e 3-deoxiglicosona
(3-DG) – derivados da glicose produzidos intracelularmente. Os AGEs assim produzidos, juntam-se aos AGEs formados fora da célula,
constituindo o pool corporal de AGEs [5] em seres humanos, o qual é determinado,
ainda, pela ingestão alimentar desses compostos, por sua excreção renal (ocorre
aumento do pool corporal pelo comprometimento da função renal), pela produção de
AGEs via hiperglicemia e estresse oxidativo e pela redução da defesa anti-AGE do
organismo humano, associado ao envelhecimento. Os AGEs
dietéticos, assim como os gerados no organismo, promovem carga glicoxidante sistêmica,
estresse oxidativo e inflamação vascular, através de mecanismos dependentes e independentes
de receptores específicos [4,6]. Esses processos associados à dislipidemia, à hipertensão
arterial sistêmica e ao tabagismo promovem a aterosclerose [2,7]. Portanto, os AGEs apresentam propriedades pró-oxidantes e pró-inflamatórias.
Os AGEs dietéticos, adicionados a outros fatores da dieta,
conduzem a desordens no sistema cardiovascular, aumentando o risco para aterosclerose,
severidade de eventos cardiovasculares mais complexos e consequentemente índices
significativos de morbimortalidade [2,4,8].
Objetivo
Esta revisão objetiva
investigar a contribuição dos AGEs dietéticos no desenvolvimento
da aterosclerose para otimização da dietoterapia.
Métodologia
Para esta revisão bibliográfica,
procedeu-se a pesquisa em artigos científicos publicados no período de 1997 a 2015,
nos Bancos de Dados Medline, PUBMed, Periódicos CAPES,
ScienceDirect e SciELO.
Os
descritores em saúde
utilizados foram: ‘produtos finais de
glicosilação’, ‘dieta’,
‘aterosclerose’ e
‘doenças cardiovasculares’, seus respectivos
sinônimos em inglês – ‘glycosylation
end products, advanced’, ‘diet’,
‘atherosclerosis’ e ‘cardiovascular diseases’.
Foram selecionados 48
artigos científicos, considerando estudos publicados nas línguas inglesa, espanhola
e portuguesa, englobando artigos de revisão, ensaios clínicos e experimentais, que
compreenderam mecanismos de formação e ação de AGEs, seu
metabolismo, considerando, ainda, os AGEs potencialmente presentes na alimentação,
sua repercussão para o desenvolvimento da aterosclerose e as perspectivas de utilização
de antiglicantes.
Formação
de AGEs
Os AGEs
são formados por várias vias, através dos intermediários dicarbonílicos reativos,
como a 3-DG, o G e o MG, que podem ocorrer no processo clássico via reação de Maillard
(1ª via), até a formação de produtos de Amadori ou produtos iniciais da glicação
[9]. Estes agentes de glicação se condensam a grupos aminas primários acessíveis
formando AGEs [4,10]. Os compostos dicarbonílicos originam-se,
também, da auto-oxidação da glicose e de lipídios a glioxal intracelular (2ª e 3ª
vias). O metilglioxal, composto dicarbonílico mais reativo, é formado principalmente
pela β-eliminação não-enzimática do grupo fosfato
das trioses fosfato, derivadas da glicólise (4ª via). Estes compostos dicarbonílicos
intracelulares reativos reagem com o grupamento amina de proteínas intracelulares
e extracelulares para formar AGEs [4,5,11,12]. Assim, os
AGEs diferem dos produtos da reação de Maillard, contrário
ao afirmado por Förster, Kühne, Henle [13].
Os mecanismos alternativos
da formação de AGEs
in vivo incluem as reações que conduzem
ao estresse carbonílico, nos quais a oxidação de
açúcares e/ou lipídios produz
intermediários
dicarbonílicos que se ligam a aminoácidos. As vias da
formação de AGEs não dependentes de glicose envolvem neutrófilos, monócitos
e macrófagos, que através de estímulo inflamatório excessivo desencadeado pelo receptor
de AGE (RAGE), produzem as enzimas mieloperoxidase e a NADPH oxidase, induzindo
à formação de AGEs pela oxidação de aminoácidos (5ª via) [4,11].
O
RAGE - receptor multiligante
para AGE - é um membro da superfamília das
imunoglobulinas de moléculas de superfície
celular que, pela via NADPH oxidase e associado à
sinalização inflamatória intracelular,
à geração de espécies reativas de
oxigênio e ao estresse oxidativo, promove a
formação
adicional de AGEs (6ª via) [4,10,14,15].
Através da via do poliol,
mediada pela aldose redutase, a glicose pode formar AGEs
diretamente pela 3-deoxiglicosona (7ª via), causando a depleção de NADPH e glutationa,
aumentando o estresse oxidativo e a formação de AGEs [4].
A produção intracelular
dos agentes de glicação G, MG e 3-DG prejudica
as células
por três mecanismos gerais: alteração da
função de proteínas intracelulares modificadas
por AGEs; modificação dos componentes da matriz
extracelular, provocando sinalização
e disfunção celular; e modificação de
proteínas plasmáticas pela ligação com o
RAGE
sobre células endoteliais, células mesangiais e
macrófagos, induzindo à produção
de espécies reativas de oxigênio [5]. A
formação de espécies reativas de oxigênio
também pode ser aumentada por AGEs, independente de RAGE,
através da diminuição de antioxidantes ou por derivados glicoxidantes formados intracelularmente,
gerando estresse oxidativo [4], causando a fragmentação proteica, alteração da imunogenicidade
e da atividade enzimática [10].
Os AGEs
têm sido encontrados no soro, no coração, no rim, na urina e nos alimentos. Por
causa de suas características de heterogeneidade e fluorescência ou não fluorescência,
os AGEs podem ser detectados por vários métodos analíticos.
A exemplo de medidas de CML (carboximetillisina), pelo
método de ELISA (ensaio de imunoabsorbância ligado à enzima), usando anticorpos
monoclonais específicos para cada tipo de amostra dificulta sua utilização no Brasil
por haver disponível apenas Kit para análise em sangue. Os métodos por HPLC (cromatografia
líquida de alta eficiência) e por GC-MS (cromatografia gasosa-espectrometria de
massa) baseados em mensurações de BSA (albumina sérica bovina) modificada pela glicose,
CML-BSA sintética e MG-BSA [16] precisam de tratamentos específicos para a extração
das amostras. Outro método para mensurar AGEs é a fluorescência,
mas a natureza da fluorescência pode ser muito heterogênea e não relacionada aos
produtos de glicação [11].
Estudos em humanos demonstraram
correlação significativa entre a ingestão aumentada de AGEs,
seus níveis no sangue e o aumento de marcadores inflamatórios [7]. Em experimento
com animais, a CML ingerida aumentou sua concentração plasmática 1-4 horas após
sua ingestão [17]. Assim, é preciso mais atenção ao efeito da absorção de AGEs dietéticos sobre o perfil de saúde e doença no Brasil e
no mundo.
Absorção,
ação e eliminação de AGEs
Os AGEs
ingeridos podem ser absorvidos pelo intestino ou degradados pela microbiota intestinal
para serem excretados nas fezes. Embora a excreção fecal de AGEs
seja influenciada por sua ingestão [18], a absorção de AGEs é significativa e tem
sido alvo de intensa investigação. Koschinsky et al. [19]
trataram deste assunto em humanos, relatando que aproximadamente 10% dos AGEs ingeridos
resistem ao processo digestivo, são transportados para a corrente sanguínea como
adutos de glicação, junto a peptídeos pequenos e aminoácidos presentes na digestão
e 2/3 destes AGEs absorvidos são retidos. O epitélio intestinal absorve os produtos
de Amadori, os AGEs (adutos livres) e os aminoácidos glicados
[6,12,18,19]. Alguns AGEs dietéticos isolados, como a pirralina,
podem ser absorvidos em até 80% [13], diferindo dos resultados encontrados por Koschinsky
et al. [19] para o total de AGEs.
Considerando que os AGEs são um grupo de compostos heterogêneos, vários fatores interferem
em sua absorção, tais como a solubilidade após a digestão gastrointestinal, o peso
molecular e a forma livre ou ligada à proteína [6]. Ainda não é possível concluir
o percentual de AGEs dietéticos realmente absorvido pelo
trato gastrotintestinal, que porção deste sistema seria responsável por essa absorção
e quais mecanismos estariam envolvidos neste processo.
Os AGEs
em baixas concentrações são toleráveis, mas quando em excesso são patogênicos [20].
Os AGEs realizam ligações cruzadas intra e intermoleculares,
formando estruturas estáveis com proteínas estruturais e com proteínas intracelulares,
afetando principalmente proteínas de meia-vida biológica longa. No entanto, compostos
de meia-vida curta também são glicados, como a lipoproteína de baixa densidade (LDL),
facilitando a oxidação de proteínas e lipídios, a perda da conformação molecular,
a alteração das funções proteicas, resultando em não reconhecimento pelos receptores
e clearance anormal [4,10,14,15,16,21]. Há dois grandes
mecanismos de ação dos AGEs, um deles depende da ativação
de RAGE, o que determina a disfunção celular e endotelial [14].
A expressão de RAGE está
aumentada durante a inflamação em células do músculo liso e endoteliais, macrófagos
e linfócitos, contribuindo para a aterosclerose [10,22,23].
Sugere-se que AGEs também estão associados a uma cascata
ligando inflamação, redução de glioxalase-1, acúmulo de metilglioxal e AGEs e subsequente
apoptose, além de estarem associados ao fenótipo humano de placas ateroscleróticas
propensas a ruptura [24].
O turnover de AGEs é regulado em parte por receptores, que participam da degradação
de proteínas modificadas pela glicação, provocando sua excreção renal. Entretanto,
esses receptores são ineficientes em condições de estresse oxidativo [4,16,19,21].
Os receptores relacionados
à detoxificação de AGEs e à supressão do estresse oxidativo
e da inflamação, representados por AGER1, AGER2, AGER3 são considerados receptores
scavenger. Entretanto, AGER2 e AGER3 têm sido menos investigados [4].
Apenas cerca de 30% dos
AGEs absorvidos são excretados pelos rins em até 48 horas
nos pacientes diabéticos com função renal normal, mas na ocorrência simultânea de
diabetes e insuficiência renal, essa excreção pode ser ainda menor, não alcançando
5% dos AGEs absorvidos [10,18,21]. Assim, uma fração importante dos AGEs dietéticos são acumulados em diferentes tecidos, tais como
o cardíaco, o hepático e o renal [10,18].
Os níveis de AGEs circulantes refletem o balanço da ingestão oral, da formação
endógena e do seu catabolismo, o qual depende da eliminação renal e da degradação
tecidual [25]. Além dos receptores scavenger, sistemas protetores intracelulares
(glioxalase e lisozima) também limitam o acúmulo de agentes de glicação, tais como
o metilglioxal, formadores de AGEs [21]. Como consequência,
a saturação desses mecanismos de detoxificação de AGEs
estimula alterações no sistema cardiovascular que, associadas à cronicidade, contribuem
para a aterogênese.
AGEs e aterosclerose
No sistema cardiovascular,
a interação AGE-RAGE pode mediar a ativação celular, levando
ao estresse oxidativo; pode conduzir à inflamação prolongada e induzir à expressão
de moléculas de adesão, em um modo dependente de RAGE [20,23].
A interação AGE-RAGE ativa
a transcrição do fator nuclear-kB (NF-kB),
que no núcleo celular aumenta a transcrição de selectina-E, endotelina-1, vascular
endothelial growth fator (VEGF), moléculas de adesão (ICAM-1 e VCAM-1) e mediadores
inflamatórios (TNF-α, IL-1α, IL-1β, IL-6), aumentando também a expressão
do próprio RAGE. Em humanos, a ingestão de AGEs tem proporção
direta com os níveis sanguíneos de TNF-α e VCAM-1 [7,10,14,22].
No
endotélio, a interação
AGE-RAGE aumenta a permeabilidade das células e o trânsito
de macromoléculas através
da perda de estruturas organizadas de actina e alterações
de morfologia celular.
Além disso, depleta os mecanismos de defesa antioxidante celular
(glutationa e vitamina
C) e induz à geração de espécies reativas
de oxigênio intracelulares, associando-se
à ativação do sistema NADPH oxidase [22,23]. Os
efeitos da interação AGE-RAGE e
da glicação de proteínas são ainda mais
evidentes nas complicações macro e microvasculares
de pacientes diabéticos [11].
Em indivíduos diabéticos,
altos níveis de AGEs teciduais correlacionam-se aos AGEs
plasmáticos e, independente dos fatores de risco cardiovascular, associam-se à morbimortalidade
por eventos cardiovasculares [26].
No diabetes e no envelhecimento,
ocorre acúmulo de produtos de glicação, resultando em elasticidade arterial diminuída
e disfunção endotelial, através do aumento da ligação cruzada do AGE com o colágeno
e a elastina vasculares [4,11,14,20,27].
Os AGEstambém
prejudicam a função vascular por diminuir o óxido
nítrico (NO) e a prostaciclina
e por induzir à expressão de endotelina-1, aumentando a
proliferação das células
do músculo liso vascular e a rigidez do vaso, predispondo
à vasoconstrição e à hipertensão
arterial sistêmica [4,10,20,27,28].
O NO é sintetizado no
endotélio a partir do aminoácido arginina pela enzima óxido nítrico sintase. O metilglioxal
em excesso reage preferencialmente com a arginina, formando os AGEs argpirimidina e hidroimidazolona, identificáveis no soro
e no rim humanos, diminuindo a arginina disponível para a síntese do NO [20].
Além
de vasodilatador,
o NO inibe a agregação plaquetária, a
migração e a proliferação de células
do músculo
liso, a expressão de moléculas de adesão, a
adesão de monócitos e atua na excreção
de água e de sódio nos rins. Alteração
nesse metabolismo do NO concorre para a disfunção
endotelial, a hipertensão arterial sistêmica e a
aterosclerose [20). Além da inibição do NO, os AGEs estão envolvidos na glicação
da LDL.
A glicação da LDL aumenta
sua susceptibilidade às alterações oxidativas e funcionais em proporção direta à
hiperglicemia e à ingestão de AGEs [7,22]. A glicação não
enzimática de proteínas, lipoproteínas e componentes da matriz extracelular está
associada à peroxidação lipídica, facilitando a dislipidemia [4].
A LDL glicada sofre modificação
em sua conformação e redução do reconhecimento por seus receptores hepáticos, aumentando
os níveis séricos da LDL glicada e/ou oxidada. Esta LDL modificada é mais facilmente
captada por receptores scavenger em macrófagos e células do músculo liso vascular,
havendo resposta inflamatória, formação e acúmulo de células espumosas [4,21,23].
Pela presença da LDL modificada,
há a quimiotaxia de monócitos às células endoteliais, a proliferação e o espessamento
da íntima e a inibição do reparo vascular após a lesão, reduzindo a luz arterial,
o que é agravado pelo comprometimento de sua capacidade vasodilatadora [4,21].
In vivo, os efeitos do
crescimento das células do músculo liso são provavelmente mediados por citocinas
ou fatores de crescimento induzidos por AGEs em fagócitos
mononucleares [22].
In
vitro, a lipoproteína
de alta densidade (HDL) também é alvo da
peroxidação lipídica e da glicação
(Gly-ox-HDL).
A glicação acarreta modificações nas
propriedades físico-químicas, estruturais e
funcionais da apolipoproteína da superfície da HDL [29].
Ao sofrer essas mudanças,
a HDL perde suas propriedades citoprotetoras e
anti-inflamatórias [30], suprimindo
a captação do éster de colesterol da HDL pelo
receptor scavenger B1 no fígado e
o efluxo do colesterol das células periféricas mediado
por este receptor [20].
As LDL e HDL glicadas
ou oxidadas, a ligação cruzada dos AGEs com proteínas da
parede do vaso, a redução do NO e a interação AGE-RAGE contribuem para a formação
de lesões importantes para a aterogênese (figura 1).
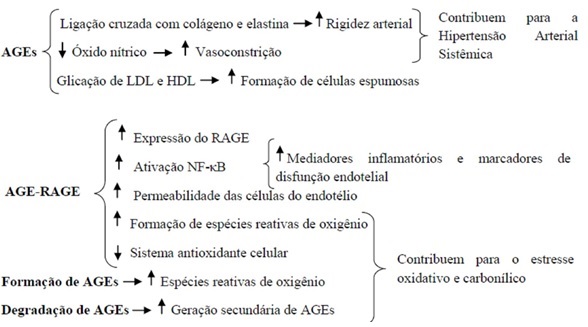
AGEs = Produtos de glicação
avançada; RAGE – Receptor para AGEs; LDL = Lipoproteína de baixa densidade; HDL
= Lipoproteína de alta densidade; NF-kB = Fator nuclear kappa
B.
Figura 1 – Efeito dos AGEs e da
interação AGE-RAGE sobre a vasculatura.
A maioria dos eventos
acima citados pode ocorrer como consequência da ingestão aumentada de AGEs dietéticos. Após as refeições e no diabetes, a ingestão
aumentada de AGEs dietéticos associa-se ao aumento de AGEs
séricos, de RAGE, de estresse oxidativo celular e de marcadores inflamatórios, diminuição
de AGER1 e prejuízo da função endotelial, quando comparada a uma refeição com baixo
teor de AGEs, que repercute em menos lesão vascular e renal [4,16,31].
AGEs dietéticos
A dieta, fonte exógena
mais importante de AGEs, e o fumo têm impacto nas DCV.
A temperatura e o método de cocção de alimentos, com perda de umidade, são fatores
mais críticos para a formação dos AGEs que o tempo de processamento,
contudo, estas condições são empregadas por conferir sabor e aroma agradáveis. Tais
fatores influenciam a geração de AGEs em proporção direta
à temperatura e à duração do aquecimento dos alimentos, à perda de umidade, à faixa
de pH do neutro ao alcalino e à presença de grupos reativos na composição dos alimentos
[10,11,12,32]. Os níveis de AGEs,
expressos em teores de
CML, pelo método ELISA, em alimentos submetidos a diferentes
métodos de cocção,
por calor seco, mostram uma tendência de maior teor de AGEs
diretamente proporcional
à temperatura e à desidratação, em
alimentos contendo lipídeos e proteínas, na seguinte
ordem: fritura a 230°C > fritura a 180°C; grelhado a
225°C > assados a 177°C.
Alimentos cozidos a @100°C por tempos curtos
e com alto teor de água, como ferver e cozinhar a vapor, contêm menor quantidade
de AGEs; por exemplo, um frango cozido a 100°C por 1 hora
tem 5 vezes menos AGEs que o mesmo item processado a 230°C por 15 minutos [4,10,12,32].
A dieta rica em alimentos
fontes de lipídeos e proteínas, processados a altas temperaturas, como na cocção
de carnes, promove a geração de AGEs por causa dos radicais
livres formados em reações de lipoxidação [32,33]. Esta afirmativa é contestada
por Assar et al. [34] que encontraram maiores teores de
AGEs em alimentos com alto teor de carboidratos e proteínas, podendo ser uma questão
de ordem analítica. Atualmente, diferentes metodologias direcionadas à avaliação
de AGEs em alimentos estão disponíveis, não havendo consenso
a respeito de que método seria capaz de identificar e quantificar de maneira fidedigna
AGEs totais, AGEs específicos e intermediários potencialmente reativos para a formação
de AGEs, presentes em diferentes tipos de amostras. Apesar disso, as características
dietéticas que contribuem para o aumento da formação de AGEs
em alimentos estão evidentes e bem consolidadas.
Em
molhos e alimentos
proteicos como o peixe, a oxidação lipídica e a
reação de Maillard estão interligadas
através da presença de proteínas,
açúcares redutores – glicose e frutose – e
produtos
da oxidação de ácidos graxos poliinsaturados,
associados ao aquecimento severo,
aumentando a formação de AGEs [35].
O consumo diário de frituras
e/ou grelhados, pelo alto teor de AGEs, facilita a aterogênese
por saturar o mecanismo natural de defesa anti-AGE [4], podendo induzir a semanas
ou meses de disfunção endotelial persistente e contribuir para o desenvolvimento
da aterosclerose [31]. Alimentos como hortaliças, frutas e cereais apresentam baixos
níveis de AGEs, exceto quando processados com calor seco
e com adição de ingredientes como manteiga, óleo, queijo, ovos e nozes, apresentando
neste último caso maior quantidade de AGEs, contudo os teores de AGEs ainda estarão
abaixo daqueles presentes em carnes [32]. As fórmulas infantis contêm níveis de
AGEs 100 vezes maiores que o leite humano ou leite bovino
[10,32,33]. No leite, o processo de pasteurização forma menos AGEs quando comparado aos processos de esterilização e desidratação
[36]. Carnes, queijo parmesão, manteiga e margarina, pelo teor de AGEs e por representarem ingredientes para alimentação moderna
no mundo ocidental, contribuem bastante para o consumo aumentado de AGEs [30]. Através
do conhecimento das fontes dietéticas de AGEs,
estratégias
de redução do consumo desses produtos de
glicação podem ser incorporadas nas
intervenções
terapêuticas para a aterosclerose.
Intervenções
terapêuticas
A
dietoterapia deve sempre
ser adotada no tratamento da aterosclerose. As correções
no estilo de vida – perda
de peso, atividade física e cessação do tabagismo
– também têm significativa influência
nas DCV [2]. Estratégias de intervenção
dietética têm sido centradas em nutrientes
e restrição calórica. Mesmo sabendo que a
restrição calórica reduz os níveis
séricos
de AGEs, há uma atual necessidade de estudos de longo prazo
com maior amostra de pacientes utilizando dieta com restrição de AGEs para alívio
do estado pró-inflamatório. Os achados científicos existentes mostram a restrição
de AGEs e o controle dos métodos de processamento de alimentos
como estratégias dietéticas promissoras, sendo preciso que essas estratégias sejam
recomendadas [7,12,37,38].
As
diretrizes atuais para
prevenir a morbimortalidade associada às dislipidemias e
à aterosclerose recomendam
redução de açúcar simples, álcool,
ácidos graxos saturados e trans, da relação
ômega
6/ômega 3 e aumento do consumo de fibras, fitoesteróis,
ácidos graxos mono e poli-insaturados, não se referindo às recomendações dietéticas
dos produtos de glicação das proteínas. Os ácidos graxos essenciais ômega 3 têm propriedades hipotrigliceridêmicas, anti-inflamatórias
e antitrombóticas quando consumidos em alimentos crus ou submetidos a temperaturas
em torno de 100°C [2,3]. A American Heart Association e a American Diabetic Association
aprovaram dietas com baixo teor de gordura e carboidrato, balanceadas com conteúdo
vitamínico incluindo suplementos de tiamina, folato e vitamina B6 por causa de suas
propriedades antioxidantes [7].
Apesar dos efeitos evidentes
dos AGEs no comprometimento da saúde humana, as recomendações
da restrição de AGEs são limitadas. Contudo, existe uma tendência para pesquisas
sobre compostos anti-AGE e/ou antioxidantes alimentares, potenciais facilitadores
do controle do pool corporal de AGEs, como ácido lipoico,
vitaminas C e E [20], compostos fenólicos [20,39,40,41], carnosina [42], ácido gálico
[43], cisteína [44], piridoxamina [45], café prata [46], óleo de oliva [47] e limoneno
[48].
Os antioxidantes e os
sequestradores de AGEs, para agirem no organismo, precisam
ser hidrolisados e estar disponíveis para a absorção [30].
Novas
estratégias de controle
da aterogênese precisam ser focalizadas não só na
redução da hiperglicemia, da hipertrigliceridemia,
do estresse oxidativo e carbonílico, mas também na
prevenção do aumento de AGEs séricos e da disfunção endotelial [2,3,9]. A diminuição
de aproximadamente 50% na ingestão de AGEs dietéticos contribui
para a redução do dano tecidual, da inflamação vascular e da aterogênese. Ao restringir
o consumo dos alimentos processados a altas temperaturas, reduzem-se a ingestão
de AGEs, os níveis de AGEs circulantes e teciduais e o
estresse oxidativo sistêmico, resultando em preservação das reservas antioxidantes,
redução dos níveis de citocinas inflamatórias, prevenção do aumento excessivo de
peso e de doenças relacionadas ao envelhecimento como o diabetes, as DCV e a doença
renal crônica [4,16,21]. A intervenção dietética consiste no consumo de alimentos
com teor menor de AGEs e de lipídeos aterogênicos, na prevenção
de picos hiperglicêmicos e no uso de técnicas culinárias com menor produção de AGEs
(ferver, cozinhar ou ensopar). Isto pode representar uma alternativa eficaz de prevenção
de doenças crônicas, através da redução da formação de AGEs
e da perda de vitaminas com propriedades antioxidantes e anti-AGE [7,11,31].
Concordando com diversos
estudos, é indicado o consumo reduzido de alimentos ricos em lipídeos e proteínas
como carnes submetidas a temperaturas acima de 120ºC, evitando para tal frituras, assados, grelhados, queijo parmesão ralado, manteiga,
margarina [12,32] e molhos contendo açúcares redutores por causa da oxidação lipídica
e da reação de Maillard [33,35]; além da inclusão de frutas e hortaliças ricas em
fibras, minerais, vitaminas e fitoquímicos [2,39]; e o consumo preferencial de leite
e derivados desnatados, grãos integrais e peixes cozidos [33], que devem ser incluídos
na intervenção terapêutica e na prevenção da aterosclerose.
Conclusão
A abordagem terapêutica
na prevenção e no tratamento da aterosclerose tem apresentado avanços, apesar disso,
existem aspectos relevantes para a doença que precisam ser considerados, a exemplo
da glicação e seus produtos que atuam claramente no desenvolvimento dessa doença.
O controle da ingestão dos produtos de glicação da dieta reduz o pool corporal de
AGEs, a inflamação, o estresse oxidativo, a disfunção endotelial
persistente e o desenvolvimento da aterosclerose, contribuindo para a menor morbimortalidade
associada às complicações vasculares, geralmente relacionadas a doenças como diabetes
e hipertensão arterial sistêmica. Dietas com reduzidos teores de AGEs constituem estratégias promissoras para a otimização das
dietoterapias relacionadas à aterosclerose.
Referências
- Soares GP, Klein CH, Silva
NAS, Oliveira GMM. Evolução da mortalidade por doenças do aparelho circulatório
nos municípios do Estado do Rio de Janeiro, de 1979 a 2010. Arq Bras Cardiol 2015;104(5):356-65.
- Sociedade Brasileira de
Cardiologia. V Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose.
Arq Bras Cardiol 2013;101(4Supl1):1-22.
- Sociedade Brasileira de
Cardiologia. I Diretriz sobre o Consumo de Gorduras e Saúde Cardiovascular. Arq Bras Cardiol 2013;100(1Supl3):1-40.
- Monnier VM. Intervention against the Maillard reaction
in vivo. Arch Biochem Biophys 2003;419(1):1-15.
- Brownlee M. Biochemistry and molecular cell biology of diabetic complications. Nature 2001;414(13):813-20.
- Delgado-Andrade C. Maillard reaction products: some considerations on their
health effects. Clin Chem Lab Med 2014;52(1):53-60.
- Vlassara H, Cai W, Crandall J, Goldberg T, Oberstein R, Dardaine V et al.
Inflamatory mediators are induced by dietary glycotoxins, a major risk factor for
diabetic angiopathy. Proc Natl Acad Sci 2002;99(24):15596-601.
- Kerkenia M, Weissb IS, Jaissonb S, Dandanad A, Addade F, Gilleryb P et al.
Increased serum concentrations of pentosidine are related to presence and severity
of coronary artery disease. Thrombosis Research 2014;134(3):
633-8.
- Shibao J, Bastos DHM.
Produtos da reação de Maillard em alimentos: implicações para a saúde. Rev Nutr 2011; 24(6):895-904.
- Negrean M. Advanced glycation endproducts (AGE) and their role in the pathogenesis
of chronic complications of diabetes mellitus. MÆDICA
A journal of clinical medicine 2006;1(2):59-66.
- Barbosa JHP, Oliveira
SL, Seara LT. O papel dos produtos finais de glicação avançada (AGEs) no desencadeamento das complicações vasculares do diabetes.
Arq Bras Endocrinol Metab 2008;52(6):940-50.
- Barbosa JHP, Oliveira
SL, Seara LT. Produtos da glicação avançada (AGEs) dietéticos
e as complicações do diabetes. Rev Nutr 2009;22(1):113-24.
- Förster A, Kühne Y, Henle T. Studies on the absorption and elimination of
dietary Maillard reaction products. Ann N Y Acad Sci 2005;1043:474-81.
- Goh S, Cooper ME. The role of advanced glication end products
in progression and complications of diabetes. J Clin Endocrinol Metab 2008;93(4):1143-52.
- Semba RD, Nicklett EJ, Ferrucci L. Does Accumulation of Advanced Glycation End Products Contribute to the Aging
Phenotype? J Gerontol A Biol Sci Med Sci 2010;65A(9):963-75.
- Cai W, He JC, Zhu L, Chen X, Zheng F, Striker GE et al. Oral glycotoxins
determine the effects of calorie restriction on oxidant stress, age-related diseases,
and lifespan. Am J Pathol 2008;173(2):327-36.
- Alamir I, Niquet-Leridon C, Jacolot P, Rodriguez C, Orosco M, Anton PM et
al. Digestibility of extruded proteins and metabolic transit of Nε-carboxymethyllysine
in rats. Amino
Acids 2013; 44:1441-9.
- Roncero-Ramos I, Delgado-Andrade
C, Tessier FJ, Niquet-Léridon C, Strauch C, Monnier VM et
al. Metabolic transit of Nε-carboxymethyl-lysine
after consumption of AGEs from bread crust. Food Funct 2013;4:1032-9.
- Koschinsky T, He C, Mitsuhashi T, Bucala R, Liu C, Buenting
C et al. Orally absorbed reactive glycation products (glicotoxins): an environmental
risk factor in diabetic nephropathy. Proc Natl Acad Sci U S A 1997;94(12):6474-9.
- Vasdev S, Gill V, Singal P. Role of advanced glycation end products in hypertension
and atherosclerosis: therapeutic implications. Cell Biochem Biophys 2007;49:48-63.
- Vlassara H, Palace MR. Glycoxidation: The menace of diabetes and aging. Mt
Sinai J Med 2003;70(4):232-41.
- Basta G, Schmidt AM, Caterina R. Advanced glycation end products and vascular
inflammation: implications for accelerated atherosclerosis in diabetes. Cardiovasc
Res 2004;63(4):582-92.
- Basta G. Receptor for advanced glication endproducts and atherosclerosis:
from basics mechanisms to clinical implications. Atherosclerosis 2008;196:9-21.
- Hanssen NMJ, Wouters K, Huijberts MS, Gijbels MJ, Sluimer JC, Scheijen JLJM
et al. Higher levels of advanced glycation endproducts in human carotid atherosclerotic
plaques are associated with a rupture-prone phenotype. Eur Heart J 2014;35(17):1137-46.
- Peppa M, Uribarri J, Vlassara H. The role of advanced glycation
end products in the development of atherosclerosis. Current Diabetes Reports
2004;4:31-6.
- Nin JW, Jorsal A, Ferreira I, Schalkwijk CG, Prins MH, Parving H et al. Higher
plasma levels of advanced glycation end products are associated with incident cardiovascular
disease and all-causemortality in type 1 diabetes. Diabetes Care 2011;34:442-7.
- Sourris KC, Lyons JG, Dougherty SL, Chand V, Straznicky NE, Schlaich MP,
et al. Plasma advanced glycation end products (AGEs) and NF-kB activity are independent determinants of diastolic and pulse pressure.
Clin Chem Lab Med 2014;52(1):129-38.
- Huang Q, Sheng C, Liu M, Li F, Li Y, Wang J. Arterial stiffness and wave
reflections in relation to plasma advanced glycation end products in a chinese population. Am J Hypertens 2013;26(6):754-61.
- Ferretti G, Bacchetti T, N`Egre-Salvayre A, Salvayre R, Dousset N, Curatola
G. Structural modifications of HDL and functional consequences. Atherosclerosis 2006;184:1-7.
- Bengmark S, Gil A. Productos
finales de la glicación y de la lipoxidación como amplificadores
de la inflamación: papel de los alimentos. Nutr Hosp 2007;22(6):625-40.
- Negrean M, Stirban A, Stratmann B, Gawlowski T, Horstmann T, Götting C et
al. Effects of low- and high-advanced glycation endproduct meals on macro- and microvascular
endothelial function and oxidative stress in patients with type 2 diabetes mellitus.
Am J Clin Nutr 2007;85:1236-43.
- Uribarri J, Woodruff S, Goodman S, Cai W, Chen X, Pyzik R et al. Advanced
glycation end products in foods and a pratical guide to their reduction in the diet.
J Am Diet Assoc 2010;110:911-6.
- Goldberg T, Cai W, Peppa M, Dardaine V, Baliga BS, Uribarri J et al. Advanced
glycoxidation end products in commonly consumed foods. J Am Diet Assoc 2004;104(8):1287-91.
- Assar SH, Moloney C, Lima M, Magee R, Ames JM. Determination of Nε-(carboxymethyl)lysine
in food systems by ultra performance liquid chromatography-mass spectrometry. Amino
Acids 2009;36:317-26.
- Chao P, Hsu C, Yin M. Analysis of glycative products in sauces and sauce-treated
foods. Food
Chemistry 2009;113:262-6.
- Andrade KQ, Ferreira RC,
Seara LT. Danos proteicos durante o processamento do leite e sua repercussão na
saúde. Nutrição Brasil 2014;13(1):48-54.
- Kellow NJ, Savige GS. Dietary advanced
glycation end-product restriction for the attenuation of insulin resistance, oxidative
stress and endothelial dysfunction: a systematic review. European Journal of Clinical
Nutrition 2013;67:239-48.
- Rodríguez JM, Balich LL, Concha MJ, Mizón C, Barnett DB, Acevedo GB, et al.
Reduction of serum advanced glycation end-products with a low calorie Mediterranean
diet. Nutr Hosp 2015;31(6):2511-7.
- Liu L, Xie Y, Song Z, Shang S, Chen X. Influence of dietary flavonoids on
the glycation of plasma proteins. Mol BioSyst 2012;8:2183-7.
- Harsha PSCS, Lavelli V, Scarafoni A. Protective ability of phenolics from
white grape vinification by-products against structural damage of bovine serum albumin
induced by glycation. Food Chemistry 2014;156:220-6.
- Vlassopoulos A, Lean MEJ, Combet E. Protein–phenolic interactions and inhibition
of glycation – combining a systematic review and experimental models for enhanced
physiological relevance. Food Funct 2014;5:2646-55.
- Brown BE, Kim CHJ, Torpy FR, Bursill CA, McRobb LS, Heather AK et al. Supplementation
with carnosine decreases plasma triglycerides and modulates atherosclerotic plaque
composition in diabetic apo E_/_ mice. Atherosclerosis 2014;232:403-9.
- Umadevi S, Gopi V, Elangovan V. Regulatory mechanism of gallic acid against
advanced glycation end products induced cardiac remodeling in experimental rats.
Chem Biol Interact 2014;208:28-36.
- Mahdavifarda S, Bathaiea SZ, Nakhjavanib M, Heidarzadeh H. L-cysteine is
a potent inhibitor of protein glycation on both albumin and LDL, and prevents the
diabetic complications in diabetic–atherosclerotic rat. Food Research International
2014;62:909-16.
- Sadowska-Bartosz I, Bartosz G. Prevention of Protein Glycation by Natural
Compounds. Molecules
2015;20:3309-34.
- Mesías M, Navarro M, Martinez-Saez
N, Ullate M, Castillo MD, Morales N et al. Antiglycative and carbonyl trapping properties of the water soluble fraction
of coffee silverskin. Food Research International 2014;62:1120-6.
- Navarro M, Fiore A, Fogliano V, Morales FJ. Carbonyl trapping and antiglycative
activities of olive oil mill wastewater. Food Funct 2015;6:574-83.
- Joglekar MM, Panaskar SN, Chougale AD, Kulkarni MJ, Arvindekar AU. A novel mechanism for antiglycative action of limonene through stabilization
of protein conformation. Mol BioSyst 2013;9:2463-72.