ARTIGO
ORIGINAL
Avaliação
microbiológica de fórmulas infantis para lactentes comercializadas em
Joinville/SC
Microbiological assessment of infant formulas sold in Joinville/SC
Beatriz Granza de Mello*, Tânia Regina de Oliveira Rosa, M.Sc.**
*Nutricionista
formada pela Associação Educacional Luterana Bom
Jesus/IELUSC, pós graduanda em Nutrição Funcional pela Unyleya,
**Mestre em Ciências Farmacêuticas. Docente do curso de Nutrição da Associação
Educacional Luterana Bom Jesus/IELUSC
Recebido 14 de
dezembro de 2016; aceito 15 de junho de 2018.
Correspondência: Beatriz Granza de Mello, Rua Belém do Pará, 252, Aventureiro,
Joinville/SC, E-mail: beatriz_g_mello@hotmail.com; Tânia Regina de Oliveira
Rosa: taniarptof@gmail.com
Resumo
Em virtude de sua
imaturidade imunológica o recém-nascido se torna mais vulnerável a infecções,
estando ainda mais expostos a possíveis contaminações em fórmulas infantis. O
objetivo deste trabalho foi analisar microbiologicamente
fórmulas infantis de partida e comparar os resultados às recomendações da
resolução RDC nº12 de 2001 da Anvisa. Foram adquiridas
9 fórmulas de partida; 4 para lactentes saudáveis, 3 antirrefluxo e 2 de soja. O perfil microbiológico foi
realizado por cultura em placas de ágar sangue, MacConkey
e chocolate, além de provas confirmatórias. Observou-se crescimento de
bactérias como Escherichia coli, Enterococcus sp,
Streptococcus sp, Staphilococcus sp, Salmonella sp e fungo Aspergillus sp. Das 9
fórmulas, apenas duas (22,22%) podem ser consideradas dentro dos padrões da
resolução citada. Assim, fica clara a importância do correto processamento e
manipulação destes produtos para prevenir surtos infecciosos e garantir a
proteção dos lactentes.
Palavras-chave: fórmulas infantis, microorganismos, recém-nascido.
Abstract
Because of immune immaturity the newborn is more vulnerable to
infections, being more expose to possible formula contaminations. The objective
of this study was to analyze from the microbiological view samples of starting
infant formulas sold at Joinville/SC and compare it to the Anvisa’s
resolution RDC nº12/2001 parameters. We acquired 9 starting formulas; 4 for
healthy infants, 3 for antireflux and 2 made of soy.
The microbiological profile was performed in blood, MacConkey
and chocolate cultures and confirmative proves. We observed bacterias
as Escherichia coli, Enterococcus sp, Streptococcus sp, Staphilococcus sp, Salmonella sp e fungus Aspergillus sp.
From the 9 formulas, only two of them (22,22%) could
be considered in accordance to the resolution. These results turn clear the
importance of a correct manipulation and making process to avoid infections and
to make effective the new born protection.
Key-words: infant
formula, microorganisms, newborn.
Introdução
A amamentação
equivale a uma das mais precoces experiências nutricionais do bebê e nenhum
alimento ou leite industrializado e modificado consegue oferecer todos os
ingredientes e benefícios do leite materno, apesar disso, inúmeras crianças
necessitam de alternativas seguras [1].
O aleitamento materno
é recomendado pelo Ministério da Saúde como fonte de alimentação exclusiva do
recém-nascido (RN) até os 6 meses e complementado até
os dois anos ou mais. Porém, diante da impossibilidade da amamentação
utilizam-se fórmulas infantis (FI) que busquem atender às suas necessidades;
para crianças menores de 6 meses são utilizadas
fórmulas de partida e, a partir disso, de segmento [2].
Segundo a Agência
Nacional de Vigilância Sanitária (ANVISA), FI de partida para lactentes é o
produto, em forma líquida ou em pó, utilizado sob prescrição, especialmente
fabricado para satisfazer, por si só, as necessidades nutricionais dos
lactentes sadios durante os primeiros 6 meses de vida
(5 meses e 29 dias). Estas podem ser de origem animal ou vegetal (soja) e as FI
de origem animal podem ser hidrolisadas, antirregurgitação
ou isentas de lactose [3,4].
As FI usuais são
criadas a partir de modificações industriais no leite bovino ou de outros
mamíferos para que se assemelhem ao leite materno. Contudo, sua composição é
fixa, diferente da do leite humano, que sofre pequenas adaptações de acordo com
mãe e filho [5].
As fórmulas à base de
soja são indicadas em casos de intolerância à lactose, galactosemia
e alergia à proteína do leite de vaca (APLV) [6]. Apesar de ser amplamente
indicada a crianças com APLV, em 2010, a Organização Mundial de Alergias (OMA)
divulgou um documento no qual desaconselha o uso de soja para crianças menores
de 6 meses devido aos riscos a reações adversas, sendo
recomendada aos lactentes alérgicos o uso de fórmulas extensamente hidrolisadas
que, além de serem utilizadas nestes casos, também são indicadas em casos
síndromes disabsortivas, hipoalbuminemia,
transição de nutrição parenteral para enteral e na realimentação de pacientes
críticos [4,7].
Fórmulas antirregurgitamento são recomendadas para o tratamento não
medicamentoso do refluxo gastro-esofágico e possuem,
usualmente, amido em sua composição, que gera espessamento quando em contato
com o suco gástrico [8].
A lactose é o principal
carboidrato do leite e das fórmulas. Geralmente, nos leites sem lactose, este
carboidrato é substituído por hidratos de carbono. Estas FI são indicadas para
lactentes que possuem deficiência primária de lactase,
lesão da mucosa intestinal, desnutrição grave ou má absorção de lactose [4].
Durante os processos
de produção, elaboração, transporte e armazenamento, qualquer alimento ou
produto alimentício fica vulnerável a contaminações físicas, químicas e
microbiológicas, que quando protagonizadas por microorganismos
(MO) patogênicos não causam nenhuma alteração nas características habituais,
sendo quase impossível a identificação à olho nu [9].
Particularmente, as FI’s oferecem excelente substrato
para o desenvolvimento de MO, pois constituem um ambiente rico em nutrientes,
gorduras e carboidratos [10].
Em virtude de sua
imaturidade imunológica, o RN se torna mais vulnerável a infecções, sendo
imprescindível a proteção conferida pelo aleitamento materno. Essa fragilidade
torna-os ainda mais expostos a possíveis contaminações em fórmulas, que por ser
fonte exclusiva de nutrição nos primeiros 6 meses, é
consumida em elevada quantidade, criando a possibilidade de que uma pequena
quantidade de MO cause alguma patologia [1,11].
O objetivo deste trabalho
foi analisar microbiologicamente amostras de FI de
partida comercializadas na cidade de Joinville/SC e comparar os resultados às
recomendações da resolução RDC nº12 de 2001 da ANVISA [12]. Para a pesquisa
foram selecionadas fórmulas de partida à base de soja, antirregurgitação
e para lactentes saudáveis.
Material
e métodos
Trata-se de um estudo
experimental, observacional e analítico realizado no Laboratório de
Microbiologia Geral e de Alimentos, da faculdade de Nutrição da Associação Educacional
Luterana Bom Jesus/IELUSC na unidade Saguaçu III. Para o desenvolvimento do estudo foram
adquiridas 9 fórmulas de partida; 4 para lactentes
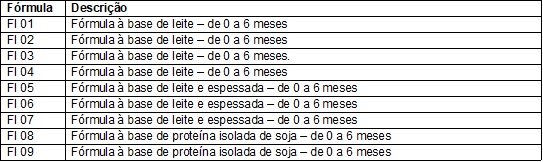
saudáveis, 3 antirrefluxo e 2 de soja (Quadro 1).
Quadro
1 – Descrição das FI utilizadas no estudo.
O perfil
microbiológico das amostras foi efetivado por cultura em placas de ágar sangue,
MacConkey, chocolate e meios bioquímicos
confirmatórios segundo a metodologia de Mortimore e
Wallace [13]. A preparação da amostra foi realizada com a dissolução de 1 medida no medidor padrão de cada marca para 30 mL de água esterilizada (redução proporcional do indicado
nas embalagens).
Foram realizadas duas
amostras com diferentes lotes (20/09 e 25/09), utilizando-se de materiais
previamente esterilizados em autoclave, ao redor de halo estéril. Logo em
seguida, as amostras foram alocadas em estufa à 36º C e acompanhadas durante o
período de 72 horas.
Todos os resultados
foram expressos em unidades formadoras de colônias por mL
(UFC/mL), os dados obtidos foram tabulados em
planilhas do Microsoft Excel 2016®, representados em tabelas no mesmo programa
e comparados à RDC nº12/2001 da Anvisa.
Resultados
Após realizadas as
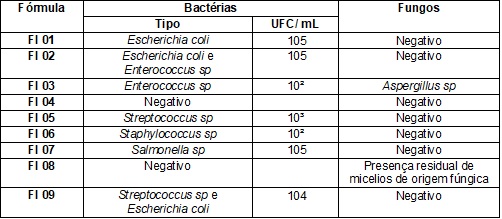
análises, pode-se perceber o mesmo padrão nas duas coletas, desta forma os
resultados foram representados apenas no Quadro 2, onde observou-se bactérias
como Escherichia coli, Enterococcus sp, Streptococcus sp, Staphilococcus sp, Salmonella sp e o fungo Aspergillus sp.
A única fórmula que
apresentou resultados negativos tanto para crescimento bacteriano quanto para o
fúngico foi a FI 04. Na FI 08 não foram encontradas
bactérias, porém, houve sinal de presença residual de micélios de origem fúngica.
Quadro
II –
Resultados das duas análises
microbiológicas.
Das 9 fórmulas analisadas, apenas duas (22,22%) podem ser
consideradas dentro dos padrões estabelecidos pela resolução RDC 12/2001 da
ANVISA [12]. As 7 restantes (77,78%), segundo esta
resolução, não seriam adequadas para o consumo.
Discussão
A Anvisa
estabelece um limite máximo aceitável de contaminação microbiológica para
fórmulas infantis em pó ou reconstituídas através da resolução RDC nº12/2001;
10 coliformes a 35°C/mL de amostra indicativa, Bacilo cereus/g
(mL) a 10², Staphylococcus coagulase-positiva/g
(mL) e Salmonella sp/25g (mL) ausentes [12].
Em um estudo
realizado por Rossi, Kabuki e Kuaye [14] foram
analisadas 5 fórmulas em pó e reconstituídas em um
lactário. Todas as amostras em pó estavam em concordância com a RDC da ANVISA,
enquanto as reconstituídas encontravam-se com
contagens elevadas de microorganismos mesófilos
totais. Santos [15], nos lactários de quatro hospitais de Campinas, encontrou amostras reconstituídas contaminadas com Enterobacter sakazakii, Bacillus cereus e
bactérias do grupo coliforme.
Segundo a RDC nº 12
de 2001 [12] não devem haver contagens de Staphylococcus
nas FI, porém, neste trabalho foram encontradas contagens de 10² UFC/mL. Linhares [16], em pesquisa realizada em lactário de um
hospital infantil, encontrou contaminações de Staphylococcus aureus em duas fórmulas reconstituídas
e relacionou este à falta de higiene durante a manipulação destas.
A Staphylococcus aureus é uma bactéria gram positiva que produz uma toxina altamente termoestável
que causa patologias em humanos, para isto, são necessárias entre 105
e 106 UFC/g, sendo fundamental o controle de fatores que estão
diretamente ligados à multiplicação da bactéria, como temperatura e tempo de
exposição [17].
Na fórmula FI 07 foram
encontradas Salmonella sp,
enquanto, segundo a resolução nº12 de 2001 [12], as FI deveriam ser ausentes
deste MO.
A Salmonella, principalmente a
entérica, é um dos patógenos mais preocupantes associado
às FI, visto que existem várias evidências que o resultado para uma
contaminação por este MO pode resultar em patologias graves, como a febre
tifoide, febre entérica e salmoneloses [18].
Segundo o rótulo,
para reconstituir as FI’s, deve-se aquecer a água,
sem ferver, à uma temperatura de 70ºC e deixar perder
temperatura naturalmente antes de oferecer ao lactente, porém, estudos
demonstraram que tratamentos térmicos com temperaturas entre 60 e 70º C por 5
ou 10 minutos não são suficientes para eliminar uma contaminação de 106
UFC/mL de Salmonella sp (valor próximo ao encontrado neste estudo; 105
UFC/mL) [18,19].
A Escherichia coli é uma bactéria do grupo
dos coliformes fecais, que são indicadores de contaminação fecal durante o
processamento ou manuseio. A E. coli é o melhor indicador deste tipo de contaminação por
estar presente tanto em fezes humanas quanto em de animais. É uma bactéria
patogênica que causa dores abdominais, diarreias (às vezes hemorrágicas), febre
e vômitos [20].
Em outra pesquisa
realizado em lactário, os autores verificaram que 3
das fórmulas analisadas estavam contaminadas com Escherichia coli, assim como neste estudo que, em 3 fórmulas
reconstituídas, foram encontradas contagens deste MO (todas acima do
recomendado pela ANVISA) [21]. Já Momesso, Lanziotti, Caproni, Souza,
Andrade [22] não registraram crescimento de E.
coli ou qualquer outro coliforme.
Streptococcus sp são MO fermentativos
e produtores de ácido láctico. Por este motivo são amplamente utilizados como probióticos em FI, pois proporcionam diversos benefícios
como controle de infecções gastrointestinais e diarreias, infecções do sistema
respiratório, cólicas e irritabilidade, manifestações alérgicas, além de
melhorar a frequência e consistência nas evacuações e contribuir positivamente
na modulação da imunidade [23,24]. Apesar disso, não haviam
indicações de adição de probióticos às formulas onde
a presença destes foi averiguada.
A presença de Streptococcus sp
foi observada em uma amostra de leite humano em um lactário de Minas Gerais, o
que foi atribuído à microbiota natural da pele da lactente ou do manipulador
[25]. No presente estudo observou-se a presença deste MO em 2
fórmulas (FI 05 e FI 09), e não existem parâmetros máximos para comparação.
Em duas fórmulas (FI
02 e FI 03) foram encontradas colônias de Enterococcus sp. O principal reservatório desta é o
trato gastrointestinal de humanos, são comensais e atuam como oportunistas,
causando infecções em populações com a imunidade comprometida como pacientes de
longa internação [26].
Ao analisar o perfil
epidemiológico de pacientes infectados por MO resistentes transferidos das
unidades de pronto atendimento para o hospital da cidade de São Paulo, foi
constatado que cerca de 4,5% destes foram contaminados
por Enterococcus sp [27].
Os fungos produtores
de micotoxinas, como o Aspergillus, são grandes
contaminantes principalmente de grãos, estes constituem a principal matéria
prima para a formulação de ração animal, sendo assim, os metabólitos destas
toxinas podem ser encontrados em subprodutos como carne, ovos e leite [28].
A legislação
brasileira e União Europeia [29] designam que o limite máximo tolerado de Aflotoxina M1 (micotoxina) no
leite de vaca é de, respectivamente, 500 ng/kg e 50 ng/kg. No estado do Paraná, dois estudos encontraram
valores superiores ao recomendado [30,31], já Silva, Janeiro, Bando, Machinski [32] descreveram concentrações médias de 19,6 ng/L, dentro dos limites estabelecidos.
Nas fórmulas FI 03 e
FI 08 foram encontrados fungos, sendo que na primeira identificou-se como do
gênero Aspergillus. Apesar de não ter sido realizada
dosagens de micotoxinas, a presença de fungos
produtores desta pode ser um indicativo da existência de contaminação por este
componente.
Conclusão
Lactentes de 0 a 6
meses possuem seu sistema imunológico ainda muito imaturo, assim se tornam
especialmente propícios a infecções, as quais poderiam ser prevenidas através
do aleitamento. Porém, muitos lactentes são dependentes de outras formas de
alimentação, como as formulas infantis, não recebendo a proteção conferida pelo
leite humano e sendo expostos a contaminações externa.
Desta forma, fica
clara a importância do correto processamento e manipulação das formulas
infantis, para prevenir surtos infecciosos e garantir a proteção deste
indivíduo tão vulnerável.
Agredecimentos
Agradecemos à
Associação Educacional Luterana Bom Jesus/IELUSC pelo
apoio, disponibilização de laboratórios, equipamentos e materiais, bem como aos
monitores e coordenadora do laboratório pela atenção e disponibilidade.
Referências
- Soares RCS, Machado
JP. Imunidade conferida pelo leite materno. Viçosa/MG: Anais IV SIMPAC 2012;4:205-10.
- Sociedade Brasileira
de Pediatria, Alimentação do lactente. In: Sociedade Brasileira de Pediatria,
ed. Departamento de Nutrologia. Manual de orientação:
alimentação do lactente, alimentação do pré-escolar, alimentação do escolar,
alimentação do adolescente, alimentação na escola. 1
ed. São Paulo: Sociedade Brasileira de Pediatria; 2006. p.11-22.
- Brasil. Agência
Nacional de Vigilância Sanitária. Resolução nº 43, de 19 de setembro de 2011.
Dispõe sobre o regulamento técnico para fórmulas infantis para lactentes
[portaria na internet]. Diário Oficial da União 22 set 2011 [acesso em 14 mar 2016].
- Lopez FA, Nutrologia. In: Lopez FA, Campos JR, eds.
Tratado de pediatria. 3 ed. Barueri: Manole; 2014. p.1473-84.
- Brasil. Ministério da
Saúde. Alimentação para crianças não amamentadas. In: Ministério da saúde, ed.
Saúde da criança: Nutrição infantil, aleitamento materno e Alimentação
complementar. 2 ed. Brasília/DF: Ministério da saúde;
2014. p 119-32.
- Martín-Aragón MT, Marcos E. Fórmulas lácteas especiales.
Farmacia Profesional 2009;23:58-63.
- Organização Mundial
de Alergias (OMA). Diagnosis and rationale for
action against cow’s milk allergy (DRACMA) guidelines. Pediatr Allergy
Immunol 2010;21:1-125. https://doi.org/10.1111/j.1399-3038.2010.01068.x
- Pena FJ et al. Comparação entre uma fórmula infantil pré-espessada e fórmula de espessamento caseiro no
tratamento do refluxo gastroesofágico. J Pediatr 2003;79:49-54. https://doi.org/10.1590/s0021-75572003000100009
- Arbos KA, Freitas RJS, Stertz SC, Carvalho LA. Segurança alimentar de hortaliças
orgânicas: aspectos sanitários e nutricionais. Cienc Tecnol
Aliment 2010;30:8215-20.
https://doi.org/10.1590/s0101-20612010000500033
- Rastogi S, Premendra DD, Sublash
KK, Mukul D. Detection of aflatoxin
M1 contamination in milk and infant milk products from Indian markets by ELISA. Food Control 2004;15:287-90.
https://doi.org/10.1016/s0956-7135(03)00078-1
- World Health Organization (WHO). Enterobacter sakazakii
and other microorganisms in powdered infant formula: meeting report. Geneva: Microbiological
Risk Assessment Series; 2-5
feb 2004.
- Agência Nacional de
Vigilância Sanitária (Brasil). Resolução nº 12, de 2
de janeiro de 2001. Aprova o regulamento técnico sobre padrões microbiológicos
para alimentos [portaria na internet]. Diário Oficial da União 10 jan 2001 [acesso em 11 nov 2016].
- Roberts D, Microbiología Pratica de los
alimentos. In: Mortimore S, Wallace C,
eds. HACCP:
Enfoque prático. 1 ed. Zaragoza: Acribia;
1996. p.357-68.
- Rossi P, Kabuki DY, Kuaye, A.Y. Avaliação microbiológica do preparo de fórmula
láctea infantil em lactário hospitalar. Rev Inst Adolfo Lutz 2012;69:503-9.
- Santos RFS.
Ocorrência de Enterobacter Sakazakii
em fórmulas infantis para lactentes em hospitais e maternidades a região de
campinas/SP. [Dissertação]. Campinas: Universidade Estadual de Campinas,
Faculdade de Engenharia de Alimentos; 2006.
- Linhares IW. Avaliação das condições higiênico sanitárias no preparo de fórmulas
infantis em lactário hospitalar. [Dissertação] Belo Horizonte: Faculdade
de Farmácia da Universidade Federal de Minas Gerais; 2012.
- Franco BDGM.
Importância dos microrganismos nos alimentos. In: Franco BDGM, Landgraf M, eds. Microbiologia dos
alimentos. 1 ed. São Paulo: Ateneu; 2008. p.1-10.
- Moraes MS, Araújo BC,
Costa LEO, Nascimento JS. Avaliação do crescimento de Salmonella
enterica em fórmulas lácteas infantis sob diferentes condições de preparo e armazenamento.
Vigilância Sanitária em Debate 2015;3:48-52. https://doi.org/10.3395/2317-269x.00294
- Rowlands RE, Papasidero AAS, Paula AMR, Cano CB, Gelli
DS. Resistência térmica de Salmonella enteritidis, S. panama e S.
infantis em fórmula láctea infantil reconstituída. Rev
Inst Adolfo Lutz 2006;65:36-9.
- Rodrigues CAP.
Condições higiênico sanitárias de lactários hospitalares de Goiânia. Goiânia.
[Dissertação]. Goiânia: Universidade Federal de Goiás; 2014.
- Reginato A, Pena FL, Trento
FKS, Giordano LCRS, Kinchocu H, Antunes AEC.
Qualidade microbiológica de fórmulas infantis administradas em hospital público
do município de Campinas, São Paulo. Segurança Alimentar e Nutricional 2015;21(1):387-94. https://doi.org/10.20396/san.v21i1.1665
- Momesso NN, Lanziotti RS, Caproni PRR, Souza
LH, Andrade MC. Estudo da contaminação microbiana no preparo de fórmulas
lácteas infantis em lactário de um hospital universitário do Sul de Minas
Gerais. Rev Cienc Saude 2016;6;1-16. https://doi.org/10.21876/rcsfmit.v6i3.581
- Vilarim JNA. Leite materno:
ciência, mistérios e novas inspirações para fórmulas infantis. Pediatr Mod 2015;51:413-21.
- Epifanio M. Prebióticos e probióticos nas
fórmulas infantis: o que temos de evidência? Bol Cient Ped 2012;1:8-12.
- Silveira LAM,
D’Amorim MFG, Silva VRD, Terra APS. Controle microbiológico do leite humano de
um hospital universitário. Rev Baiana Saúde Pública 2012;36:844-50.
- Pesquero MA, Filho JE,
Carneiro LC, Feitosa SB, Oliveira MAC, Quintana RC. Formigas em ambiente
hospitalar e seu potencial como transmissoras de bactérias. Neotropical
Entomologia 2008;37:472-7. https://doi.org/10.1590/s1519-566x2008000400017
- Feijó RDF, Sassi SJG, Martino PB, Pinto CM. Avaliação da epidemiologia
e da estrutura dos insumos para precauções e isolamentos em um hospital público
no município de São Paulo. Am
J Infect Control
2012;1:151.
- Neto LT, Ferreira
RBH, Ferreira FD. Ocorrência de aflatoxina M1 em
leite bovino brasileiro e ingestão diária estimada. Anais do VII SIEPE; 2015
out 26-30; Chopinzinho/PR: Anais SIEPE 2015;7:1-2.
- Comissão das
Comunidades Europeias. Regulamento (CE) Nº 881 de 19 de Dezembro de 2006. Que
fixa os teores máximos de certos contaminantes presentes nos géneros
alimentícios. Jornal Oficial da União Europeia 20 dez 2006 [acesso em 11 nov 2016].
http://www.analitus.com.br/Documentos/DocumentosSite/277328f0-aafe-4d87-9161-7e26336d10f1.pdf
- Sassahara M, Netto DP, Yanaka EK. Aflatoxin occurrence in food
stuff supplied to dairy cattle and aflatoxin M1 in
raw milk in the North of Paraná state. Food Chem Toxicol 2005;43:981-4.
https://doi.org/10.1016/j.fct.2005.02.003
- Becker TA, Negrelo IF, Racoulte
F, Drunkler DA. Avaliação
da qualidade sanitária de leite integral informal, pasteurizado, UHT e em pó
comercializados na cidade de Medianeira e Serranópolis do Iguaçu/PR. Semina: Ciências Agrárias 2010;31:707-16.
https://doi.org/10.5433/1679-0359.2010v31n3p707
- Silva MV, Janeiro V,
Bando E, Machinski JRM. Occurrence and estimative of aflatoxin M1
Intake in UHT cow milk in Paraná State. Food Control 2015;53:222-5. https://doi.org/10.1016/j.foodcont.2015.01.025