REVISÃO
Uso do
ômega 3 no controle da artrite reumatoide
Use of omega 3 in the control of rheumatoid arthritis
Jennifer Stephanie
Xisto*, Tatiana de Lima Brito*, Bruna Raniel Vieira
Pinto Cabral**, Drielly Rodrigues Viudes***
*Acadêmica
do curso de Nutrição no Centro Universitário Católico Salesiano Auxilium de Araçatuba/SP, **Nutricionista, Pós-graduada em
Alimentos Funcionais, Suplementação e Fitoterápicos pela FAMERP/SP, Orientadora
de estágio supervisionado do curso de Nutrição no Centro Universitário Católico
Salesiano Auxilium de Araçatuba/SP, ***Nutricionista,
Pós-graduada em Nutrição Clínica Funcional pela Unicsul/CVP,
mestrado da disciplina de Gastroenterologia da
Universidade Federal de São Paulo – UNIFESP, docente do curso de Nutrição no
Centro Universitário Católico Salesiano Auxilium de
Araçatuba/SP
Recebido 22 de
janeiro de 2017; aceito 15 de dezembro de 2017.
Endereço
para correspondência:
Jennifer Stephanie Xisto, rua Euclides de Almeida, 105
Art Ville Birigui SP,
E-mail: jenni_stephanie@hotmail.com; Tatiana de Lima Brito:
tatiana_lima_brito@hotmail.com: Bruna Raniel Vieira
Pinto Cabral: nutricionistabruraniel@gmail.com; Drielly
Rodrigues Viudes: driviudes@gmail.com
Resumo
A artrite reumatoide
é uma inflamação das articulações que pode ocorrer por múltiplos fatores. Esta
doença pode atingir cerca de 1% da população mundial. O objetivo foi avaliar o
uso do ômega 3 no controle desta doença por meio de
uma revisão de literatura. Foi possível verificar sua atuação no sistema imune
através dos derivados Eicosapentaenoico e Docosahexaenoico
que podem diminuir o processo inflamatório. Em contrapartida é necessária
cautela com o consumo de peixes e suplementos de ômega 3
que possam conter mercúrio em sua composição, podendo ocasionar danos à saúde,
porém não está diretamente relacionado Artrite Reumatoide mas pode agravar a
doença. É necessário orientar o paciente a consumir peixes com menor
concentração de mercúrio ou suplementar produtos
confiáveis.
Palavras-chave: ácido
eicosapentaenoico, artrite reumatoide, mercúrio, óleos de peixe.
Abstract
Rheumatoid arthritis is an inflammation of the joints caused by multiple
factors. This disease can reach about 1% of the world population. The objective
was to evaluate the use of omega 3 in the control of this disease through a
literature review. It was possible to verify its role in the immune system
through derivatives EPA and DHA and the decreasing the inflammatory process. On
the other hand, caution is needed with the consumption of fish and omega 3
supplements that may contain mercury and may cause health problems, and
aggravate the disease. It is necessary to guide the patients to consume fish
with lower concentrations of mercury or additional reliable products.
Key-words: eicosapentaenoic acid, rheumatoid arthritis, mercury, fish
oils.
Introdução
A Artrite Reumatoide
(AR) é uma doença autoimune que causa uma inflamação crônica nas articulações,
e sua origem envolve fatores genéticos e ambientais [1]. A AR
é resultante da ação das células T e B autorreativas,
que levam a sinovite, a infiltração celular e a um
processo desorganizado de destruição e remodelação óssea [2].
Entre os possíveis
fatores envolvidos na etiologia desta doença pode-se citar a periodontite, o
tabagismo e predisposição genética, que atuam de forma associada ou isolada. Os
fatores genéticos estão fortemente associados à positividade do anticorpo antipeptídio cíclico citrulinado
(anti-CCP) e à resposta do paciente ao tratamento.
Diversos fatores já foram relacionados com o desenvolvimento da
AR, sendo o alelo HLA-DRB1 a principal associação genética, também
associado ao desenvolvimento de formas mais graves da doença [2].
De acordo com dados
epidemiológicos, a AR atinge uma em cada mil pessoas (1:1000)
acometendo cerca de 1% da população mundial [3]. Os principais sintomas
clínicos observados para diagnóstico da doença são: o inchaço dolorido, a
rigidez muscular, fadiga e perda de peso [4].
A investigação
completa para diagnóstico de AR engloba exames laboratoriais como o fator
reumatoide e anti-CCP (anticorpos contra peptídeos citrulinados cíclicos) [5], radiografia e provas
imunológicas específicas. O tratamento principal é baseado no uso de
anti-inflamatórios não esteroidais, glicocorticóides e imunossupressores, drogas modificadoras
do curso da doença como metotrexato, e agentes imunobiológicos como o adalimumabe
[6], com o objetivo de melhorar a qualidade de vida do indivíduo [7].
Associar agentes
farmacológicos com suplementação à base de ômega 3 (w-3),
um ácido graxo poli-insaturado essencial que possui a capacidade de modular a
resposta inflamatória [8], pode auxiliar no controle da AR e de outras doenças
inflamatórias [9]. Estudo realizado na University of Massachusetts Medical School
mostrou o potencial anti-inflamatório do w-3 em comparação e em
associação ao óleo de borragem, para pacientes com
AR, mostrando os benefícios do mesmo para esses indivíduos [10]. O w-3
pode ser obtido através da ingestão de alguns tipos de peixes, suplementos e
sementes [11]. Em contrapartida, os peixes e suplementos que são as maiores
fontes desse ácido graxo podem possuir uma concentração aumentada de mercúrio,
um metal pesado e tóxico, relacionado à um mau
prognóstico da AR, além de poder ocasionar danos neurológicos, renais,
respiratórios, cardiovasculares e hepáticos [12].
A atual pesquisa teve
como objetivo analisar a implicação do ácido graxo da série w-3
no tratamento e evolução clínica da AR e sua
contribuição para a melhora da qualidade de vida e mobilidade desses doentes.
Material
e métodos
Para entendimento do
assunto e elaboração do trabalho final, por meio da revisão de literatura foram
coletadas informações de artigos científicos clínicos, revisão simples,
experimentais e metanálises. Priorizou-se
artigos publicados nos últimos dez anos, em língua portuguesa e inglesa
encontrados nas seguintes bases de dados: Lilacs, Scielo, Bireme e PubMed. Foram utilizados os seguintes descritores para
realização da pesquisa bibliográfica: ácido graxo (fatty
acid), artrite reumatoide (rheumatoid
arthritis), ômega 3 (omega 3), ácido eicosapentaenoico (eicosapentaenoic
acid), inflamação (inflammation),
sistema imune (immune system), peixes e mercúrio (fish and mercury),
toxicidade do mercúrio (mercury toxicity),
mercúrio e óleo de peixe (mercury and
fish oil).
Revisão
de literatura
Etiologia
e epidemiologia da AR
De acordo com o
Consenso da Sociedade Brasileira de Reumatologia 2011, no país há uma
prevalência de até 1% da população adulta com AR, gerando uma estimativa de
1.300.000 pessoas acometidas por essa doença. Embora a AR possa ocorrer em
qualquer idade, as mulheres na faixa etária entre 40 e
60 anos são mais afetadas do que os homens. O potencial genético é uma das
principais causas de desenvolvimento da doença, sendo que indivíduos que tem
familiares próximos com AR tem maior predisposição de desenvolver a doença [5].
O hábito de fumar
também é um gatilho para o desenvolvimento da doença ou de agravamento do
quadro clínico quando já instalada, devido ao aumento de proteínas citrulinadas no pulmão [5]. Existem outros fatores
ambientais envolvidos na etiologia da AR como a
periodontite ocasionada pela má higienização bucal [2].
Para um diagnóstico
eficaz de AR são utilizados exames de imagem como radiografia, ultrassonografia
e ressonância magnética que avaliam danos articulares estruturais. Para que o
médico especialista faça um diagnóstico completo, deve se levar
em conta alguns exames como o anti-CCP, fator
reumatoide (FR), velocidade de hemossedimentação (VHS), proteína C- reativa
(PCR) e tipificação do antígeno leucocitário humano HLA [13].
O anticorpo anti-CCP é uma imunoglobulina (IG) produzida na sinóvia reumatoide, com a presença de proteínas citrulinadas no local que leva a uma resposta imunológica.
O anti-CCP pode ser detectado em aproximadamente 80%
do soro de pacientes com AR, específico em 95% a 99% dos casos [14]. A ativação
de anticorpos IgG na sinóvia, leva a produção de FR de classe IgM (Imunoglobulina M) superiores a 50 UI/ml, presente na
sorologia do paciente, aumentando o processo inflamatório [2,5].
A PCR é uma proteína
de fase aguda do processo inflamatório que é sensível para acompanhamento da AR. Níveis aumentados de PCR representam um pior
prognostico da doença. A elevação da VHS provoca aumento de proteínas de fase
aguda como o fibrinogênio e imunoglobulinas [15].
O gene HLA está
ligado ao risco de desenvolvimento de AR, e associado ao desenvolvimento de anti-CCP. Indivíduos portadores do alelo HLA-DRB1 estão
mais suscetíveis à doença, e sua presença pode ocasionar mortalidade por
patologias cardiovasculares [13].
Devido ao fato da AR ser uma doença autoimune e multifatorial dificulta a
determinação exata de sua origem. Dessa forma, a prevenção através de um estilo
de vida saudável pode diminuir os riscos ambientais desencadeantes da doença.
Patogênese
da AR
Pode-se dizer que o
ponto inicial para seu desenvolvimento ainda é incerto, mas há evidências de
que a desregulação na ação dos linfócitos T no reconhecimento ou não a um gene
MHC (complexo principal de histocompatibilidade) pode
ser um fator desencadeador da inflamação pelo sistema imune, culminando no
desenvolvimento da doença [16]. Na figura 1 pode-se observar a interação entre
fatores genéticos e ambientais no desenvolvimento do processo inflamatório da AR.
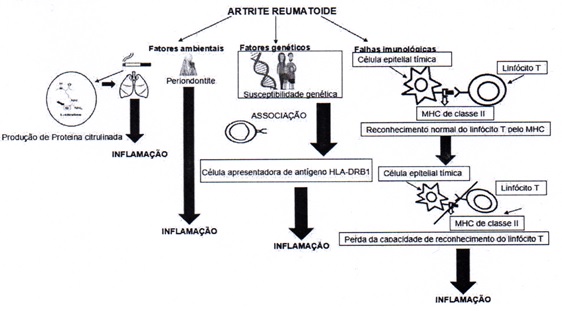
(Imagem ilustrada pelo próprio autor).
Figura
1 – Fatores desencadeantes da
AR.
Os neutrófilos
presentes no sangue têm papel importante na ativação do processo inflamatório,
pois atraem quimiocinas e citocinas.
Em um organismo normal eles são eliminados do sangue por meio do processo de
apoptose, já em um organismo com doença autoimune, como é o caso da AR, há um distúrbio no processo de apoptose, aumentando
no sangue a circulação de materiais tóxicos que elevam a produção de auto
anticorpos [17].
No processo inflamatório
os macrófagos ativam os linfócitos T e B, liberando citocinas
pró-inflamatórias como: interleucinas (IL-1, IL-6,
IL-12), fator de necrose tumoral alfa (TNF-α), interferon
gama (IFN-g) e quimiocinas. As
quimiocinas respondem aos estímulos de inflamação,
contribuindo para a resposta imune adaptativa. Os mastócitos são células CD34+
e estão presentes no tecido sinovial de uma pessoa saudável, e em maior
concentração na de pessoas que possuem AR com consequente aumento na destruição
das articulações e cartilagem. O Sistema Complemento (SC) é ativado pelo
antígeno-anticorpo chamado imunocomplexo, levando a
inflamação tecidual que resulta na AR [17].
Os linfócitos Th1
estão ligados a patogênese da AR, pois eles aumentam a
produção de citocinas. Estudos recentes indicam o
envolvimento dos linfócitos Th17 no processo da doença por elevarem a produção
de IL-22, IL-26 e IL-17 responsáveis por mediar a
inflamação, reabsorção óssea e ativação de osteoclastos
[18].
A IL-18, uma citocina pró-inflamatória, eleva os níveis do TNF-a
podendo ser inibida através de medicamentos ou fitoquímicos
reduzindo ou retardando a inflamação das articulações. As IL-1
e IL-6 atuam no agravamento das inflamações [19]. No tecido sinovial e no
líquido sinovial também encontra-se a IL-8 [17].
A ausência de células
T reguladoras de ocorrência natural, desencadeia a AR,
elevando os anticorpos antinúcleo causando defeitos e
alterações funcionais na sinóvia [16]. Em suma, uma
resposta imune desordenada pode causar a AR pela elevação do TNF-a,
IL-1 e IL-6 e de outras citocinas que caracterizam o
processo inflamatório da doença.
Ômega 3 e o sistema imune
O w-3
é considerado um ácido graxo de cadeia longa, tendo duas ou até mais duplas
ligações, que possuem 20 carbonos, e uma última dupla ligação no terceiro
carbono. Os ácidos graxos poli-insaturados pertencem à família do w-3,
que a partir de um processo de metabolização são transformados em ácido a-linolênico
(ALA-C - 18:3 - 18 carbonos com 3 insaturações),
ácido eicosapentaenoico (EPA - C20:5 - 20 carbonos e 5 insaturações),
e o ácido docosahexaenóico (DHA - C22:6 - 22 carbonos
e 6 insaturações), sendo possível a conversão destes
em ácidos graxos essenciais [20,21].
Os eicosanoides são
provenientes dos ácidos graxos essenciais (AGE), sintetizados a partir do ácido
araquidônico (AA) que se converte em prostaglandinas e tromboxano
(PGE2 e TXE2), e agem imediatamente no local afetado, ocasionando várias ações
principalmente a resposta inflamatória e autoimune [9-8]. Sua formação se dá
através da metabolização dos ácidos graxos por ciclooxigenase
(COX), em consequência desta via ativada há aumento de prostaglandinas (PGs), tromboxanos (TXs) e prostaciclinas (PCI). Há
também outra via de formação de eicosanoides, a lipooxigenase
(LOX) que faz a síntese de leucotrieno A (LTs) e ácido hidroperoxieicosanóico
[21]. Com o aumento do consumo de w-3 as prostaglandinas
e tromboxanos são convertidos em segunda série e os leucotrienos em quarta série, tendo efeito anti-inflamatório
[22].
Na
AR
ocorre um processo de estresse oxidativo relacionado
a produção de prostaglandinas, citocinas, espécies
reativas de oxigênio (ROS) e radicais livres (RLs)
que leva a inflamação. Uma célula para ser oxidada é ativada pelo NADPH
(fosfato de dinucleótido de nicotinamida e adenina) e
induzida por citocinas, IFN-g,
IL-1 e TNF-a. Eicosanoides são liberados e induzirão o
aumento dos níveis de AMPc
(adenosina 3’, 5’- monofosfato cíclico), dessa forma
a cascata de mediadores inflamatórios será ativada [21,23].
Uma dieta com aumento
da ingestão de EPA e DHA pode diminuir a formação de eicosanoides de origem
inflamatória e ativar eicosanoides anti-inflamatórios [8].
Ômega 3 e AR
A
AR
é caracterizada pela produção de citocinas e
eicosanoides provenientes do AA como, PGE2, leucotrieno
(LTB4) e hidroperoxieicosatetraenoico (5-HPETE), que
culminarão no quadro inflamatório e consequente surgimento de sintomas de dor,
vermelhidão e rigidez. Quando surge esse quadro no local inflamado (sinóvia), ocorrerá a ativação das
linhas de defesa com o surgimento de macrófagos, monócitos, granulócitos
e linfócitos, com o objetivo de reparar o tecido destruído [24].
As principais fontes
de EPA e DHA são encontradas normalmente em peixes marinhos de água fria: atum,
sardinha, arenque, salmão, bacalhau e linguado (126 a 3725 mg/100g
de peixe), também em óleos de fonte vegetal como linhaça e canola, bem como a
ingestão de suplementação por cápsulas. De acordo com as DRIs
(Dietary reference intakes) a recomendação de w-3
é de 1,6 g por dia para homens e 1,1 g por dia para mulheres [25].
O w-6
é de origem do AA, encontrado principalmente em óleos vegetais de milho, soja e
girassol. O seu consumo eleva a produção de eicosanoides inflamatórios (PGE2 e
LTB4). Uma dieta rica em w-3 diminui a produção
de PGE2, porém eicosanoides derivados do EPA são menos ativos do que os
provenientes do AA, mas associados podem inibir a produção de TNF-a
por monócitos [26]. Para que haja um equilíbrio nas funções do w-3
e w-6 é necessário fazer uma dieta com balanço
entre suas proporções que fica em torno 1-2:1 e atualmente é de 15-17:1 devido a ocidentalização da dieta [27].
Foram acompanhados 34
pacientes com AR por 6 meses. Os mesmos foram
divididos em 3 grupos, sendo o grupo I com 2 g
suplementação de w-3 em duas capsulas
por dia (460 mg de EPA e 380 mg de DHA); o grupo II iniciou uma dieta
mediterrânea rica em peixes e fontes vegetais de w-3; e por fim o grupo
III que continuou com a dieta habitual. Os resultados mostraram que a
suplementação com o w-3 reduziu a VHS nos
doentes e diminuiu a ingestão de anti-inflamatórios não esteroides [28].
Em uma pesquisa
realizada em pacientes com AR, mantidos em tratamento com anti-inflamatórios
não esteroides, e submetidos a intervenções com peixe e óleo de linhaça em
forma líquida ou em cápsulas, com doses que variaram de 1,7 a 9,6 g, com
duração de até 15 meses, apontou em 3 meses de estudo
que a suplementação com w-3 de peixe e óleo de
linhaça melhorou o quadro de dor dos pacientes comparado com o grupo placebo
[29].
Em um estudo feito
com 18 ratos durante 20 dias, os animais foram divididos em 3
grupos. No grupo I (Grupo controle), os animais receberam 0,2 ml de soro
fisiológico; no grupo II (Grupo tenoxicam) receberam 1 mg/kg de tenoxicam
(anti-inflamatório); e no grupo III (Grupo ômega 3) foram suplementados com 200
mg/kg de w-3, sendo 180 mg/g de EPA e 120 mg/g de DHA.
O tratamento foi realizado uma única vez ao dia por 20 dias. Foi aplicada
formalina no dorso da pata para verificar a dor, sendo realizado em duas fases
de tempos distintos. Observou-se que os grupos GT e GC iniciaram com o peso de
389,8 g e 384,0 g e ao final pode-se verificar o aumento de peso 72,03 g e
39,01 g totalizando 461,83 g e 423,01 g, GO iniciou com peso 411,0 g e teve ganho de 24,16 g finalizando com 435,16 g. Os autores
deste estudo concluíram que o tenoxicam por ser um
anti-inflamatório pode apresentar efeitos colaterais como a retenção de sódio e
água podendo ocorrer devido ao aumento de peso que pode ocasionar doenças
crônicas não transmissíveis. O efeito do w-3 é semelhante ao tenoxicam, mas com menor efeito colateral [22].
Por fim, o w-3
produz eicosanoides de série ímpar (PGE3, TXA3 e LTB5) que possuem atividade
anti-inflamatória que auxiliam no equilíbrio do sistema imune e menor formação
de citocinas pró inflamatórias
[4].
Mercúrio
e ômega 3 – impacto imunológico
O mercúrio pode ser
encontrado na natureza nas formas líquida, gasosa e sólida sendo dos tipos
metálico ou elementar. Pode ser inorgânico nas formas de mercúricos
e mercurosos, e orgânico como metilmercúrio
e etilmercúrio [30].
De todas as formas
existentes deste metal, o metilmercúrio é o mais
tóxico sendo encontrado principalmente no sistema aquático. É um metal tóxico
que pode atingir o organismo de várias formas [12], conforme pode-se
observar na figura 2.
O metilmercúrio
pode ter concentrações muito elevadas em peixes de água doce e salgada [31] e,
consequentemente, nos seres humanos por ser de fácil absorção e difícil
eliminação [30]. No Brasil, mais precisamente em Belém, três espécies de peixe
foram analisadas em relação ao teor de mercúrio em diferentes períodos do ano.
Os resultados encontrados indicaram que nenhuma das espécies
analisadas ultrapassaram o limite permitido, entretanto na espécie Brachyplatystoma rousseauxii
(dourada) o valor da concentração de mercúrio se aproximou do limiar de 1 µg/g
para peixes predadores e 0,5 µg/g para peixes não predadores, sendo necessário
cuidados em relação ao consumo frequente desta espécie [32].
Estudo semelhante
realizado em Portugal observou que a maioria dos peixes analisados se enquadra
dentro do limite estabelecido, com apenas duas espécies apresentando valores
mais elevados. Ainda, foi realizada uma avaliação com a população para
identificar grupos de risco de intoxicação por mercúrio com o alto consumo de
peixes. Os resultados apontaram as lactantes como o maior grupo de risco [12].
Há indícios de que a
idade, peso e tamanho do peixe possam influenciar na quantidade de mercúrio que
ele contém. O ciclo de contaminação do mercúrio pode ocorrer de várias formas,
sendo a aquática a mais exposta a contaminação, por
isso os peixes, principalmente os de grande porte, podem ter altas concentrações
de mercúrio [30,33].
O mercúrio não tem
efeitos diretos na AR, mas pode agravar o estado da
doença devido aos efeitos colaterais e tóxicos quando em excesso [31]. Este metal toxico é difícil de ser encontrado em suplementos
de w-3, mas são necessários certos cuidados na
escolha do produto optando-se pelos que possuem laudos técnicos que indicam a
isenção deste metal [34].
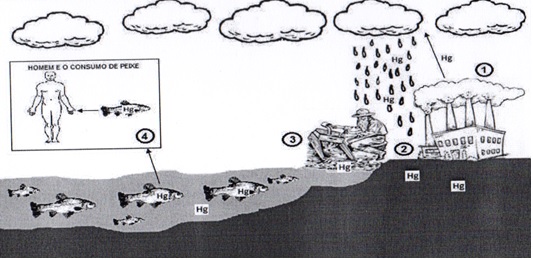
1 - As industrias utilizam o mercúrio para diversas finalidades
liberando gases ricos em metais pesados na atmosfera. 2 - O mercúrio contamina
o solo através da chuva que já contém o mercúrio presente no ar. 3 - Os
garimpeiros utilizam mercúrio na limpeza do ouro e com consequente contaminação
dos rios. 4 - Os peixes são contaminados por mercúrio presente na água, e o
homem se contamina ao consumir peixes, principalmente os grandes que concentram
maior quantidade deste metal. (Imagem ilustrada pelo próprio autor)
Figura
2 - Ciclo de contaminação do mercúrio.
Conclusão
Com base no exposto
pode-se concluir que o w-3 é efetivo no
auxílio ao controle da AR e na prevenção da mesma por
sua ação imunomoduladora. O consumo de forma adequada
de fontes de w-3 como os peixes,
associado ao uso de medicamentos pode trazer melhorias na qualidade de vida e
diminuição dos sintomas da doença, como a dor e a degeneração articular.
O consumo de w-3
deve ser estimulado por meio da ingestão de alimentos de origem vegetal ou
animal fontes desse nutriente, além da suplementação que deve ser indicada por
profissional capacitado quando se fizer necessário. Não há doses estabelecidas
de ingestão de w-3 para portadores de
AR, dessa forma o profissional deve-se atualizar constantemente visto as
inúmeras publicações sobre este assunto na literatura científica.
Por
fim, o mercúrio
não está diretamente relacionado a AR, mas a
intoxicação por este metal pode
agravar o estado geral do paciente. Portanto, é
necessário orientar o consumo
de peixes com menor concentração de mercúrio e, se
necessário, realizar a suplementação
de w-3 com produtos idôneos.
Referências
- Scheinberg M, Golmia R, Rollo C. O uso de agentes biológicos no
tratamento de artrite reumatoide. Rev Bras Med
2015;72(9):403-13.
- Goeldner I, Skare TL, Reason ITM, Utiyama
SRR. Artrite
reumatóide: uma visão atual. J Bras
Patol Med Lab 2011;47(5):495-503.
- Roma I, Almeida ML, Mansano NS, Viani GA, Assis MR,
Barbosa PMK. Qualidade de vida de pacientes adultos e idosos com artrite
reumatoide. Rev Bras Reumatol 2014;54(4):279-86.
- Costa P, Beck ST.
Avanços nos diagnóstico e tratamento da artrite reumatoide. Saúde (Santa Maria)
2011;37(1):65-76. Disponível em:
http://periodicos.ufsm.br/revistasaude/article/view/2592/2041
- Mota LMH, Cruz BA, Brenol CV, Pereira IA, Fronza
LSR, Bertolo MB et al.
Consenso da sociedade brasileira de reumatologia 2011 para o diagnóstico e
avaliação inicial da artrite reumatoide. Rev Bras Reumatol 2012;52(2):135-174.
- Bagatini F, Blatt CR, Maliska G, Trespash GV, Pereira IA, Zimmermann AF, Storb
BH et al. Potenciais interações medicamentosas em
pacientes com artrite reumatoide. Rev Bras Reumatol 2011;51(1)
20-39
- Mota LMH, Brenol CV, Pereira IA, Fronza
LSR, Bertolo MB et al.
Consenso 2012 da sociedade brasileira de reumatologia para o tratamento da
artrite reumatoide. Rev Bras
Reumatol 2012;52(2):135-174.
- Perini JAL, Stevanato FB, Sargi SC, Visentainer JEL, Dalalio MMO, Matshushita M et al. Ácidos graxos
poli-insaturados n-3 e n-6: metabolismo em mamíferos e resposta imune. Rev Nutr 2010;23(6):1075-86.
- Gomes TKCG, Oliveira
SL. O papel dos ácidos graxos essenciais no perfil de eicosanoides e sua
repercussão na resposta imune. J Brazilian Soc Food Nutr 2010;35(1):167-86.
- Reed GW, Leung K, Rossetti RG, VanBuskirk S,
Sharp JT, Zurier RB. Treatment of rheumatoid
arthritis with marine and botanical oils: na
18-month, randomized, and double – blind trial. Evid Based
Complement Alternat Med 2014 Mar;19(3):1-9.
- Martins MB, Suaiden AS, Piotto RF, Barbosa M.
Propriedades dos ácidos graxos poliinsaturados –
Ômega 3 obtidos de óleo de peixe e óleo de linhaça. Rev Inst Ciênc
Saúde 2008;26(2) 153-6.
- Santos LMP. Avaliação
da exposição da população portuguesa ao metilmercúrio
por consumo de pescado proveniente dos grandes mercados fornecedores.
[Dissertação]. Lisboa; 2015 [acesso em 2016 mar 22]. Disponível
em: http://repositorio.ul.pt/bitstram/10451/20763/1/
- Tese_MCQTA_Luciana_Santos.pdf
- Mota LMH, Cruz BA, Brenol CV, Pereira IA, Fronza
LSR, Bertolo MB et al.
Diretrizes para o diagnóstico da artrite reumatoide. Rev
Bras Reumatol 2013;53(2):141-57.
- Alarcon RT, Andrade LEC.
Anticorpos antiproteínas citrulinadas
e a artrite reumatoide. Rev Bras
Reumatol 2007;47(3):180-7.
- Neto NSR, Carvalho
JF. O uso de provas de atividade inflamatória em reumatologia. Rev Bras Reumatol
2009;49(4) 413-30.
- Souza AWS, Junior DM,
Araújo JAP, Catelan TTT, Cruvinel
WM, Andrade LEC et al. Sistema imunitário- Parte III O
delicado equilíbrio do sistema imunológico entre os polos de tolerância e
autoimunidade. Rev Bras Reumatol 2010;50(6):665-94.
- Cruvinel WM, Junior DM, Araújo
JAP, Catelan TTT, Souza AWS, Silva NP et al. Sistema imunitário – Parte I Fundamentos da imunidade
inata com ênfase nos mecanismos moleculares e celulares da resposta
inflamatória. Rev Bras Reumatol 2010;50(4):434-61.
- Junior DM, Araújo
JAP, Catelan TTT, Souza AWS, Cruvinel
WM, Andrade LEC et al. Sistema imunitário – Parte II
Fundamentos da resposta imunológica mediada por linfócitos T e B. Rev Bras Reumatol
2010;50(5):552-80.
- Farias TDJ, Canto LM,
Medeiros MD, Sereia AFR, Back LKFC, Mello FM et al.
Ausência de associação entre os polimorfismos do gene interleucina-18 e artrite
reumatoide. Rev Bras Reumatol 2012;53(2):199-205.
- Coqueiro DO, Bueno
PCS, Simões MJ. Uso da suplementação com ácidos graxos poli-insaturados ômega-3
associado ao exercício físico: uma revisão. Pensar a Prática. 2011;14(2)1-15. Disponível em:
http://www.revistas.ufg.br/fef/article/view/12444/9562
- Andrade PMM, Carmo
MGT. Ácidos graxos n-3: um link entre eicosanoides, inflamação e imunidade. Mn
Metabólica 2006;8(3):135-42. Disponível em:
http://laszlo.ind.br/admin/artigos/arquivos/prisciladematto%20machadoandrademnmetab%C3%83%C2%B3licav8n3.pdf
- Mesquita TR, Souza
AA, Constantino E, Pelógia NCC, Posso IP, Pires OC. Efeito anti-inflamatório da
suplementação dietética com ácidos graxos ômega-3, em ratos. Rev Dor 2011;12(4) 337-41.
- Filippin LI, Vercelino R, Marroni NP, Xavier
RM. Influência de processos redox na resposta inflamatória da artrite
reumatoide. Rev Bras Reumatol 2008;48(1):17-24.
- Calder PC. n-3 polyunsaturated fatts acids, inflammation, and inflammatory diseases. Am J Clin Nutr 2006;83(6):1505-19.
- Padovani RA, Farfán já, Colugnati FAB, Domene SMA. Dietary reference intakes: aplicabilidade
das tabelas em estudos nutricionais. Rev Nutr 2006;19(6):741-60.
- Calder PC. Ômega-3 fatty acids and inflammatory
processes. Nutrients 2010;2(3)
355-74.
- Martin CA, Almeida
VV, Ruiz MR, Visentainer JEL, Matshushita
M, Souza NE et al. Ácidos graxos poli-insaturados
ômega-3 e ômega-6: importância e ocorrência em alimentos. Rev
Nutr 2006;19(6):761-70.
- Araújo ACP. Dieta mediterrânica e ácidos gordos ômega-3 que papel na
artrite reumatoide. [Dissertação] Coimbra; 2014. [citado 2016 mar 22].
Disponível em: http://estudogeral.sib.uc.pt/bitstream/10316/27792/1/Tese%20%20v5.2.pdf
- Goldberg RJ, Katz J. A meta-analysis of the analgesic
effects of ômega-3 polyunsaturated fatty acid supplementation for inflammatory
joint pain. J
Fam Pract 2007;129(1):210-223.
- Kasper D, Botaro D, Malm EFAPO. Mercúrio em
peixes – fontes e contaminação. Oecol Bras 2007;11(2):228-39. Disponível
em: http://www.oecologiaaustralis.org/ojs/index.php/oa/article/download/182/108
- Bueno PC, Rodrigues
JC, Lemos AF, Malaspina FG, Matsui
CT, Rohlfs DB. Exposição humana a mercúrio: subsídios
para o fortalecimento das ações de vigilância em saúde. Cad Saúde Colet
2011;19(4):443-7. Disponível em:http://www.iesc.ufrj.br/cadernos/images/csc/2011_4/artigos/csc_v19n4_443-447.pdf
- Amaro CSO, Junior DR,
Silva MCF, Lima AAS, Santos GFS, Pinheiro, MCN. Concentração de mercúrio total
(Hg-T) em peixes comercializados em diferentes períodos sazonais no Mercado do
Ver-o-Peso, Belém, Estado do Pará, Brasil. Rev Pan-Amaz Saúde 2014;5(1):53-60.
- Silva MW, Estanislau CAM. Concentração de mercúrio em peixes da
Amazônia. Boletim ABLimno 2015;41(1):08-14.
Disponível: http://www.ablimno.org.br/boletins/pdf/bol_41_1-4.pdf
- Magalhães DMO. Ácidos
gordos ômega 3 na gravidez. Porto; 2012 [citado 2016
mar 22]. Disponível em: http://sigarra.up.pt/fmup/pt/pub_geral.show_file?pi_gdoc_id=w113457.