REVISÃO
A
obesidade e a ação dos prebióticos, probióticos e
simbióticos na microbiota intestinal
The
obesity and the action of prebiotics, probiotics and symbiotics
in intestinal microbiota
Michely Lopes Nunes*, Marilene
Porawski Garrido**
*Departamento
do Programa de Pós-Graduação em Medicina: Hepatologia da Universidade Federal
de Ciências da Saúde UFCSPA, Porto Alegre/RS, **Professora adjunta de
Fisiologia do Departamento de Ciências Básicas da Saúde e orientadora do PPG em
Medicina: Hepatologia e do PPG Biociências da Universidade Federal de Ciências
da Saúde de Porto Alegre (UFCSPA), Porto Alegre/RS
Recebido 14 de maio de
2017; aceito 15 de outubro de 2018.
Endereço
para correspondência:
Michely Lopes Nunes, Rua Sarmento Leite, 245
90050-350 Porto Alegre RS, E-mail: mednutry@gmail.com; Marilene Porawski Garrido: marilenep@ufcspa.edu.br
Resumo
A crescente prevalência
da obesidade e suas comorbidades apresentam-se como um dos principais problemas
de saúde pública atualmente. O intestino é um órgão complexo que tem sido cada
vez mais estudado na obesidade devido à sua capacidade para sinalizar vias
envolvidas na fisiopatologia da doença. Objetivo: Esclarecer os principais
efeitos de prebióticos e probióticos nas alterações
metabólicas e da microbiota intestinal na obesidade. A microbiota intestinal
pode ser modulada pela dieta e atuar no controle da ingestão alimentar
interagindo com receptores e enzimas que interferem nas alterações metabólicas
decorrentes da obesidade e na modulação da resposta inflamatória. Pesquisas com
animais mostraram resultados positivos do uso de prebióticos
e probióticos como coadjuvantes no tratamento da obesidade, contudo, os
resultados com humanos ainda apresentam dados controversos. Portanto a
implementação de tais estratégias provavelmente vai abrir o caminho para
alimentação personalizada e/ou estratégias terapêuticas inteligentes, incluindo
a manipulação da microbiota intestinal através da concepção de novos
probióticos, prebióticos e simbióticos para reverter
problemas causados pela obesidade.
Palavras-chave: prebióticos,
probióticos, obesidade, microbiota intestinal.
Abstract
The
growing prevalence of obesity and its comorbidities are currently one of the
major public health problems. The intestine is a complex organ that has been
increasingly studied in obesity because of its ability to signal pathways
involved in the pathophysiology of the disease. Objective: to clarify the main
effects of prebiotics and probiotics on intestinal microbiota and metabolic
changes in obesity. Animal research showed positive results of the use of
prebiotics and probiotics as complements in the treatment of obesity. However,
the results in humans still feature controversial data. Therefore
implementing such strategies will probably pave the way for personalized
nutrition and/or clever therapeutic strategies, including manipulation of the
intestinal microbiota through the design of new probiotics, prebiotics and symbiotics to reverse problems caused by obesity.
Key-words: prebiotics,
probiotics, obesity, intestinal microbiota.
.
Introdução
A Organização Mundial
de Saúde aponta a obesidade como um dos maiores problemas de saúde pública no
mundo. “A projeção é que, em 2025, cerca de 2,3 bilhões de adultos estejam com
sobrepeso e mais de 700 milhões, obesos” [1].
A obesidade é causa de
incapacidade funcional, de redução da qualidade de vida, redução da expectativa
de vida e aumento da mortalidade. Condições crônicas, como doença renal,
osteoartrose, câncer, diabetes tipo 2, apneia do sono, doença hepática
gordurosa não alcoólica (DHGNA), hipertensão arterial e doenças cardiovasculares
estão diretamente relacionadas com incapacidade funcional e com a obesidade
[2].
De acordo com Pistelli e Costa [3], o desenvolvimento da obesidade nos
seres humanos pode ser influenciado pelas proporções relativas de dois filos
principais de bactérias da microbiota intestinal, os bacteroidetes
e os firmicutes, sugerindo que a atividade metabólica
deles pode facilitar a extração e estocagem das calorias ingeridas. A proporção
de bacteroidetes é menor em indivíduos obesos do que
em magros.
Estudos com o uso de
animais livres de germes e o transplante de microbiota mostraram que a
microbiota intestinal pode desempenhar um papel importante no desenvolvimento
da obesidade e distúrbios metabólicos associados. Nos seres humanos, observa-se
diferenças na composição da microbiota correlacionadas com mudanças na
atividade metabólica e na expressão de genes entre indivíduos obesos e magros,
sugerindo uma contribuição da microbiota intestinal para esses fenótipos [4].
Estudos observacionais
e retrospectivos enfatizam que a microbiota intestinal e seus metabólitos estão
alterados no estado de obesidade [5]. A microbiota intestinal é complexa e
parece afetar o equilíbrio metabólico do hospedeiro, modulando a absorção de
energia, a motilidade intestinal, o apetite, o metabolismo da glicose e dos
lipídeos, bem como o armazenamento de gordura hepática. Um comprometimento do
equilíbrio delicado entre a microbiota intestinal e o sistema imunológico do
hospedeiro pode provocar a translocação bacteriana e o desenvolvimento de endotoxemia metabólica, levando à inflamação sistêmica e à
resistência à insulina [6].
Pesquisa de Jumpertz et al.
[7] mostrou que a disponibilidade de diferentes nutrientes provoca mudanças na
composição da microbiota intestinal no mecanismo de absorção dos nutrientes,
nesse sentido, a microbiota tanto de humanos como de animais pode ser
modificada através da dieta, de modo que a ingestão de calorias em excesso
promove a proliferação de bactérias do filo firmicutes,
os quais permitem a extração de nutrientes com maior eficiência.
Outro estudo [8]
mostrou que uma dieta hiperlipídica e pobre em fibras
está associada a alterações na microbiota do intestino distal de camundongos,
sugerindo que a atividade metabólica dos micro-organismos intestinais pode
gerar derivados lipopolissacarídeos que atuariam como
um gatilho no desencadeamento da resposta inflamatória, contudo essas
alterações metabólicas podem ser reversíveis.
Diante das alterações
metabólicas e das modificações na microbiota intestinal que ocorrem em
indivíduos obesos, a utilização de probióticos pode ser uma estratégia
coadjuvante na prevenção e tratamento da obesidade [9]. Os probióticos são
definidos como micro‑organismos vivos que, quando ingeridos em
quantidades adequadas, exercem efeitos benéficos ao organismo. Os gêneros Lactobacillus e Bifidobacterium
são os mais utilizados na elaboração de probióticos. Eles são indicados para o
tratamento de diversas doenças, como inflamações, desordens alérgicas e
diarreia [10].
Os probióticos agem no
intestino e estimulam o sistema imunológico o que leva a uma redução dos
organismos patogênicos presente na microbiota. Esse fenômeno traz benefícios
para o ecossistema intestinal porque reduz a incidência e a gravidade da
diarreia. O uso de probióticos reduz o risco de câncer de cólon em modelos
animais, provavelmente por sua capacidade de suprimir a atividade de certas
enzimas bacterianas que podem aumentar os níveis de pró-carcinógenos, mas isto
não foi provado em humanos [11].
Animais obesos,
induzidos por dieta e tratados com probióticos mostraram redução do ganho de
peso e na acumulação de gordura corporal, bem como diminuição da insulina
plasmática, leptina, colesterol total e biomarcadores de toxicidade hepática.
Observou-se alterações transcricionais no tecido adiposo e no fígado. No tecido
adiposo, a expressão dos genes pró-inflamatórios (TNF-α, IL-6, IL-1β
e MCP1) foi diminuída em ratos que receberam tratamento probiótico. No fígado,
a expressão dos genes relacionados com a oxidação de ácidos graxos (PGC1a,
CPT1, CPT2 e ACOX1) foi aumentada em animais que receberam tratamento
probiótico. A microbiota intestinal de animais obesos induzidos pela dieta
parece ser modulada em ratos que recebem tratamento probiótico [12].
Microbiota,
obesidade e modulação da resposta imune inflamatória
Estudos recentes têm
associado a microbiota intestinal ao estado inflamatório que ocorre na
obesidade, sugerindo que alterações na sua composição e na sua diversidade em
obesos podem desempenhar papel importante no desenvolvimento de desordens
metabólicas [13].
A absorção de
nutrientes é diferente para cada pessoa, dependendo da sua microbiota
intestinal e este mecanismo de absorção e armazenamento determina a quantidade
de calorias armazenadas pelos indivíduos, pois a microbiota está envolvida no
aumento da taxa metabólica, modulação da lipogênese e no aumento da captação de
monossacarídeos [14].
O termo disbiose descreve qualquer desequilíbrio significativo no
ecossistema microbiano intestinal, isto inclui o crescimento excessivo ou o
esgotamento de uma espécie comensal particular, a família ou o filo de
bactérias, ou um deslocamento geográfico de uma ou mais espécies (isto é,
bactérias do cólon que colonizam o intestino delgado) [15].
A disbiose
do intestino pode ser um dos principais desencadeadores de uma ampla gama de
distúrbios gastrointestinais e sistêmicos, isso ocorre quando os adipócitos
liberam citocinas pró-inflamatórias, entre elas, interleucina IL-1, IL-6 e
fator de necrose tumoral alfa (TNF-α), sendo que a expressão gênica
aumenta conforme ocorre hipertrofia das células epiteliais.
A gordura saturada
induz a liberação de prostaglandinas, principalmente de série par como a PGE2,
oriundas da biossíntese do ômega. O excesso do consumo de ômega-6 também está
associado à resposta imune através dos efeitos sobre o receptor do tipo toll like, os TLR-4, que ao ser
ativado induz a sinalização das proteínas da via das MAP quinases e, por fim,
pode ativar o fator de transcrição NF-kB, relacionado
com a expressão de mais de 200 genes [16].
Recentes estudos têm
demonstrado a participação de receptores de interleucina 1/TLR, como o receptor
TLR5, na inflamação [17]. O TLR5 é uma proteína que atua na resposta
imunológica através do reconhecimento de patógenos associados a bactérias. A
interação entre microbiota e TLR5 é fundamental para a homeostase intestinal,
pois a maioria dos micro-organismos do intestino tem alta afinidade com o TLR5
e essa reação emite sinais que regulam o funcionamento intestinal, portanto
deficiências nesse receptor levam ao início da cascata inflamatória, com
transcrição de citocinas e mediadores inflamatórios como o NF-kB [18].
Estudos mostram que
camundongos geneticamente deficientes em Toll-like
receptor 5 (TLR5) exibem hiperfagia e desenvolvem
características da síndrome metabólica, incluindo hiperlipidemia,
hipertensão, resistência à insulina e aumento da adiposidade. A restrição
alimentar impediu a obesidade, mas não a resistência à insulina, nos
camundongos deficientes em TLR5. Estes resultados suportam a visão emergente de
que a microbiota intestinal contribui para a doença metabólica e sugerem que o
mau funcionamento do sistema imune inato pode promover o desenvolvimento da
síndrome metabólica [19].
O que são
prebióticos e probióticos?
O termo prebiótico foi empregado “em 1995, para designar
ingredientes nutricionais não digeríveis que afetam o hospedeiro estimulando
seletivamente o crescimento e a atividade de uma ou mais bactérias benéficas do
cólon, melhorando a saúde do seu hospedeiro” [20].
Os prebióticos
não são metabolizados ou absorvidos durante a sua passagem pelo trato digestivo
superior; devem servir como substrato a uma ou mais bactérias intestinais
benéficas (algumas espécies de Lactobacillus e Bifidobacterium) e, desta maneira, reduzem a quantidade de
outras bactérias como Bacteroides, Clostridium e Coliformes [21]. Possuem a
capacidade de alterar a microbiota intestinal de maneira favorável à saúde do
hospedeiro [22].
Alguns açúcares
absorvíveis ou não, fibras, álcoois de açúcares e oligossacarídeos estão dentro
deste conceito de prebióticos. Destes, os
oligossacarídeos - cadeias curtas de polissacarídeos compostos de 3 a 10
açúcares simples ligados entre si têm recebido mais atenção pelas inúmeras
propriedades prebióticas atribuídas a eles. Os frutooligossacarídeos são polissacarídeos que têm
demonstrado bons efeitos prebióticos, podem ser
obtidos na forma natural em sementes e raízes de alguns vegetais como a
chicória, cebola, alho, alcachofra, aspargo, cevada, centeio, nas leguminosas
como: grãos de soja, grão-de-bico, feijões, lentilha, ervilha. Também, podem
ser extraídos por cozimento ou através de ação enzimática ou alcoólica. Há,
também, os oligossacarídeos sintéticos obtidos através da polimerização direta
de alguns dissacarídeos da parede celular de leveduras ou fermentação de
polissacarídeos. Estudos mostram que os oligossacarídeos sintéticos têm
apresentado melhores resultados como prebióticos e
menos efeitos colaterais [6,23].
Desta maneira, os prebióticos agem intimamente relacionados aos probióticos,
constituem o "alimento" das bactérias. O uso de prebióticos
em associação como os probióticos apresentam ações benéficas superiores aos
antibióticos. São promotores de crescimento, não deixam resíduos nos produtos
de origem animal e não induzem o desenvolvimento de resistência às drogas, por
serem produtos essencialmente naturais [24].
Como já mencionado, as
substâncias prebióticos agem alimentando e
estimulando o crescimento de diversas bactérias intestinais benéficas, cujos
metabólitos atuam também reduzindo o pH através do aumento da quantidade de
ácidos orgânicos, presentes no ceco. Por outro lado, atuam bloqueando os sítios
de aderência principalmente a D-manose imobilizando e reduzindo a capacidade de
fixação de algumas bactérias patogênicas na mucosa intestinal [25]. Especula-se
que os oligossacarídeos possam atuar também estimulando o sistema imune,
através da redução indireta da translocação bacteriana [26].
Probióticos
O termo probiótico foi
definido pela (OMS) e pela Organização Mundial da Saúde, nos anos 2000, como
microrganismos vivos que são benéficos para a saúde do hospedeiro quando
administrados em quantidades adequadas [27]. Segundo a Organização de
Alimentação e Agricultura das Nações Unidas e a Organização Mundial de Saúde,
“probióticos são microrganismos vivos que, quando administrados em quantidades
adequadas conferem um benefício à saúde do hospedeiro que vive no intestino”
[28].
Existe uma variedade de
microrganismos utilizados como probióticos, que podem ser classificados da
seguinte forma: probióticos bacterianos e não bacterianos. Com a exceção de
certas leveduras e probióticos fúngicos, a maioria dos microrganismos
utilizados são bactérias. Exemplos de probióticos bacterianos são várias
espécies de Lactobacillus
[29], Bifidobacterium,
[30,31], Bacillus
[32] e Enterococcus
[33]. Os probióticos não bacterianos (levedura ou fungos) incluem Aspergillus oryzae [34], Candida pintolopesii
[35], Saccharomyces bourlardii
e Saccharomyces cerevisiae
[36].
Os probióticos podem
conter bactérias totalmente conhecidas e quantificadas ou, culturas bacterianas
não definidas. Enterococcus,
Bacteroides, Eubacterium
e especialmente Lactobacillus
e Bifidobacterium
estão presentes em todas as culturas. Por outro lado, não se conhece ainda a
composição ideal que melhor estimula as propriedades probióticas “in vivo”
produtos com culturas não definidas têm melhor ação probiótica que as culturas
definidas [37].
Os lactobacilos são
bactérias gram-positivas e anaeróbicas facultativas, predominantes no intestino
delgado. Entre suas espécies pode-se citar os Lactobacillus casei, Lactobacillus rhamnosus,
Lactobacillus acidophilus.
Os lactobacilos inibem a proliferação de microrganismos patogênicos pela
competição com locais de ligação de nutrientes e produzem ácidos orgânicos, que
reduzem o pH intestinal, retardando o crescimento de bactérias patogênicas
[38].
Os probióticos fazem
parte dos chamados “Alimentos Funcionais”, cujo principal alvo é a mucosa intestinal.
Diferentes probióticos são capazes de induzir respostas pró-inflamatórias,
anti-inflamatórias ou secretórias que podem inibir a carcinogênese. Vários
estudos têm comprovado a eficácia dos probióticos na prevenção e tratamento de
diarreia associada aos antibióticos [39].
Qual é a
quantidade recomendada de probióticos?
O Grupo de Trabalho
Conjunto da Organização das Nações Unidas para a Alimentação e Agricultura
(FAO) e da Organização Mundial de Saúde (OMS) definiu os “probióticos como microrganismos
vivos que, quando administrados em quantidades adequadas, conferem um benefício
tanto para a saúde humana quanto para o hospedeiro” [40]. Esta definição é
amplamente aceita e adotada pela Associação Científica Internacional de
Probióticos e Prebióticos [41]. Os diferentes
probióticos são estudados e comercializados na forma de preparações contendo um
único ou uma combinação de microrganismos. O probiótico deve se apresentar
viável na preparação e manter essa viabilidade no ecossistema digestivo, condição
indispensável para a sua atuação [42].
A Legislação Brasileira
define que a quantidade mínima viável para o “probiótico deve estar situada na
faixa de 108 a 109 UFC (unidades formadoras de colônias)
na porção diária do alimento para ser de importância fisiológica para o
consumidor” [41]. O consumo de quantidades adequadas dos microrganismos
probióticos desejados nos bioprodutos (109
a 1010 UFC/100g de produto) é suficiente para a manutenção das
concentrações ativas fisiologicamente (quantidade intestinal de 106
a 107 UFC/g) “in vivo” [42]. De forma geral, os probióticos vão
atuar em conjunto com os microorganismos
na
microbiota do indivíduo auxiliando na barreira protetora formada
por ela assim
produzindo compostos que inibem o crescimento de microrganismos
patogênicos e
até mesmo competindo por nutrientes, fator muito importante no
controle de
patógenos [40] Em relação à
nutrição e digestão, os probióticos
auxiliam na
produção de alguns compostos, como vitaminas do complexo
B, que são importantes
para proteção do fígado, influenciam no
trânsito intestinal, ajudam na absorção
de nutrientes, também podem aumentar o valor nutritivo dos
alimentos e promove
uma redução na acidez durante armazenamento do produto
final [42]. Para
proteger os micro-organismos da ação ácida do
estomago é utilizado
carboidratos, que podem ser açúcares ou fibras, chamados
de prebióticos,
para envolver essas bactérias e impedir que o ácido clorídrico do estômago
degrade as cepas em indivíduos saudáveis.
Quadro 1 - Probióticos mais utilizados conforme ANVISA/OMS.
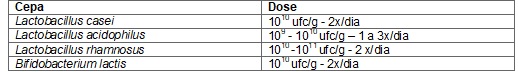
Fonte: (ANVISA/OMS)
[40,41].
A imunorregulação
induzida pelos probióticos pode atuar a nível local e sistêmico. A nível local,
promove a inibição da adesão de microrganismos patogênicos, a atividade anti-microbiana, a produção de mucinas, o reforço da função
de barreira intestinal e a produção de citocinas pró-inflamatórias. A nível
sistêmico que regula a proliferação de linfócitos B e linfócitos T e a produção
de imunoglobulinas. Sugerem um efeito positivo na modulação da microbiota
intestinal na prevenção e no tratamento de doenças metabólicas relacionadas com
a obesidade [43]. Nesse contexto, Aguilar et
al. [44] encontraram redução nos níveis de coliformes totais e aumento nos
níveis de lactobacilos no trato gastrointestinal de ratos Zucker
obesos após suplementação com o probiótico BIO-L6®, que continha 10 cepas do
gênero Lactobacillus, durante nove semanas, mostrando
a capacidade de modulação benéfica da microbiota intestinal. Além disso,
encontraram redução de marcadores inflamatórios como fator de necrose tumoral α
(TNF-α) e interleucinas 4, 10 e 11. Esse mecanismo pode configurar-se como
efeito benéfico ao combater o estado de inflamação associado à obesidade.
Kadooka et al. [45], utilizando Lactobacillus casseri LG2055 foi aproximadamente 5x1010 CFU/100g/dia
via oral em indivíduos obesos, verificaram que os probióticos comparados ao
placebo determinaram redução de adiposidade visceral, além de redução de peso
corporal e circunferência da cintura.
Em outro estudo [46]
com ratos obesos e diabéticos induzidos por dieta (Ob/ob) alimentados com dieta hiperlipidica
e suplementada com oligofrutose (0,3 g/dia)
adicionada em água, a suplementação prebiótica
diminuiu filos Firmicutes
e aumentou Bacteroidetes.
Além disso, os prebióticos melhoraram a tolerância à
glicose, aumentaram o número de células L e os parâmetros associados (expressão
do ARNm do proglucagon
intestinal e níveis plasmáticos de peptídeo-1 semelhante ao glucagon) e
reduziram o desenvolvimento de massa gorda, estresse oxidativo e inflamação de
baixo grau. Em ratos alimentados com dieta hiperlipidica,
o tratamento prebiótico melhorou a sensibilidade à
leptina, assim como os parâmetros metabólicos.
Nguyen et al. [47] utilizaram suplemento de plantarum PH04 em ratos
hipercolesterolêmicos na quantidade de 107 UFC/g/rato/dia, durante
14 dias. Comparado com um grupo controle, o colesterol sérico e os
triglicerídeos foram respectivamente 7 e 10% menores no grupo alimentado com L. plantarum
PH04 sem diferenças significativas no peso corporal, no índice de peso visceral
e translocação bacteriana entre dois grupos. Os resultados indicaram que L. plantarum
PH04 poderia ser eficaz como um probiótico com atividades de redução do
colesterol.
Conforme estudo [48]
com ratos alimentados com dieta hiperlipídica e
suplementaram Lactobacillus plantarum
LS/07 e Lactobacillus plantarum Biocenol LP96, as cepas probióticas foram proporcionadas em
dose 3 × 109 CFU de cepas/1mL, cada rato recebeu aproximadamente
1,5x109 CFU de lactobacilos via oral. Os resultados mostram que Lactobacillus plantarum LS/07
reduziu o colesterol sérico e o colesterol LDL, mas o Lactobacillus
plantarum Biocenol LP96
diminuiu os triglicerídeos e VLDL. Ambas as cepas probióticas reduziram os
ácidos biliares totais no soro.
Assim a definição do
efeito dos prebióticos ainda é algo a ser explorado,
visto que a maioria dos estudos existentes apresenta fatores de confusão e/ou
baixa comparabilidade por lançarem mão de diferentes modelos experimentais, e
diferentes métodos de análise, espécie estudada (maioria dos estudos feitos em
animais), falta de padronização dos graus de adiposidade corporal, da idade dos
participantes e da dieta empregada.
Conclusão
A administração de
probióticos e prebióticos tem sido amplamente
utilizada para manipular a microbiota intestinal. No entanto, apesar de vários
estudos relatarem resultados promissores, ainda não há evidência clínica sólida
recomendando seu uso terapêutico para doenças metabólicas. Também faltam
estudos clínicos de longo prazo. Portanto, estudos adicionais e ensaios
clínicos randomizados, usando probióticos e prebióticos,
são necessários para entender melhor seu impacto na manipulação da microbiota
intestinal. Os estudos sobre a influência de nutrientes específicos e/ou
alimentos funcionais para tratar a obesidade estão no início e ainda são
inconclusivos para que se possa identificar estratégias nutricionais capazes de
promover modulação da microbiota intestinal e minimizar as complicações da
obesidade. A partir da determinação de estratégias eficazes para a combinação
de dietas com utilização de prebióticos e/ou
probióticos será possível estabelecer uma forma de alimentação personalizada
e/ou estratégias terapêuticas para a manipulação da microbiota intestinal a
favor da manutenção da saúde dos indivíduos.
Refêrencias
- World
Health Organization (WHO). Obesity and overweight. Fact sheet no. 311. WHO Media Center.
http://www.who.int/mediacentre/factsheets/fs311/en/.
- ABESO. Associação
Brasileira para Estudo da Obesidade.
http://www.abeso.org.br/noticia/dia-nacional-de-prevencao-da-obesidade.
- Pistelli GC, Costa CEM.
Bactérias intestinais e obesidade. Revista Saúde e Pesquisa 2010;3(1):115-6.
- Gérard P. Gut microbiota and obesity. Cell Mol Life Sci 2016;73:147-62. https://doi.org/10.1007/s00018-015-2061-5
- Graham
C, Mullen A, Whelan K. Obesity and the gastrointestinal microbiota: a review of
associations and mechanisms. Nutr Rev
2015;73:376-85. https://doi.org/10.1093/nutrit/nuv004
- Festi D, Schiumerini
R, Eusebi LH, Marasco G, Taddia M, Colecchia A. Gut microbiota and metabolic syndrome. World J Gastroenterol 2014;20(43):16079-94.
https://doi.org/10.3748/wjg.v20.i43.16079
- Jumpertz RDS, Turnbaugh PJ, Trinidad C, Bogardus
C, Gordon JI et al. Energy-balance studies reveal
associations between gut microbes, caloric load and nutrient absorption in
humans. Am J Clin Nutr 2011;94(1):58-65.
https://doi.org/10.3945/ajcn.110.010132
- DiBaise JK, Zhang H, Crowell
MD, Krajmalnik-Brown R, Decker GA, Rittmann BE. Gut microbiota and its possible relationship
with obesity. Mayo Clin Proc 2008;83(4):460-9. https://doi.org/10.4065/83.4.460
- Petschow B, Doré
J, Hibberd P, Dinan T, Reid G, Blaser M et al.
Probiotics, prebiotics, and the host microbiome: the science of translation. Ann N Y Acad Sci 2013;1306(1):1-17.
https://doi.org/10.1111/nyas.12303
- Frota KMG, Soares NRM,
Muniz VRC, Fontenelle LC, Carvalho CMRG. Efeito de prebióticos
e probióticos na microbiota intestinal e nas alterações metabólicas de
indivíduos obesos. Nutrire 2015;40(2):173-87. https://doi.org/10.4322/2316-7874.55314
- Quigley
EMM. Prebiotics and probiotics; modifying and mining the microbiota. Pharmacol Res 2010;61(3):2138.
https://doi.org/10.1016/j.phrs.2010.01.004
- Park
DY, Ahn YT, Park SH, Huh CS, Yoo
SR, RYu R, MSung MK, McGrego RA, Choi MS. Supplementation of Lactobacillus curvatus HY7601 and Lactobacillus plantarum KY1032 in
diet-induced obese mice is associated with gut microbial changes and reduction
in obesity. PloS ONE 2013;8(3):e59470.
https://doi.org/10.1371/journal.pone.0059470
- Rodrigues A. Microbiota
intestinal e sua possível relação com a obesidade. ABESO
2011;53(5):5-7.
- Gerritsen
J, Smidt H, Rijkers GT, Vos WM. Intestinal microbiota
in human health and disease: the impact of probiotics. Genes Nutr 2011;6(3):209-40. https://doi.org/10.1007/s12263-011-0229-7
- Nibali
L, Henderson B, Sadiq ST, Donos N. Genetic dysbiosis:
the role of microbial insults in chronic inflammatory diseases. J Oral Microbiol 2014;25(6). https://doi.org/10.3402/jom.v6.22962
- Myles IA. Fast food fever: reviewing the impacts of the Western diet on immunity. Nutr J 2014;13:61.
https://doi.org/10.1186/1475-2891-13-61
- Dasu MR, Ramirez S, Isseroff
RR. Toll-like receptors and diabetes: a therapeutic perspective. Clin Sci
2012;122(5):203-14. https://doi.org/10.1042/cs20110357
- Shen
J, Obin MS, Zhao L. The gut microbiota, obesity and
insulin resistance. Mol Aspects Med 2013;34(1):39-58.
https://doi.org/10.1016/j.mam.2012.11.001
- Vijay-Kumar
M, Aitken JD, Carvalho FA, Cullender TC, Mwangi S, Srinivasan S, Sitaraman SV, Knight R, Ley RE Gewirtz AT. Metabolic
syndrome and altered gut microbiota in mice lacking Toll-Like Receptor 5.
Science 2010;328(5975):228-31. https://doi.org/10.1126/science.1179721
- Gibson
GR, Roberfroid MB. Dietary modulation of the human
colonic microbiota: introducing the concept of prebiotics. J Nutr 1995;125(6):1401-12.
https://doi.org/10.1093/jn/125.6.1401
- Flesch
AG, Poziomyck AK, Damin DC.The therapeutic use of symbiotics. Arq Bras
Cir Dig 2014;27(3):206-9.
https://doi.org/10.1590/s0102-67202014000300012
- Denipote FG, Trindade EB, Burini RC. Probiotics and
prebiotics in primary care for colon cancer. Arq
Gastroenterol 2010;47(1):93-8. https://doi.org/10.1590/s0004-28032010000100016
- Horvat
M, Krebs B, Potrc S, Ivanecz
A, Kompan L. Preoperative synbiotic
bowel conditioning for elective colorectal surgery. Wien Klin Wochenschr
2010;122(Suppl2):26-30. https://doi.org/10.1007/s00508-010-1347-8
- Organização Mundial de Gastroenterologia (OMGE). Guias práticos: Probióticos e Prebióticos; 2011. http://www.worldgastroenterology.org/assets/export/userfiles/Probiotics_FINAL_pt_2012.pdf
- Hill
C, Guarner F, Gregor Reid G, Glenn R Gibson GR, Merenstein DJ, Pot B, Morelli L, Canani
RB, Flint HJ, Salminen S, Calder FC, Sanders ME. The International Scientific Association for Probiotics and
Prebiotics consensus statement on the scope and appropriate use of the term
probiotic. Nat Rev Gastroenterol Hepatol
2014;11(8);506-14. https://doi.org/10.1038/nrgastro.2014.66
- Salminen S, Loveren
H. Probiotics and prebiotics: health claim substantiation. Microb
Ecol Health Dis 2012;23.
https://doi.org/10.3402/mehd.v23i0.18568.
- Hutkins RW, Krumbeck JA, Bindels LB, Cani PD, Fahey G, Goh YJ, Hamaker
B, Martens EC, Mills DA, Rastal RA, Vaughan E,
Sanders ME. Prebiotics: why definitions matter. Curr Opin Biotechnol 2016;37:1-7.
https://doi.org/10.1016/j.copbio.2015.09.001
- European
Food Safety Authority. Reasoned opinion on the modification of the existing
maximum residue levels (MRLs) for dazomet in several vegetables EFSA Journal
2015;13(3):4049. https://doi.org/10.2903/j.efsa.2015.4049
- Mookiah S, Sieo
CC, Ramasamy K, Abdullah N, Ho YW. Effects of dietary prebiotics, probiotic and
synbiotics on performance, caecal
bacterial populations and caecal fermentation
concentrations of broiler chickens. J Sci Food Agric 2014;94(2):341-8.
https://doi.org/10.1002/jsfa.6365
- Khaksar
V, Golian A, Kermanshahi H.
Immune response and ileal microflora in broilers fed wheat-based diet with or
without enzyme Endofeed W and supplementation of
thyme essential oil or probiotic PrimaLac. African
Journal of Biotechnology 2012;11(81):14716-23.
- Pedroso
AA, Hurley-Bacon AL, Zedek AS, Kwan TW, Jordan APO,
Avellaneda G, Hofacre CL, Oakley BB, Collett SR,
Maurer JJ, Lee MD. Can probiotics improve the environmental microbiome and resistome of commercial poultry production? Int J Environ
Res Public Health 2013;10(10):4534-59. https://doi.org/10.3390/ijerph10104534
- Abdelqader A, Irshaid
R, Al-Fataftah A-R. Effects of dietary probiotic
inclusion on performance, eggshell quality, cecal
microflora composition, and tibia traits of laying hens in the late phase of
production. Trop Anim Health Prod 2013;45(4):1017-24.
https://doi.org/10.1007/s11250-012-0326-7
- Mountzouris K, Tsitrsikos
P, Palamidi I, Arvaniti A, Mohnl M, Schatzmayr G, Fegeros K. Effects of probiotic inclusion levels in broiler
nutrition on growth perfor-mance, nutrient
digestibility, plasma immunoglobulins, and cecal
microflora composition. Poult Sci 2010;89(1):58-67.
https://doi.org/10.3382/ps.2009-00308
- Daskiran M, Onol
AG, Cengiz O, Unsal H, Turkyilmaz
S, Tatli O, Sevim O.
Influence of dietary probiotic inclusion on growth performance, blood
parameters, and intestinal microflora of male broiler chickens exposed to posthatch holding time. J Appl Poult
Res 2012;21(3):612–22.
https://doi.org/10.3382/japr.2011-00512
- Rahman
M, Mustari A, Salauddin M,
Rahman M. Effects of probiotics and enzymes on growth performance and haematobiochemical parameters in broilers. Journal of the
Bangladesh Agricultural University 2013;11(1):111-8.
https://doi.org/10.3329/jbau.v11i1.18221
- Bai
S, Wu A, Ding X, Lei Y, Bai J, Zhang K,Chio
J. Effects of probiotic-supplemented diets on growth performance and intestinal
immune characteristics of broiler chickens. Poultry Sci 2013;92(3):663-70.
https://doi.org/10.3382/ps.2012-02813
- Bindels LB, Neyrinck AM, Claus SP, Roy CIL, Grangette
C, Pot B, Martinez I, Walter JD, Cani P, Delzenne N. M. Synbiotic approach
restores intestinal homeostasis and prolongs survival in leukaemic
mice with cachexia. The ISME Journal 2016;10;1456-70.
https://doi.org/10.1038/ismej.2015.209
- Varavallo MA, Santos TT. A importância de
probióticos para o controle e/ou reestruturação da microbiota intestinal.
Revista Itpac 2011;4(1).
- Verspreet J, Damen
B, Broekaert WF, Verbeke K,
Delcour JA, Courtin CM. A critical look at prebiotics within the dietary fiber concept. Annu Rev Food Sci Technol 2016;7:167-90.
https://doi.org/10.1146/annurev-food-081315-032749
- FAO/WHO.
Health and nutritional properties of probiotics in food including powder milk
with live lactic acid bacteria. Food and
Agriculture Organization of the United Nations;
2001.
- Agência Nacional de
Vigilância Sanitária (ANVISA). Guia para Comprovação da Segurança de Alimentos
e Ingredientes e substâncias bioativas e probióticos. Pag.(7)
[citado 2017 mar 14]. Disponível em:
http://portal.anvisa.gov.br/documents/33916/395734/Guia+para+Comprova%C3%A7%C3%A3o+da+Seguran%C3%A7a+de+Alimentos+e+Ingredientes/f3429948-03db-4c02-ae9c-ee60a593ad9c
- Nogueira JCR, Gonçalves
RCM. Probióticos – Revisão da Literatura. Revista Brasileira de
Ciências da Saúde 2011;15(4):487-92.
- Sociedade Portuguesa de
Endoscopia Digestiva – SPED. 2009. [citado 2017 mar 16]. Disponível em:
http://www.sped.pt/images/Publicacoes_SPED/TemaRevisao_Probioticos_Jul10.pdf
- Aguilar LT, Esparza
JRE, Fragoso LR. Effect of probiotic Bio-L6® on
intestinal morphology, microbiota abd serum cytokines
in obese Zucker rats. FASEBJ 2014;28(1):633-47.
- Kadooka Y, Sato M, Imaizumi K, Ogawa A, Ikuyama K,
Akai Y et al. Regulation of abdominal adiposity by probiotics (Lactobacillus gasseri SBT2055) in adults with obese tendencies in a
randomized controlled trial. Eur J Clin Nutr
2010;64(6):636-43. https://doi.org/10.1038/ejcn.2010.19
- Everard
A, Lazarevic V, Derrien M, Girard M, Muccioli GG, Muccioli GM et al.
Responses of gut microbiota and glucose and lipid metabolism to prebiotics in
genetic obese and diet-induced leptin-resistant mice. Diabetes
2011;60(11):2775-86. https://doi.org/10.2337/db11-0227
- Nguyen
TD, Kang JH, Lee MS. Characterization of Lactobacillus plantarum PH04, a
potential probiotic bacterium with cholesterol-lowering effects. Int J Food
Microbiol 2007;113:358-61.
https://doi.org/10.1016/j.ijfoodmicro.2006.08.015
- Salaj R, Štofilová
J, Šoltesová
A, Hertelyová Z, Hijová E, Bertková I, Strojný L, Kružliak P, Bomba A. The effects
of two Lactobacillus plantarum strains on rat lipid metabolism receiving a high
fat diet. Scientific World Journal
2013:135142. https://doi.org/10.1155/2013/135142