REVISÃO
Mecanismos
moleculares associados à hipertrofia e hipotrofia muscular: relação com a
prática do exercício físico
Molecular mechanisms associated with muscle hypertrophy and hypotrophy:
relationship with physical exercise
Waldecir Paula Lima, D.Sc.
Professor
Titular do Instituto Federal de Educação, Ciência e Tecnologia de São Paulo
(IFSP), Professor e Orientador do Programa Stricto sensu em Biomateriais – EM
(IFSP), Doutor em Biologia Celular e Tecidual pelo Instituto de Ciências
Biomédicas da Universidade de São Paulo (ICB-USP)
Recebido em 29 de
março de 2016; aceito em 12 de abril de 2016.
Endereço
para correspondência:
Waldecir Paula Lima, Instituto Federal de São Paulo, Rua Pedro Vicente, 625,
Canindé, 01109-010 São Paulo SP, E-mail: waldecir@ifsp.edu.br
Resumo
As células (fibras)
musculares estriadas esqueléticas são altamente especializadas, podendo
apresentar uma alta capacidade de adaptação morfológica, resultando, entre
outras adaptações, em hipertrofia e hipotrofia muscular. Considerando que os
processos de hipertrofia e hipotrofia muscular estão diretamente relacionados
ao turnover proteico muscular, é importante destacar que as vias de síntese e
degradação proteica ocorridas nesta célula são estimuladas por diversos sinais
extracelulares controlados, destacando-se a prática do exercício físico agudo e
crônico. Em linhas gerais, a hipertrofia muscular está relacionada com as
seguintes vias de sinalização: Akt/mTOR (mammalian Target of Rapamycin) e
regulação das AMPK (adenosine mono
phosphate/AMP-activated protein kinase); ativação das células satélites;
calcineurina/NFAT (Nuclear Factor of
Activated T cells); regulação da miostatina. A hipotrofia muscular
relaciona-se com as vias: sinalização das catepsinas ou lisossomais; calpaínas
dependentes de cálcio (Ca2+); caspases; ubiquitina proteassoma
ATP-dependente (UPS); FoxO (Forkhead box O); TNFα (Tumor Necrosis Factor-α); NFkB (Nuclear Factor kappa-B);
glicocorticoides. Sendo assim, o objetivo deste estudo de revisão é elucidar
estas vias envolvidas nos processos de hipertrofia e hipotrofia muscular,
relacionando-as com os diversos tipos de exercício e treinamento físico.
Palavras-chave: treinamento físico, vias de sinalização, células satélites, miostatina.
Abstract
The cells (fibers) skeletal striated muscles are highly specialized and
may have a high capacity of morphological adaptation, resulting, among other
adaptations in muscle atrophy and hypertrophy. Whereas the enlargement
processes and muscle atrophy are directly related to muscle protein turnover,
it is important to note that the process of protein synthesis and degradation
occurring in this cell is stimulated by several controlled extracellular
signals, especially the practice of acute and chronic exercise. In general,
muscle hypertrophy is related to the following signaling pathways: Akt/mTOR (mammalian Target of
Rapamycin) and regulation of AMPK (adenosine mono phosphate/AMP-activated
protein kinase); activation of satellite cells; calcineurin/NFAT
(Nuclear Factor of Activated T cells); regulation of myostatin.
Muscle atrophy relates to the routes: signaling of cathepsins
or lysosomal; calpain-dependent calcium (Ca2+);
caspases; ATP ubiquitin dependent proteasome (UPS); FOXO (forkhead
box O); TNFα (Tumor Necrosis Factor-α); NFkB (nuclear factor kappa B); glucocorticoids. Thus, the
aim of this review study is to elucidate these pathways involved in hypertrophy
processes and muscle atrophy, relating them to the various types of exercise
and physical training.
Key-words: physical
training, signaling pathways, satellite cells, myostatin.
Introdução
As células musculares
estriadas esqueléticas (fibras musculares), inseridas nos músculos estriados
esqueléticos, são altamente especializadas, podendo apresentar uma alta
capacidade de adaptação morfológica. Objetivamente, estas adaptações resultam
em duas situações: no aumento do tamanho das células musculares, denominada
hipertrofia e na diminuição do tamanho das células musculares, denominada
hipotrofia.
Importante ressaltar
que os processos de hipertrofia e hipotrofia que ocorrem em cada fibra (célula)
muscular, promovem, quando analisadas de forma macro, alterações morfológicas
no órgão músculo, denominadas hipertrofia e hipotrofia muscular. Estes
processos estão relacionados à área de secção transversa dos músculos (AST), ou
seja: um aumento da AST reflete em hipertrofia muscular e uma diminuição da AST
reflete em hipotrofia muscular.
Considerando que os
processos de hipertrofia e hipotrofia (atrofia) muscular estão diretamente
relacionados ao turnover proteico muscular, é importante destacar que as vias
de síntese e degradação proteica ocorridas na célula muscular estriada
esquelética são estimuladas por diversos sinais extracelulares controlados,
entre outros, por hormônios, citocinas, fatores de crescimento e potenciais de
ação (estímulos neurais), permitindo a possibilidade da remodelação destas
células a partir de um processo dinâmico. Desta forma, entende-se que o aumento
da massa magra (hipertrofia muscular) ou diminuição da massa magra (hipotrofia
muscular) ocorrem pelo balanço positivo ou negativo entre a síntese e
degradação proteica, promovido pela integração coordenada de uma rede
extremamente complexa de vias de sinalização intracelular.
Em linhas gerais, a
hipertrofia e a hipotrofia muscular estão relacionadas com as seguintes vias de
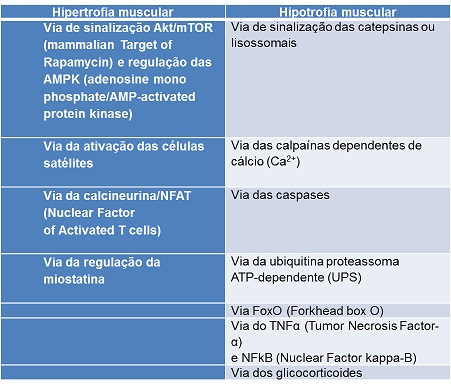
sinalização, descritas no quadro 1 [1-4].
Quadro
1 - Vias de sinalização
relacionadas aos processos de hipertrofia e hipotrofia muscular [1-4].
Destacam-se, como
estratégia para estímulo destas vias, o treinamento físico e o desuso muscular,
muito embora, atualmente, não exista clareza na relação entre os diversos tipos
de exercício agudo e crônico e as vias de sinalização intracelulares que
promovem a hipertrofia e a hipotrofia de células musculares estriadas
esqueléticas.
Sendo assim, o
objetivo deste estudo de revisão é elucidar as principais vias envolvidas nos
processos de hipertrofia e hipotrofia muscular, relacionando-as com os diversos
tipos de exercício e treinamento físico.
Revisão
da literatura
Hipertrofia
muscular: vias de sinalização intracelular
Segundo Goldberg et al. [5], o processo de hipertrofia do
músculo estriado esquelético é resultado do aumento da área de secção
transversal da fibra muscular, culminando com o aumento da área de secção
transversal do músculo. Embora, atualmente, os mecanismos responsáveis pela
hipertrofia muscular ainda não estejam totalmente elucidados, há muito tempo
Denny-Brown [6] e Goldspink [7], entre outros pesquisadores, apontaram que
processos como o aumento da síntese proteica, o aumento do número e tamanho das
miofibrilas e a adição de sarcômeros no interior da fibra muscular são
fundamentais para que o músculo obtenha esta adaptação morfológica. Na
sequência, serão abordados os principais mecanismos relacionados ao processo de
hipotrofia muscular.
Via de
sinalização Akt/mTOR (mammalian Target of Rapamycin) e
regulação das AMPK (adenosine mono phosphate/AMP-activated protein kinase)
A AKT, uma
serina/treinina quinase também denominada de proteína quinase do tipo B (PKB),
apresenta destacada função em uma das diversas vias de sinalização intracelular
que regula a síntese proteica, além de controlar outros diversos marcadores
fundamentais das vias regulatórias de funcionamento celular, relacionados a
metabolismo, proliferação, sobrevivência, consumo de glicose, angiogênese e
crescimento [8].
A família da Akt é
constituída de três isoformas: Akt1, Akt2 e Akt3, embora exista uma
predominância da expressão de Akt1 e Akt2 em células musculares estriadas
esqueléticas.
A fosforilação e
consequente ativação da Akt são conhecidas por uma diversidade de estímulos,
como os fatores de crescimento (IGF1), as citocinas (Interleucinas) e os
hormônios (insulina, testosterona e outros), sugerindo um importante papel da
Akt na promoção de síntese proteica celular.
Um esquema
simplificado da via de IGF1/Akt é mostrado na Figura 1.

Figura
1 - Um esquema simplificado da via de IGF1-Akt.
Adaptação de Schiaffino e Mammucari [9].
A ligação de IGF-1 ao
seu receptor conduz à ativação da tirosina-quinase intrínseca e sua
autofosforilação, gerando sítios de ligação para o substrato receptor da
insulina (IRS), que também é fosforilado pelo receptor de IGF1. O IRS
fosforilado atua também como um sítio de ligação para recrutar e,
posteriormente, ativar o fosfatidilinositol-3-quinase (PI3K) que, por sua vez,
fosforila fosfolípidos da membrana, gerando o fosfoinositide-3,4,5-trifosfato
(PIP3). O PIP3 age como um local de ancoragem para duas quinases: as
dependentes de fosfatidilinositol quinase-1 (PDK1) e a Akt. A subsequente
fosforilação da Akt, na serina 308 por PDK1, é que propicia a ativação da Akt.
Todas estas etapas ocorrem na superfície interna da membrana celular
(denominada sarcolema, na célula muscular estriada esquelética). A Akt inibe a
degradação proteica por fosforilar os fatores de transcrição da família FoxO, promovendo inibição de sua atividade (maiores
informações no item 2.2.2e) e estimula a síntese proteica por meio da ativação
da proteína alvo de mamífero de rapamicina ou mammalian Target of Rapamycin
(mTOR) e inibição da 3β glicogênio sintase quinase (GSK3β), entre
outras moléculas sinalizadoras [8].
Importante ressaltar
que a Figura 01 mostra que os fatores de transcrição FoxO
são necessários para a regulação da transcrição das ubiquitinas ligases
atrogin-1 (ou MAFbx) e MuRF1, conduzindo à ubiquitinação de miosina e outras
proteínas musculares, com a sua degradação por ação do proteassoma 26S. Os FoxOs também são necessários para regular a transcrição da
proteína denominada cadeia leve associada a microtúbulos-3 (LC3) que, em
conjunto com a Bcl2, é essencial para a ativação da via de autofagia
lisossomal.
No que tange a via de
estimulação da síntese proteica, TOR é uma proteína serina/treonina quinase com
grande tamanho molecular (cerca de 300 kDa),
que
pertence a família de quinases relacionadas com o
fosfatidilinositol (PIK). TOR
foi primeira e timidamente descrita, em 1991, como uma proteína
relacionada com
aspectos antifúngicos e imunossupressores [10]. Estudos
posteriores revelaram
diversas funções importantes de TOR, evidenciando esta
proteína quinase na
posição central da rede de sinalização que
regula o crescimento celular. As
funções da TOR englobam a regulação do
metabolismo, da tradução e transcrição
proteica, em resposta a ativação de nutrientes e fatores
de crescimento [11].
Segundo Zoncu, Efeyan
e Sabatini [12], a ação da Akt em mTOR é indireta: a
Akt inibe as proteínas complexas de tuberinas escleroses ou tuberous sclerosis complex (TSC1 e
TSC2), que atuam como proteínas de ativação de GTPase (GAP) para inibir a
proteína Ras homólogo enriquecido no cérebro ou Ras homolog enriched in brain (Rheb) que ativa a sinalização de
mTOR. A mTOR forma dois complexos de proteínas
diferentes, a mTORC1 sensível à rapamicina, quando ligado a raptor, e a mTORC2
insensível à rapamicina, quando ligado a rictor. A mTORC2
é necessária para a fosforilação e ativação de Akt, enquanto a mTORC1 fosforila
a quinase S6 (S6K), que por sua vez, fosforila a proteína ribossómica S6 e
outros fatores envolvidos no início da tradução gênica, estimulando, assim, a
síntese de proteínas. A mTORC1 também ativa a início
da tradução gênica do fator 4E (eIF4E) por fosforilação das proteínas
inibidoras de ligação eIF4E (4EBPs). A Akt também promove a síntese de
proteínas por, diretamente, fosforilar e inativar a GSK3β, promovendo,
assim, a inibição do fator de iniciação de tradução 2B (eIF2B).
Watson e Baar [13]
relatam em seu artigo intitulado mTOR and the health
benefits of exercise, que o exercício físico agudo, mas, sobretudo, o crônico,
pode trazer diversos benefícios à saúde por, dentre vários aspectos, modular a
ativação da proteína mTOR.
Hoppeler et al. [14] citam que o treinamento,
principalmente com cargas elevadas, estimula, por diversas vias intervenientes,
a atividade aumentada da via AKT/m-TOR nas células musculares estriadas
esqueléticas, resultando em maior síntese proteica e, consequentemente, aumento
do trofismo celular.
Em contrapartida,
Atherson et al. [15] apontam que o exercício
crônico de endurance aumenta a atividade da proteína quinase ativada por AMP ou
adenosine mono phosphate (AMP)-activated protein kinase (AMPK),
resultando em fosforilação da TSC2 com consequente inatividade da mTOR,
induzindo a inibição da síntese proteica quando da prática deste tipo de
treinamento.
Considerando a
relação AMPK e AKT/mTOR com o exercício físico, uma
combinação de uma mesma sessão de exercícios de endurance e de força foi reportada para verificar a resposta
hipertrófica. Apró et al. [16] apresentavam como hipótese que
o aumento de AMPK, induzido pelo exercício de endurance, poderia inibir da sinalização mTORC1. Esta hipótese foi
testada em oito homens treinados que realizaram exercícios de endurance na bicicleta e, depois, exercícios
resistidos. Verificou-se um aumento significativo da atividade de AMPK.
Contudo, a elevação induzida pelo ciclismo intervalado de alta intensidade na
atividade da AMPK não inibiu a atividade do mTORC1
após exercícios resistidos subsequentes, embora os autores do estudo façam
resalva a uma possível interferência na resposta hipertrófica, por possível
influência em componentes-chave em outras vias da degradação de proteínas.
Sendo assim,
entende-se que a influência da AMPK na atividade de mTORC1
por indução da prática de exercício físico agudo e crônico não está bem
estabelecida. Postulando investigar mais amplamente esta relação, Vissing et al. [17] desenvolveram um estudo com
homens que foram divididos em 3 grupos: praticantes de exercícios (10 semanas)
de endurance, praticantes de
exercícios (10 semanas) de força e grupo de não praticantes (controle). Os
dados foram obtidos antes e durante a recuperação pós-atividade de uma sessão
aguda de exercício compatível com o realizado nas semanas de treinamento. Houve
aumento significativo, após o exercício de força, nas concentrações do fator de
crescimento semelhante à insulina-1 (IGF-1), AKT fosforilado, mTOR e glicogênio sintase quinase-3, entre outros marcadores
de estimulação de síntese proteica. O aumento da fosforilação da AMPK foi
observado após exercícios de endurance,
embora tenha apresentado o mesmo aumento em relação ao pós-exercício de força.
Os resultados confirmam que em indivíduos treinados, a sinalização de mTORC1 é preferencialmente ativada após o exercício, o que
induziria a hipertrofia muscular, enquanto a sinalização AMPK é menos
específica, quando se trata de sua relação com uma possível inibição da via
hipertrófica, para os diferentes tipos de exercício.
Via das
células satélites
As fibras (células)
musculares esqueléticas e os respectivos músculos formados por elas possuem
grande capacidade de adaptação frente a diversas situações fisiológicas, tais
como o crescimento, o treinamento físico, os danos/lesões, entre outras. Pelo
fato das fibras musculares estriadas esqueléticas adultas se apresentarem
extremamente diferenciadas, essa exacerbada condição de adaptação que estas
células apresentam é atribuída a outro tipo de célula residente no músculo
esquelético adulto, denominada de célula satélite [18].
Foi indicada, em
importante e pioneira publicação no Journal
of Biophysical and Biochemical Cytology [19], a primeira descrição das
células satélites musculares. Como características específicas, as células
satélites são mononucleadas e indiferenciadas, apresentando sua membrana em
comunicação com a membrana da fibra muscular (sarcolema) e com a
membrana/lâmina basal. Sua denominação está relacionada com a sua localização,
anexada na periferia de fibras musculares estriadas esqueléticas, que são
células multinucleadas (Figura 2).

Em destaque: Membranas
da Célula Satélite (sp), Fibra Muscular (mp) e Basal
(bm) Microscopia eletrônica, aumento: 22.000 X. Fonte: [19].
Figura
2 - Corte transversal de uma fibra muscular
esquelética do músculo sartório de rato.
Do ponto de vista
funcional, as células satélites apresentam grande atividade mitogênica,
contribuindo substancialmente para o crescimento/desenvolvimento do músculo na
fase pós-natal, o reparo de fibras musculares lesionadas e a manutenção do
músculo esquelético morfologicamente constituído.
Importante ressaltar
que quando o músculo não recebe interferências externas ou internas que resultam
em alterações estruturais, como lesões, as células satélites permanecem em
estado quiescente, ou seja, estado de dormência/repouso/não ativo. Contudo,
estímulos como o crescimento/desenvolvimento, lesões e regeneração/remodelação,
promovem alteração no comportamento destas células. Assim sendo, as células
satélites sairiam do estado quiescente para o estado de ativação e,
posteriormente, de proliferação. Ao se proliferarem, a partir de atividade
mitótica, se juntam e se fundem com a fibra muscular adjacente, promovendo
reparo de possível lesão. Ademais, doam seus núcleos para a fibra muscular,
aumentando a capacidade de síntese proteica da mesma, o que resultaria em
crescimento e desenvolvimento da fibra muscular – hipertrofia muscular [20]. É
fato que, em qualquer estado, estas células são capazes de expressarem diversos
marcadores da linhagem miogênica, apontados no quadro 2.
Quadro
2 - Marcadores moleculares utilizados para
identificar a população de células satélites do músculo estriado esquelético em
sujeitos adultos [18,21].

MNF = Fator Nuclear
dos Miócotos; Pax7 = Fator de Transcrição paired box;
c-Met = MET gene transformante; M-cadherin = M-caderina; NCAM = Molécula de
Adesão de Células Neurais; VCAM-1 = Molécula de Adesão de Células Vasculares;
MNF-β = Fatores de Regulação Miogênica do tipo Beta; Myf5 = Fatores de
Regulação Miogênica tipo Myf5 MyoD = fatores de regulação miogênica tipo MyoD;
Desmin = Desmina; Myogenin = Miogenina; c-ski = Regulador Transcricional do
tipo Ski; MNF-α = Fatores de Regulação Miogênica do tipo Alfa; BrdU =
Bromodeoxiuridina; PCNA = Antígeno Nuclear de Proliferação Celular
[3H]thymidine = [3H]timidina.
Diversos estudos
[21-24], especialmente os realizados com a técnica de cultivo celular (in
vitro), apontam para alguns fatores de crescimento como reguladores de
atividade, proliferação e diferenciação (em mioblastos) das células satélites
musculares Ademais, alguns hormônios e citocinas apresentam função regulatória
no comportamento das células satélites. Estes fatores de crescimento,
hormônios, citocinas e suas respectivas ações estão apresentados no quadro 3.
Quadro
3 - Alguns fatores de crescimento, hormônios e
citocinas e suas respectivas ações nas células satélites musculares [21-24].

Importante constatar
a característica autócrina das células satélites (células que produzem
secreção, lançam em direção ao meio extracelular e, posteriormente, receptam a
própria secreção), além de, também, serem moduladas por substâncias oriundas de
diversos outros territórios corporais, tais como sangue, células do sistema
imunológico, sistema nervoso [21].
Como respostas
fisiológicas aos possíveis estímulos funcionais (como, por exemplo, a prática
do exercício físico que promova microlesões musculares), a célula satélite
muscular apresenta a possibilidade de participar diretamente do processo de
reparação com consequente hipertrofia muscular [25]. É fato que a inativação
com diminuição da proliferação e da diferenciação destas células (exacerbada,
por exemplo, nos idosos), está relacionada ao processo de hipotrofia muscular
[26].
Via da calcineurina/NFAT
(Nuclear Factor of Activated T cells)
É fato inquestionável
que o Ca++ age como segundo mensageiro em
células musculares estriadas. Portanto, este íon é fundamental para o processo
de contração muscular tanto em músculo cardíaco quanto esquelético, embora os
mecanismos moleculares relacionados a essas contrações sejam diferentes.
Especificamente no
tecido muscular esquelético, os impulsos nervosos eferentes promovem, no nível
terminal, a liberação de acetilcolina e uma sucessiva despolarização na
membrana celular/sarcolema, chegando até os túbulos T. Nos túbulos T, os canais
de cálcio voltagem-dependentes, denominados também de Receptores de
Diidropiridina (DHPR) comunicam-se física e diretamente com um canal específico
de liberação de Ca++ do retículo sarcoplasmático, os receptores de
Rianodina (RyR1). Esta comunicação promove a abertura
dos canais de liberação do Ca++ do retículo sarcoplasmático,
promovendo a liberação deste Ca++ para o sarcoplasma, local onde
ocorre sua ligação com a troponina C do filamento de actina, iniciando o
processo mecânico de contração muscular [1].
Importante ressaltar
que, no músculo esquelético, a entrada de Ca2+ oriundo do meio extracelular
parece não ser fundamental para a contração muscular, diferente do que ocorre
no músculo cardíaco [27].
Ocorre que parte do
Ca++ liberado no sarcoplasma pode ligar-se a molécula de calmodulina
resultando no complexo Cálcio/calmodulina (Ca2+/CaM),
propiciando condições de ativar uma via alternativa que resultaria em estímulo
hipertrófico na fibra muscular estriada esquelética.
Segundo Sakuma e Yamaguchi
[28], a ligação do complexo Ca2+/CaM com a
subunidade reguladora da calcineurina, encaminha a sua ativação. A calcineurina
ativada, desfosforila: o NFATc1 (Fator Nuclear de
ativação das células T/C1 ou nuclear
factor of activated T cells c1), NFATc3 (Fator Nuclear de ativação das
células T/C3 ou nuclear factor of
activated T cells c3), MEF2C (Fator de potencialização de miócitos 2C ou Myocyte enhancer factor 2C) e MEF2A
(Fator de potencialização de miócitos 2A ou Myocyte
enhancer factor 2A), resultando em sua translocação desde o citoplasma até
o núcleo. Estes fatores de transcrição induzem a expressão de genes
hipertróficas e/ou de remodelação, tais como Dev MHC (Developmental myosin heavy chain), α-actina, IGF-I, miogenina
e IL-6 (Interleukin-6). Além disso, a calcineurina inibe o papel funcional da
Egr-1 e da miostatina, reconhecidos fatores estimuladores
de hipotrofia muscular.
Mais recentemente,
Hudson e Price [29] relatam outras possibilidades da relação entre a
calcineurina e o controle dos processos hipertróficos e hipotróficos (Figura
3).

As linhas sólidas
representam percursos estabelecidos enquanto as linhas pontilhadas representam
interações potenciais. A Ativação de PGC-1α (via MEF2 e NFAT) por meio da
ação da calcineurina está sendo considerada, atualmente, a principal cascata de
sinalização através da qual ela evita a perda de massa muscular. No entanto,
parece que a calcineurina apresenta potencial para ativar a miR-23a
(de forma direta e/ou indireta, via MEF2 e/ou NFAT), inibindo, assim, a ação de
atrogina-1 e MuRF1. Isso representaria um mecanismo adicional pelo qual a
calcineurina poderia prevenir a perda de massa magra. Adaptado de Hudson e
Price [29].
Figura
3 - Visão geral dos mecanismos promovidos pela
calcineurina em relação ao tamanho das fibras musculares estriadas
esqueléticas.
As linhas sólidas
representam percursos estabelecidos enquanto as linhas pontilhadas representam
interações potenciais. A Ativação de PGC-1α (via MEF2 e NFAT) por meio da
ação da calcineurina está sendo considerada, atualmente, a principal cascata de
sinalização através da qual ela evita a perda de massa muscular. No entanto,
parece que a calcineurina apresenta potencial para ativar a miR-23a
(de forma direta e/ou indireta, via MEF2 e/ou NFAT), inibindo, assim, a ação de
atrogina-1 e MuRF1. Isso representaria um mecanismo adicional pelo qual a
calcineurina poderia prevenir a perda de massa magra. Adaptado de Hudson e
Price [29].
Via da
regulação da miostatina
Identificada em 1997
[30] nas células musculares estriadas esqueléticas, a miostatina, também
conhecida como Fator de Crescimento e Diferenciação ou Growth Differentiation Factor-8 (GDF-8), é um membro dos fatores de
crescimento transformador-beta ou Transforming
Growth Factor-beta (TGF-β), pertencentes a
superfamília de fatores de crescimento e diferenciação secretados por diversas
células do organismo. Especificamente, a miostatina funciona como um regulador
negativo do crescimento do músculo esquelético [30]. Fica estabelecido, então,
que a célula muscular estriada esquelética predominaria em sinalizações que
resultariam em aumento da síntese proteica e hipertrofia muscular quando as
ações da miostatina estiverem minimizadas.
A miostatina é
considerada uma secreção autócrina (esclarecida anteriormente) e parácrina
(secretada em direção ao meio extracelular e receptada pelas células vizinhas).
Em conjunção, a miostatina é também considerada uma substância endócrina
(secretada em direção a rede vascular, transportada pelo plasma sanguíneo e
receptada por células de outros tecidos/territórios), como demonstrado por
Argilés et al. [31] em importante publicação no
periódico Drug Discovery Today.
A miostatina é uma
proteína sintetizada em uma forma bruta composta por 375 aminoácidos,
prioritariamente no músculo estriado esquelético. Após duas clivagens, gera o
Peptídeo Associado à Latência (LAP) (porção um N-terminal), com peso molecular
de 40 KDa e a miostatina madura (porção C-terminal),
com 26 KDa, A miostatina madura representa a parte biologicamente ativa
[32,33].
A função minimizada
da miostatina está associada a um aumento na massa muscular, já observado em
bois, ratos e, até, em humanos, assim como o bloqueio da miostatina melhora a
regeneração muscular observado em ratos knockout para a distrofia muscular de
Duchenne [34,35].
Durante a
embriogênese, a expressão da miostatina está restrita ao desenvolvimento de
músculos esqueléticos, embora a miostatina seja expressa por músculos
esqueléticos durante a vida adulta [30].
Conforme apontado por
Leal, Santos e Aoki [36], a miostatina é sintetizada pela célula muscular na
sua forma latente, sendo secretada em direção ao meio extracelular e,
consequentemente, associada a um propeptídeo, formando o complexo
propeptídeo-miostatina. No meio extracelular, este complexo é clivado,
liberando a miostina em sua forma ativa. A miostatina ativa tem condições de
vincular-se com seu receptor de membrana e, posteriormente, ativar a
sinalização cuja função é de inibir a síntese proteica com consequente
diminuição do trofismo muscular.
Uma das estratégias
que inibiria a ação hipotrófica da miostatina na célula muscular seria evitar
que ela fosse receptada, inibindo sua sinalização. Entre as diversas e
conhecidas proteínas antagonistas/bloqueadoras dos
receptores de miostatina – heterodímero ALK 4/5 (Activina I) e Activina IIB, e
os compostos que apresentam capacidade de interação com a miostatina no meio
extracelular, inibindo sua atividade biológica, reduzindo sua disponibilidade e
subsequente interação com seu receptor, destacam-se a Folistatina ou Folistatin (FS), o gene relacionado com Folistatina
ou Follistatin–related gene (FLRG) e
o Fator de crescimento e diferenciação associado a proteína sérica-1 ou Growth and differentiation Factor-associated
serum protein-1 (GASP-1) [34,37].
A miostatina age
fosforilando o receptor Activina IIB e ativando o receptor ALK 4/5-activina I,
formando um complexo receptor ativado. Na sequência, inicia-se a sinalização
intracelular por meio da ligação com uma classe de proteínas denominada Mothers
Against Decapentaplegic (MAD). As MADs, sistematicamente, formam um complexo
com outras MADs inibitórias (SMADs do tipo 2, 3 e 4). A associação da SMAD-2
com a SMAD-4 vai permitir seu transporte para o núcleo da célula, território
onde exerce o papel de um fator de transcrição que regula a expressão de
proteínas ligadas à degradação proteica, apoptose e inibição do trofismo
celular muscular. Em contraste, as SMADs do tipo 6 e,
em especial, do tipo 7 agem como antagonistas à via de sinalização da miostatina.
Kollias et al. [38] apontam que o aumento da
SMAD-7 inibe a associação da SMAD-2 com a SMAD-4 e o seu acúmulo nuclear,
respostas estas estimuladas, como descrito anteriormente, pela ação da
miostatina. Ademais, é possível afirmar que a SMAD-7, além de inibir a ação
hipotrófica sinalizada pela miostatina, acelera a iniciação e diferenciação
miogênica levando à hipertrofia celular, sobretudo por meio da interação com a
proteína MyoD.
Elinka et al. [39] apontam que a miostatina pode
ativar a via das proteínas quinases ativadas por mitógenos ou Mitogen-activated Protein Kinase (MAPK)
dos tipos p38 e ERK e inibir a sinalização da via AKT/m-TOR, o que resultaria,
ainda que por ação indireta, na diminuição da síntese proteica com consequente
hipotrofia da célula muscular.
Tanto a prática do
exercício agudo [40] como a do exercício crônico [41], exercem efeito de
regulação na expressão e ação da miostatina e/ou moléculas inibitórias que
participam de sua via sinalizadora. Desta forma, a atividade hipotrófica
muscular que é estimulada pela sinalização da miostatina é minimizada pela ação
do exercício.
Hipotrofia
muscular: vias de sinalização intracelular
Diversos autores
[2,42] apontam para o desuso do músculo estriado esquelético, sobretudo em
função de baixas sobrecargas de trabalho, como o principal fator na diminuição
da síntese e aumento da degradação proteica, acarretando em hipotrofia
muscular. Este desuso parece influenciar de forma negativa o início do processo
de tradução proteica, além de facilitar a atividade das vias proteolíticas
hipotróficas. Na sequência, serão abordados os principais mecanismos
relacionados ao processo de hipotrofia muscular.
Via de
sinalização das catepsinas ou lisossomais
As catepsinas são
proteases, dos tipos B, D, H e L, encontradas, em especial, nos lisossomos
celulares. Embora promovam proteólise, suas ações estão direcionadas para
proteínas de membrana, como receptores, transportadores e canais iônicos. As
catepsinas não agem em proteínas citosólicas, como as proteínas miofibrilares
[2]. Porém, Zhao et al. [43] relatam que a proteólise
lisossomal dependente de autofagia apresenta mecanismos mais complexos,
principalmente em função de uma autofagia aumentada por meio do fator de
transcrição FoxO3 (que será posteriormente detalhado) e uma regulação
coordenada entre os sistemas ubiquitina proteassoma ATP-dependente/UPS e
lisossomal (figura 4).

Figura
4 - Vias de sinalização de hipotrofia muscular
(ubiquitina proteassoma ATP-dependente/UPS e lisossomal) controladas pelo fator
de transcrição FoxO3, associando mecanismo
hipertrófico e hipotrófico. Adaptado de Zhao et al.
[43].
Via das
calpaínas dependentes de cálcio (Ca2+)
O sistema de
calpaínas integra o grupo de proteases de tipo cisteínas dependentes de cálcio
(Ca2+). Less et al. [44] discorrem, a partir de um
estudo desenvolvido com ratos, que uma grande depleção de glicogênio poderia
resultar na incapacidade de reabsorção do cálcio liberado pelas cisternas do
retículo sarcoplasmático, sobretudo pela diminuição nas reservas locais de ATP,
o que promoveria uma incapacidade das bombas de cálcio (caracterizadas por um
transporte ativo – dependente de ATP) funcionarem adequadamente. Sendo assim,
atividades musculares de alto volume e intensidade, poderiam estar relacionadas
com esta grande liberação de Ca2+ e consequente ativação do sistema de
calpaínas.
Goll et al. [45], em seu artigo de revisão,
relatam a presença das calpaínas 1 (m-calpaína) e 2 (µ-calpaína), além de uma
calpaína específica denominada calpaína-3 ou calpastatina, nas células
musculares estriadas esqueléticas. Embora as funções destas calpaínas nas
fibras musculares ainda não estejam descritas claramente na literatura, estes
autores citam a possibilidade do envolvimento destas calpaínas na organização
do citoesqueleto destas células. Goll et al. [45] e
Donkor [46] também evidenciam que a m-calpaína e a µ-calpaína são,
efetivamente, as proteases cálcio-dependentes, enquanto a calpastatina seria
responsável por inibir o sistema proteolítico.
Kandarian e Stevenson
[4] relatam que o aumento exacerbado na concentração sarcoplasmática de Ca2+
poderia ativar as calpaínas ligadas a linha/disco-Z,
resultando em proteólise com consequente hipotrofia muscular. As proteínas
musculares nebulina e fodrina seriam degradadas na presença das calpaínas
ativas [47], assim como a vinculina e a titina também são considerados
substratos do sistema de calpaínas [2]. Segundo Kandarian e Stevenson [4], a
clivagem da titina, proteína que mantém o alinhamento do sarcômero, permite a
liberação das proteínas miofibrilares para serem ubiquitinadas e,
posteriormente, degradadas no sistema proteassoma/UPS, uma vez que este sistema
não é capaz de degradar proteínas intactas.
Via das
caspases
As caspases (cysteine-dependent aspartate-specific
proteases ou, em português, proteases aspartato-específicas dependentes de
cisteína) inserem-se na família das proteases a base de cisteína que reconhecem
certos tetrapeptídeos (proteínas-alvo) e os clivam nos sítios próximos ao
resíduo de aspartato [48]. Segundo Nicholson [49], as caspases são essenciais
para a iniciação e execução de apoptose ou morte programada de células e no
processamento e maturação das citocinas inflamatórias.
Nos seres humanos,
foram identificados 11 diferentes tipos de caspases: a caspase-1 até a
caspases-10 e caspase-14. Várias caspases adicionais, incluindo caspase-11,
caspase-12 e caspase-13 foram detectados em outros mamíferos, tais como
roedores e a vaca Bos taurus. Estas 14 caspases encontradas nos mamíferos são
classificadas em vários grupos, de acordo com as suas relações filogenéticas e
correlacionadas funcionalmente [50]. Dois subgrupos são caracterizados como
iniciadores (caspases-2, -8, -9 e -10) e efetores (caspases-3,
-6 e -7) na via de sinalização apoptótica. Na subfamília das caspases
inflamatórias, estão incluídas as caspases-1, -4, -5,
-11, -12 e -13. A caspase-14 é única, uma vez que não pertence nem as caspases
apoptóticas e nem caspases inflamatórias. Ela é considerada uma caspase atuante
na diferenciação de queratinócitos na pele [51].
No que tange a fibra
muscular, Du et al. [2] destacam a caspase-3 que, por
meio de uma conexão entre a via de sinalização da PI3K/Akt e ativação das vias
proteolíticas, teria um importante papel na hipotrofia muscular induzida por
algumas doenças crônico-degenerativas, como o câncer e o diabetes. Kandarian e
Jackman [3] relatam que o sistema proteolítico ubiquitina-proteassoma/UPS é
capaz de degradar os filamentos de actina ou miosina, contudo, como descrito
anteriormente, este sistema não é capaz de quebrar os complexos actomiosina
intactos. Sendo assim, as caspases (em especial, a caspase-3) teriam ações
conexas àquelas das calpaínas, disponibilizando as proteínas miofibrilares para
a ubiquitinação.
Mesmo com o
desenvolvimento de diversos estudos objetivando investigar e elucidar os
mecanismos celulares mais intrínsecos, atualmente não existem
evidências mostrando o papel das caspases na hipotrofia muscular induzida pelo
desuso.
Via da
ubiquitina proteassoma ATP-dependente (UPS)
Jackman e Kandarian
[2] relatam que o proteassoma 26S, responsável pela degradação da maioria das
proteínas miofibrilares ubiquinadas decorrente da hipotrofia, caracteriza-se
por um complexo proteico constituído por uma subunidade central, denominada 20S
e duas subunidades periféricas, conhecidas como anéis, denominadas 19S.
Kandarian e Stevenson
[4] citam que o processo de ubiquitinação ocorre em função da participação de
três enzimas, denominadas: E1 ou de ativação da ubiquitina, E2 ou conjugante de
ubiquitina e a E3 ou de ligação da ubiquitina. O mecanismo proteolítico,
segundo estes autores, ocorre em função de uma ordem sequencial de etapas.
Primeiramente, a ubiquitina é ativada pela enzima E1, procedimento que
necessita de ATP. Uma vez ativada, a ubiquitina é transferida para a enzima E2.
Na sequência, a enzima E3 (enzima que esta ligada junto ao substrato proteico a
ser marcado e. em seguida, hidrolisado), se liga a enzima E2. Em continuidade
ao mecanismo, a enzima E2 transfere a ubiquitina para o substrato proteico
(alvo) ligado a E3, marcando-o para posterior clivagem (degradação) no
proteassoma. Este mecanismo ocorre repetidas vezes até que se forme uma cadeia
de quatro ou mais moléculas de ubiquitina, o que permitiria a degradação, em
peptídeos, da proteína alvo no proteassoma (Figura 5 A e B).

A.

B.
Figura
5 - A. Sistema Ubiquitina Proteassoma
ATP-dependente/UPS, promovendo mecanismos de ubiquitinação e degradação
proteica. B. Ação das enzimas E1, E2 e E3 enfatizadas no Sistema Ubiquitina
Proteassoma ATP-dependente/UPS. Adaptado de Kandarian e Stevenson [4].
Como abordado
anteriormente, o proteassoma não é capaz de degradar proteínas intactas.
Postula-se, então, que a proteólise miofibrilar, oriunda do sistema das
calpaínas [45] ou estimulada pelas caspases [52], seja exigência prévia e
fundamental para que ocorram os processos de ubiquitinação e, subsequentemente,
de degradação proteica no proteassoma 26S. Portanto, sobretudo no desuso
muscular, os sistemas das calpaínas e caspases atuariam previamente, liberando
proteínas oriundas dos sarcômeros para que, posteriormente, estas sofressem os
processos de ubiquitinação (enzimas E1, E2 e E3) e degradação no proteassoma.
Thomas e Mitch [53] e
Kandarian e Jackman [3] discorrem sobre relação entre as proteínas muscle atrophy F-box (MAFbx,
também conhecida como atrogin-1) e a muscle
ring finger 1 (MuRF-1), com a via ubiquitima proteassoma, indicando-as,
inclusive, como marcadores de proteólise da referida via.
Via FoxO (Forkhead box O)
Os fatores de
transcrição FoxO (Forkhead
box O), integram uma subfamília de um grande grupo de fatores de
transcrição denominados forkehead,
com destacado papel na homeostase celular As células dos seres humanos possuem
quatro membros desta família, FoxO1, FoxO3, FoxO4 e FoxO6, sendo todos
expressos no músculo esquelético, embora os três primeiros membros sejam os
mais estudados neste tecido [54].
Sanchez, Candau,
Bernardi [54] ainda apontam que, referente ao processo de trofismo muscular, os
FoxO1 e FOXO3 são reguladores-chave da degradação de
proteínas, uma vez que modulam a atividade de vários agentes nas vias
proteolíticas ubiquitina-proteassoma e autofágica-lisossomal, incluindo a
autofagia mitocondrial, também chamada de mitofagia.
Estes fatores de
transcrição/Foxo também têm sido implicados na regulação do mecanismo de
apoptose em fibras musculares estriadas esqueléticas [55].
A função dos Foxo é
minimizada quando os mesmos são fosforilados em seus resíduos conservados,
procedimento que os manteriam no citoplasma. Desta forma, os FoxOs,
sobretudo o FoxO1, não iriam para os núcleos das fibras musculares ativar a
expressão de diversos genes relacionados com a hipotrofia muscular, os quais se
incluem as chamadas ubiquitinas ligases: Atrogin-1 (Muscle Atrophy F-box ou MAFbx) e MuRF-1 (Muscle RING-Finger-1) [56].
Dentre vários
fatores, Sandri e colaboradores [57] citam o desuso como um importante
estimulador do mecanismo hipotrófico via FoxO,
aproveitando para apontarem, de forma abrangente, o comportamento da via FoxO a
partir da ação dos estímulos hipertróficos e hipotróficos.
O exercício físico, quer seja de força ou de endurance, propicia a condição de
ativar as vias que promoveriam a fosforilação dos FoxOs, inibindo assim, a
expressão gênica de atrogin-1 e MuRF1 [58]. Estas proteínas estão altamente
ligadas com o processo de degradação proteica [59].
Via do
TNFα (Tumor Necrosis Factor-α) e NFkB
(Nuclear Factor kappa-B)
Alguns fatores de
transcrição, como o Fator Nuclear kappa-B ou Nuclear Factor kappa-B (NFkB), desempenham
um importante papel como mediadores da imunidade e inflamação. O NFkB também é expresso no músculo esquelético, no qual
medeia o efeito de citocinas inflamatórias, particularmente do fator de necrose
tumoral-α ou Tumor Necrosis Factor-α
(TNF α), na perda de massa muscular e caquexia. Dentre os vários
processos, o complexo proteico NF-kB (composto por
cinco subunidades diferentes: p65 ou Rel 11 A, Rel B, c-Rel, p52 e p50) está
envolvido no mecanismo de hipotrofia muscular induzida pelo desuso.
No estado inativo, o
fator NFkB é sequestrado no citoplasma por uma família
de proteínas inibitórias, chamadas de IkB. Em resposta ao TNFα, o complexo
de IkB-quinases (IKKβ), fosforila o IkB,
resultando na sua ubiquitinação e degradação no proteossoma. Isso leva a
translocação nuclear de NFkB e a ativação da
transcrição de genes modulados por NFkB, como MuRF-1 [60].
Corroborando o
descrito, Cai et al. [61] apontam que a superexpressão
de IKKβ específicos do músculo em ratinhos transgênicos promove uma severa
hipotrofia muscular mediada, pelo menos em parte, por MuRF-1, mas não por
atrogin-1.
Além disto, o TNFα
e outras citocinas pró-inflamatórias também causam resistência à insulina e
supressão da via de IGF1-Akt [62]. Portanto, a fosforilação de Akt deve ser
sempre ativada quando a via NFkB é minimizada, pelo
fato da inibição de Akt contribuir substancialmente para a hipotrofia muscular.
Este conceito é apoiado pelo estudo de Mourkioti et al. [63], desenvolvido com ratos knockout de IKKβ. Estes ratos apresentaram alta resistência à
hipotrofia muscular, além de uma hiperfosforilação da molécula de Akt.
O significado da hipotrofia
muscular diminuída após diminuição da atividade de IKKβ e o grau a que
esse efeito é dependente de Akt permanecem obscuros.
No entanto, estes
resultados destacam a importância da interação entre as duas vias, e outros
estudos são necessários para elucidar as respectivas contribuições dos caminhos
de IKKβ-NFkB e Akt-FoxO na hipotrofia muscular.
O TNF relacionado à
fraca indução de apoptose ou TNF-like weak inducer of apoptosis (TWEAK) é um
membro da superfamília de TNF e foi descrito como um indutor de hipotrofia
muscular [62]. O TWEAK atua sobre as células que respondem pela ligação ao
fator-14 (Fn14), um pequeno receptor de superfície celular. O Fn14 é regulado
positivamente nos músculos desnervados, permitindo a ativação do NFkB e, consequentemente, a expressão de MuRF1 (mas não
atrogin-1).
Outro importante
sinalizador positivo de NFkB em célula muscular é uma
ubiquitina ligase denominada fator associado ao receptor de TNF do tipo 6 ou TNF receptor-associated factor 6
(TRAF6), tendo importante papel na ativação da via NFkB por diversos estímulos,
entre eles o jejum [64]. Estes mesmos autores também relatam que por meio do
TRAF6, ocorre indução da hipotrofia muscular pela ativação da via FOXO3 e da
via AMPK nos músculos em jejum, além da ativação dos sistemas proteolíticos:
ubiquitina-proteassoma e autofagia-lisossomal.
Via dos
glicocorticoides
Glicocorticoides é a
denominação de uma família de hormônios esteroides produzidos,
preferencialmente, na zona fasciculada do córtex da glândula adrenal ou
suprarrenal. O principal representante desta família, em seres humanos, é o
hormônio cortisol.
É fato inconteste que
a concentração de glicocorticoides é aumentada em muitas condições patológicas
associadas com a perda de massa muscular.
Não obstante, é
sabido que o tratamento com glicocorticoides induz ao aumento da expressão de
atrogin-1 e MuRF1, resultando em hipotrofia de células
musculares em cultivo (in vitro) e in vivo [65,66]. Os mecanismos de
hipotrofia muscular modulados pelos glicocorticoides foram recentemente
desvendados [67]. Uma vez no núcleo da fibra muscular estriada esquelética, o
receptor de glicocorticoide ativa a expressão de dois genes alvo: o Regulated in development and DNA damage-1
(REDD1) e o Kruppel-like factor-15
(KLF15) [68]. O REDD1 inibe a atividade da mTOR, por
promover o aumento da atividade das TSC1 e TSC2. Hayasaka et al. [69] relatam que o exercício de endurance induz o aumento da expressão gênica de REDD1,
sinalizando, consequentemente, uma inibição da atividade de mTORC1, fato este
que poderia estar relacionado com os efeitos “anti-hipertróficos” do hormônio
cortisol. A inibição da mTOR é permissiva para a
ativação de um programa de hipotrofia através do KLF15. De fato, a ativação de mTOR atenua a hipotrofia muscular induzida por
glicocorticoides. KLF15 é um fator de transcrição que está envolvido em vários
processos metabólicos no músculo esquelético como, por exemplo, na regulação
positiva da aminotransferase de cadeia ramificada 2 (BCAT2).
O KLF15 participa também do catabolismo muscular regulando a transcrição gênica
de FoxO1, Atrogin-1 e MuRF1. Além disso, o KLF15 afeta
negativamente a mTOR através de regulação positiva de
BCAT2 que, por sua vez, induz a degradação de aminoácidos de cadeia ramificada.
Waddell et al. [70] relatam que FOXO1 e receptores
de glicocorticoides cooperaram mutuamente para ativar a expressão MuRF1.
Conclusão
Postula-se que os
processos de hipertrofia e hipotrofia muscular estão diretamente relacionados
ao turnover proteico muscular. É importante apontar que as vias de síntese e
degradação proteica ocorridas na célula muscular estriada esquelética são
estimuladas por diversos sinais extracelulares controlados, como por hormônios,
citocinas, fatores de crescimento, potenciais de ação (estímulos neurais) e,
com destaque, pela prática do exercício físico agudo e crônico. Assim sendo, o
objetivo deste estudo de revisão foi elucidar as principais vias envolvidas nos
processos de hipertrofia e hipotrofia muscular, relacionando-as com os diversos
tipos de exercício e treinamento físico.
Muito embora a
literatura apresente diversas informações sobre as vias de sinalização
promotoras dos processos de hipertrofia e hipotrofia nas células musculares
estriadas esqueléticas e alta relação com a otimização
de algumas destas vias pela prática aguda e crônica do exercício físico, a
relação de algumas outras vias com o exercício físico, sobretudo com os
diversos tipos de exercício – moderado e intenso, de força e resistência
muscular, resistidos e não resistidos, com predomínio do metabolismo aeróbio e
com alta participação do metabolismo anaeróbio, entre outros – ainda se mostra
pouco esclarecedora, necessitando de estudos mais aprofundados para um maior
entendimento.
Referências
- Fernandes T, Soci
UPR, Alves CR, Carmo EC, Barros JG, Oliveira EM. Determinantes moleculares da
hipertrofia do músculo esquelético mediados pelo treinamento físico: Estudo de
vias de sinalização. Revista Mackenzie de Educação Física e Esporte 2008; 7(1):169-188.
- Jackman RW, Kandarian
SC. The molecular basis of skeletal muscle atrophy. Am J Physiol, Cell Physiol 2004;287(4):834-43.
- Kandarian SC, Jackman RW. Intracellular
signaling during skeletal muscle atrophy. Muscle Nerve 2006;33(2):155-65.
- Kandarian SC, Stevenson EJ. Molecular events in
skeletal muscle during disuse atrophy. Exerc Sport Sci Rev 2002;30(3):111-6.
- Goldberg AL, Etlinger JD, Goldspink
DF, Jablecki C. Mechanism of work-induced hypertrophy
of skeletal muscle. Med Sci Sports 1975;7(3):185-98.
- Denny-Brown D. Experimental studies pertaining to hypertrophy hypertrophy, regeneration and degeneration. Neuromuscular
Disorders 1961;38:147-196.
- Goldspink NM. The combined effects of exercise and reduced food intake on
skeletal muscle fibers. J Cell Comp Physiol
1964;63:209-16.
- Manning BD, Cantley LC. AKT/PKB signaling: navigating downstream. Cell 2007;129:1261-74.
- Schiaffino S, Mammucari C. Regulation of skeletal muscle growth by the
IGF1-Akt/PKB pathway: insights from genetic models. Skelet
Muscle 2011;24(1):1-4.
- Heitman J, Movva NR, Hall MN. Targets for cell cycle arrest by the
immunosuppressant rapamycin in yeast. Science 1991;253:905-9.
- Jung CH, Ro SH, Cao J, Otto NM, Kim DH. Mtor regulation of autophagy. FEBS Lett 2010;584(7):1287-95.
- Zoncu R, Efeyan
A, Sabatini DM. mTOR: from growth signal integration
to cancer, diabetes and ageing. Nat Rev Mol Cell Biol 2011;12:21-35.
- Watson K, Baar K. mTOR
and the health benefits of exercise. Semin Cell Dev Biol 2014; 36:130-9.
- Hoppeler H, Baum O, Lurman G, Mueller M. Molecular mechanisms of muscle
plasticity with exercise. Compr Physiol
2011;1(3):1383-412.
- Athersos PJ, Barbra J, Smith
J, Singh M, Renne J, Wackerhage
H. Selective activation of AMPK-PGG-lalpha or
PKB-TSC2-mTOR signaling can explain adaptive responses to endurance or
resistance training-like electrical muscle stimulation. FASEB J 2005;19:786-8.
- Apró W, Moberg
M, Hamilton DL, Ekblom B, van Hall G, Holmberg HC, Blomstrand E. Resistance exercise-induced S6K1 kinase
activity is not inhibited in human skeletal muscle despite prior activation of
AMPK by high-intensity interval cycling. Am J Physiol
Endocrinol Metab 2015;308(6):E470-81.
- Vissing K, McGee S, Farup J, Kjølhede T, Vendelbo M, Jessen N. Differentiated mTOR
but not AMPK signaling after strength vs. endurance exercise in
training-accustomed individuals. Scand J Med Sci Sports 2013;23(3):355-66.
- Foschini RMSA, Ramalho FS, Bicas
HEA. Células satélites musculares. Arq Bras Oftalmol 2004;67(4):681-7.
- Mauro A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol 1961;9(2):493-5.
- Allen DL, Roy RR, Edgerton VR. Myonuclear domains in muscle adaptation and disease. Muscle Nerve 1999;22:1350-60.
- Hawke TJ, Garry DJ. Myogenic satellite cells: physiology to molecular
biology. J Appl Physiol
2001;91( 2):534-51.
- Tatsumi R, Sheehan SM,
Iwasaki H, Hattori A, Allen RE. Mechanical stretch induces activation of
skeletal muscle satellite cells in vitro. Exp Cell
Res 2001;267(1):107-14.
- Anderson JE. A role for nitric
oxide in muscle repair: nitric oxide-mediated activation of muscle satellite
cells. Mol Biol Cell 2000;11:1859-74.
- Tidball JG. Inflammatory
processes in muscle injury and repair. Am J Physiol Regul Integr Comp Physiol 2005;288(2):R345-53.
- Verdijk LB, Gleeson BG, Jonkers RA, Meijer K, Savelberg
HH, Dendale P, van Loon LJ. Skeletal muscle
hypertrophy following resistance training is accompanied by a fiber
type-specific increase in satellite cell content in elderly men. J Gerontol A Biol Sci
Med Sci 2009;64(3):332-9.
- Pierine DT, Nicola M,
Oliveira EP. Sarcopenia: alterações metabólicas e consequências no
envelhecimento. RBCM 2009;17(3):96-103.
- Vega RB, Bassel-Duby R, Olson EN. Control of cardiac growth and function by calcineurin signaling. J Biol
Chem 2003;278(39):36981-4.
- Sakuma K, Yamaguchi A. The functional role of calcineurin in hypertrophy, regeneration, and disorders of
skeletal muscle. J Biomed Biotechnol 2010;1-8.
- Hudson MB, Price SR. Calcineurin: a poorly
understood regulator of muscle mass. Int J Biochem Cell Biol 2013;45(10):2173-8.
- McPherron AC, Lawler AM, Lee
SJ. Regulation of skeletal muscle mass in mice by a new
TGF-beta superfamily member. Nature 1997;387:83-90.
- Argilés JM, Orpí M,
Busquets S, López-Soriano FJ. Myostatin: more than just a
regulator of muscle mass. Drug Discov Today 2012;17(13-14):702-9
- McFarlane C, Langley B, Thomas M, Hennebry A,
Plummer E, Nicholas G et al. Proteolytic processing of myostatin
is auto-regulated during myogenesis. Dev Biol 2005;283(1):58-69.
- McMahon CD, Popovic L, Jeanplong
F, Oldham JM, Kirk SP, Osepchook CC, et al. Sexual
dimorphism is associated with decreased expression of processed myostatin in males. Am J Physiol Endocrinol Metab 2003;284(2):E377-81.
- Lee SJ. Regulation of muscle mass by myostatin. Annu Rev Cell
Dev Biol. 2004;20:61-86.
- Schuelke M, Wagner KR, Stolz LE, Hubner C, Riebel T, Komen W, et al. Myostatin
mutation associated with gross muscle hypertrophy in a child. N Engl J Med 2004;350(26):2682-8.
- Leal ML, Santos AR,
Aoki MS. Adaptações moleculares ao treinamento de força: recentes descobertas
sobre o papel da miostatina. Revista Mackenzie de Educação Física e Esporte 2008;7(1):161-7.
- Tsuchida K. Activins, myostatin and related
TGF-beta family members as novel therapeutic targets for endocrine, metabolic
and immune disorders. Curr Drug Targets Immune Endocr Metabol Disord 2004;4(2):157-166.
- Kollias HD, Perry RL, Miyake
T, Aziz A, McDermott JC. Smad7 promotes and enhances skeletal muscle
differentiation. Mol Cell Biol
2006;26(16):6248-60
- Elkina Y, von Haehling S, Anker SD, Springer J. The role of myostatin in muscle wasting: an
overview. J Cachexia Sarcopenia Muscle 2011;2(3):143-151.
- Pugh JK, Faulkner SH, Jackson AP, King JA, Nimmo
MA. Acute molecular responses to concurrent resistance
and high-intensity interval exercise in untrained skeletal muscle. Physiol Rep 2015;3(4):E12364.
- Santos AR, Lamas L,
Ugrinowitsch C, Tricoli V, Miyabara EH, Soares AG, Aoki MS. Different resistance-training regimens evoked a similar increase in myostatin inhibitors expression. Int
J Sports Med 2015;36(9):761-8.
- Baar K, Nader G, Bodine S. Resistance
exercise, muscle loading/unloading and the control of muscle mass. Essays in Biochem 2006;42:61-74.
- Zhao J, Brault JJ, Schild
A, Goldberg AL. Coordinate activation of autophagy and the proteasome pathway
by FoxO transcription factor. Autophagy 2008;4(3):378-80.
- Lees SJ, Franks PD, Spangenburg EE, Williams
JH. Glycogen and glycogen phosphorylase associated with sarcoplasmic reticulum:
effects of fatiguing activity. J Appl Physiol 2001;91:1638-44.
- Goll DE, Thompson VF, Li H, Wei W,
Cong J. The calpain system. Physiol Rev 2003;83:731-801.
- Donkor IO. Calpain
inhibitors: a survey of compounds reported in the patent and scientific
literature. Expert Opin Ther
Pat 2011;21:601-36.
- Vermaelen M, Sivebt P, Raynaud P, Astier C,
Mercier J, Lacampagne A, Cazorla
O. Differential localization of autolyzed calpains 1
and 2 in slow and fast skeletal muscles in the early phase of atrophy. Am J Physiol Cell Physiol 2007;292(6):C1723-31.
- Sakamaki K, Satou Y. Caspases: evolutionary aspects of their functions
in vertebrates. J Fish Biol 2009;74(4):727-53.
- Nicholson DW. Caspase structure, proteolytic substrates, and function
during apoptotic cell death. Cell Death Differ 1999;6:1028-42.
- Lamkanfi M, Declercq W, Kalai M, Saelens X, Vandenabeele P. Alice
in caspase land. A phylogenetic analysis of caspases from
worm to man. Cell Death Differ 2002;9:358-61.
- Lippens S, Kockx M, Knaapen M, Mortier L, Polakowska R, Verheyen A et al. Epidermal differentiation does not
involve the pro-apoptotic executioner caspases, but is associated with
caspase-14 induction and processing. Cell Death Differ 2000;7:1218-24.
- Du J, Wang X, Meireles C, Bailet
JL, Debigare R, Zheng B et al. Activation of
caspase-3 is an initial step triggering accelerated muscle proteolysis in
catabolic conditions. J Clin Invest 2004;113(1):115-23.
- Thomas SS, Mitch WE. Mechanisms
stimulating muscle wasting in chronic kidney disease: the roles of the
ubiquitin-proteasome system and myostatin. Clin Exp Nephrol
2013;17(2):174-82.
- Sanchez AM, Candau RB, Bernardi
H. FoxO transcription factors: their roles in the
maintenance of skeletal muscle homeostasis. Cell Mol
Life Sci 2014;71(9):1657-71.
- McLoughlin TJ, Smith SM, DeLong
AD, Wang H, Unterman TG, Esser
KA. FoxO1 induces apoptosis in skeletal myotubes in a
DNA-binding-dependent manner. Am J Physiol Cell Physiol 2009;297(3):C548-55.
- McClung JM, Kavazis AN, Whidden
MA, DeRuisseau KC Falk DJ, Criswell DS et al.
Antioxidant administration attenuates mechanical ventilation-induced rat
diaphragm muscle atrophy independent of protein kinase B (PKB–Akt) signaling. J Physiol 2007;585(1): 203–215.
- Sandri M, Sandri C, Gilbert A, Skurk C,
Calabria E, Picard A, Walsh K, Schiaffino S, Lecker SH, Goldberg AL. FoxO
Transcription Factors Induce the Atrophy-Related Ubiquitin Ligase Atrogin-1 and
Cause Skeletal Muscle Atrophy. Cell 2004;117(3):399–412.
- Kanzleiter T, Rath M, Görgens SW, Jensen J, Tangen DS, Kolnes AJ, Kolnes KJ, Lee S, Eckel J, Schürmann A, Eckardt K. The myokine decorin is regulated by
contraction and involved in muscle hypertrophy. Biochem
Biophys Res Commun 2014;450(2):1089-94.
- Gumucio JP, Mendias CL. Atrogin-1, MuRF-1, and
sarcopenia. Endocrine.
2013;43(1):12-21
- Peterson JM, Bakkar N, Guttridge
DC. NF-kB
signaling in skeletal muscle health and disease. Curr
Top Dev Biol 2011;96:85–119.
- Cai D, Frantz JD, Tawa NE, Jr Melendez PA, Oh BC, Lidov
HG, Hasselgren PO, Frontera
WR, Lee J, Glass DJ et al. IKKbeta/NF-kappaB activation causes severe muscle wasting in mice.
Cell 2004;119:285–98.
- Dogra C, Changotra H, Wedhas
N, Qin X, Wergedal JE, Kumar A. TNF-related weak
inducer of apoptosis (TWEAK) is a potent skeletal muscle-wasting cytokine.
FASEB J 2007;21:1857-69.
- Mourkioti F, Kratsios P, Luedde T, Song YH, Delafontaine P, Adami R, Parente V, Bottinelli R, Pasparakis M, Rosenthal N. Targeted ablation of IKK2
improves skeletal muscle strength, maintains mass, and promotes regeneration. J
Clin Invest 2006;116(11):2945-54.
- Paul PK, Bhatnagar S, Mishra V, Srivastava S, Darnay
BG, Choi Y, Kumar A. The E3 ubiquitin ligase TRAF6 intercedes in
starvation-induced skeletal muscle atrophy through multiple mechanisms. Mol Cell Biol 2012;32:1248-59.
- Clarke BA, Drujan D, Willis MS, Murphy LO, Corpina RA, Burova E, et al.The E3 Ligase MuRF1 degrades myosin heavy chain protein
in dexamethasone-treated skeletal muscle. Cell Metab
2007;6:376-85.
- Schakman O, Gilson H, Thissen JP. Mechanisms of
glucocorticoid-induced myopathy. J. Endocrin 2008;197:1-10.
- Bonaldo P, Sandri M.
Cellular and molecular mechanisms of muscle atrophy. Dis Model Mech 2013;6(1):25-39.
- Shimizu N, Yoshikawa N, Ito N, Maruyama T, Suzuki Y, Takeda S et al.
Crosstalk between glucocorticoid receptor and nutritional sensor mTOR in skeletal muscle. Cell Metab
2011;13:170-82.
- Hayasaka M, Tsunekawa H, Yoshinaga M,
Murakami T. Endurance exercise induces REDD1 expression and transiently decreases
mTORC1 signaling in rat skeletal muscle. Physiol Rep
2014;2(12):E12254.
- Waddell DS, Baehr LM, van den Brandt J,
Johnsen SA, Reichardt HM, Furlow
JD et al. The glucocorticoid receptor and FOXO1 synergistically activate the
skeletal muscle atrophy-associated MuRF1 gene. Am J Physiol Endocrinol
Metab 2008;295: E785-97.